运用无标记定量蛋白质组学技术分析AURKB介导骨肉瘤恶性表型的分子机制
2019-04-25皮闻森刘家明黄山虎
皮闻森,刘家明,黄山虎
(南昌大学第一附属医院骨科 330006)
骨肉瘤(osteosarcoma,OS)是最常见的原发性恶性骨肿瘤,多发于儿童和青少年。虽然新辅助化疗药物使用后患者生存率有所提高(55%~80%),但是5年生存率未见提高。并且发生肺部转移的患者5年生存率低于20%,肺转移是OS患者的主要死亡原因[1]。因此,阐明OS转移的分子机制为骨肉瘤转移的防治提供有效的策略及靶点,提高生存率是非常必要的。研究表明AURKB 在多种恶性肿瘤中高表达与肿瘤发生发展及转移密切相关[2]。笔者前期研究表明AURKB高表达与OS肺部转移呈正相关,并促进OS细胞增殖、迁移及侵袭[3]。然而,AURKB促进OS细胞增殖、迁移及侵袭的分子机制尚不清楚。本研究采用慢病毒转染、无标记定量蛋白质组学技术筛选差异表达蛋白,结合生物信息学分析,预测AURKB促进OS恶性表型的关键蛋白和潜在的分子调控机制,为进一步探讨AURKB促进OS转移分子机制奠定基础。
1 材料与方法
1.1实验材料 人OS细胞143B购自中国科学院上海细胞库,AURKB-shRNA慢病毒(Lv-shAURKB)和阴性对照慢病毒(Lv-negative)购于上海吉凯基因化学技术有限公司。cDNA 第一链合成试剂盒及 PCR 试剂盒购于天根生化科技(北京)有限公司。总蛋白提取试剂盒(BB-3101)购自上海BestBio公司。凝胶制备试剂盒(AR018)购自武汉博士德生物技术公司。AURKB 单克隆抗体(兔抗人)购自美国Abcam公司。β-actin 单克隆抗体(鼠抗人)、HRP标记山羊抗兔多克隆抗体和HRP标记山羊抗鼠多克隆抗体购自北京中杉金桥公司。高分辨质谱仪Q-Exactive和液相色谱均购自美国Thermo Fisher公司。
1.2方法
1.2.1细胞转染 细胞分组:D组为Lv-shAURKB转染细胞组,C组为阴性对照组(转染Lv-negative)。按照上海吉凯基因化学技术有限公司提供的慢病毒转染说明书进行转染,转染前1天以2×104/mL细胞悬液接种6孔板,每孔总体积为2 mL,在 5% CO2,37 ℃条件下培养。依照感染复数50,每组3个孔,铺板24 h后,分别加入Lv-shAURKB慢病毒和 Lv-negative慢病毒 2 μL,混匀后继续培养。转染后 12 h换DMEM培养基常规培养。感染48 h后观察慢病毒侵染结果,消化转移细胞至50 mL培养瓶中,以含0.25 μg/mL嘌呤霉素的DMEM完全培养基连续培养2周,得到稳定细胞系。不同时间重复实验3次。
1.2.2蛋白质谱
1.2.2.1蛋白还原烷基化及酶解上机 用细胞刮刀刮取收集细胞,加入裂解液苯甲基磺酰氟(PMSF),超声3 min后于冰上裂解30 min。高速离心15 min(4 ℃,15 000 r/min),取上清。蛋白采用500 mmol/L三乙胺碳酸(TEAB)缓冲液重溶。使用BCA蛋白试剂盒测定上清液中的蛋白浓度,随后将各个样品100 μg转移到新试管中,用8 mol/L 尿素调至100 μL定容。加入11 μL 1× MDTT并在37 ℃下温育1 h,然后将样品加到10 K超滤管14 000×g离心10 min后,加入120 μL 55 mmol/L碘乙酰胺,在室温下避光温育20 min。在超滤管中用100 mmol/L TEAB 连续离心3次置换Urea 体系后,用1∶50的胰蛋白酶酶解过夜。
1.2.2.2液质联用质谱(LC-MS/MS)上机测定 将冻干后的肽段重溶于30 μL溶剂A(A:0.1%甲酸水溶液)后用nano-LC分离,经在线电喷雾串联质谱分析。实验在Nano ACQUITY UPLC系统(Waters Corporation公司,Milford,MA,美国)上进行,系统连接装有在线Nano电喷雾离子源的Q-Exactive 质谱仪(Thermo Fisher Scientific,MA,美国)。10 μL肽段样品以10 μL/min流量上样到捕集柱(Thermo Scientific Acclaim PepMap C18,100 μm × 2 cm),随后在分析柱(Acclaim PepMap C18,75 μm × 15 cm)中以线性梯度分离120 min内3% B至32% B(B:0.1%甲酸ACN溶液)。柱子在初始条件下平衡10 min。柱流量控制在300 μL/min,电喷雾电压2 kV。Q-Exactive质谱仪在数据依赖采集模式下运行,自动在MS和MS/MS采集间切换。在70 K质量分辨率下获得全扫描谱图(m/z 300~1 800),随后在17.5 K分辨率下进行后续HCD MS/MS扫描。动态排除时间10 s。
1.2.2.3数据库的检索 串联质谱图经过PEAKS Studio version 8.5(Bioinformatics Solutions公司,Waterloo,加拿大)分析。PEAKS DB对swiss prot-human数据库(ver.201604,20191 entries)搜库,设置胰蛋白酶酶解。搜库参数碎片离子质量容许误差:0.05,母离子质量容许误差:7 ppm,最大漏切数:2,固定修饰:Carbamidomethylation 57.02,可变修饰:Oxidation(M)15.99,Deamidation(NQ)0.98,Acetylation(Protein N-term)42.01。肽段经过1% FDR 和 1 unique peptide质控过滤。筛选差异倍数1.5以上,具有2条unique 肽段,根据ANOVA算法取P<0.05的蛋白作为差异蛋白。
1.2.3生物信息分析 使用pheatmap软件(https://CRAN.R-project.org/ package=pheatmap)完成构建聚类分析热图,使用ggplot2软件(http://ggplot2.org)构建火山图,运用Blast2GO v.4进行GO功能分析,差异蛋白的功能统计使用Fisher′s精确测试进行检验计算。运用 KOBAS(http://kobas.cbi.pku.edu.cn/)进行KEGG通路富集分析,并使用STRING分析构建PPI网络。聚类分析是一组将研究对象分为相对同质的群组的统计分析技术,分析通过pheatmap软件生成聚类热图。火山图是在x,y轴上表示倍数变化及P值的散点图,根据显著性变化的阈值为分界线可以看出数据分布情况。
2 结 果
2.1聚类热图和火山图 慢病毒转染后收集细胞经无标记定量蛋白组学技术处理,共筛选到了105个差异表达蛋白,见图1。
A:聚类热图;B:火山图
图1 聚类热图和火山图
2.2GO分析结果 共计生物学过程773条,细胞组成156条,分子功能122条。前20个条目差异蛋白主要参与单生物体细胞器组织和细胞骨架组织的生物学过程;发挥RNA结合和肌动蛋白依赖性ATP酶活性的分子功能;主要定位于细胞质和膜界限的细胞器。见图2。
2.3KEGG分析 KEGG分析显示涉及150条,前20个条目见表1。差异蛋白富集的主要信号通路有肌动蛋白细胞骨架的调节、局部黏着和RNA运输等。

表1 KEGG分析结果(前20条信号通路)
2.4PPI网络图 以degree≥9筛选节点蛋白,即核心蛋白。显示的核心蛋白有:ACTN4(degree=9)、TPR(degree=9)和ACLY(degree=16)。若删除这些核心蛋白后,网络结构的稳定性降低。见图3。
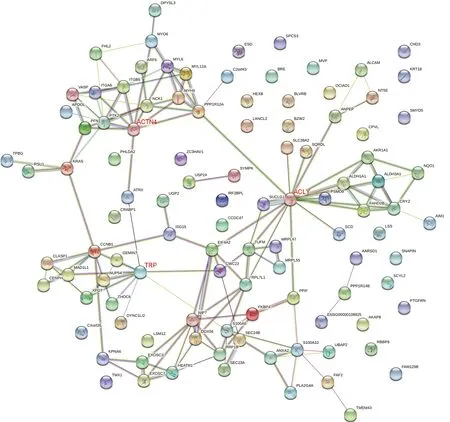
图3 差异蛋白的PPI网络图
3 讨 论
无标记定量蛋白质组学技术应用于各种癌症的研究[4],发现了与癌症相关的蛋白,可用于癌症的诊断、治疗和预防,同时阐明癌症发生的分子机制,让人们从致病机制上认识癌症,理解其致病的分子网络图。本研究将无标记定量蛋白组学技术用于OS中单个癌基因AURKB介导OS恶性表型的研究。共鉴定到105个差异表达蛋白,在PPI网络图中,核心蛋白包括ACTN4、TRP和ACLY。从GO分析和KEGG通路富集分析的结果来看,差异蛋白主要参与细胞骨架调节的生物学过程和起到调节肌动蛋白依赖性ATP酶活性的分子功能,主要富集的通路为肌动蛋白细胞骨架的调节。
细胞骨架是细胞内不同蛋白质纤维的聚合物和各种调控蛋白交错连接的网络结构,在维持真核细胞的形态、胞内运输和变形运动等方面发挥着重要作用。肿瘤细胞与正常细胞的细胞骨架有明显的差异,细胞骨架的异常改变已成为反映肿瘤细胞的恶性生物学行为的特征之一。细胞骨架的重组影响着细胞的迁移,而肿瘤细胞迁移能力是其转移主要因素之一[5]。差异蛋白中涉及细胞骨架调节的有ACTN4、PFN、MLC、PPP1R12A等,其中ACTN4是PPI网络图中的核心蛋白。ACTN4是一 种 非 肌 肉 的 细 胞 骨 架 蛋 白,参与细胞骨架重组,细胞质分裂,调节细胞黏附及形态,与多种肿瘤细胞的侵袭、迁移有关,包括乳腺癌细胞[6]和肝癌细胞[7]等。在肌动蛋白细胞骨架的调节通路中,ACTN4的激活与Rho/ROCH的活性有关[8]。Rho是一种的GTP酶,属于Rho-GTPase家族,而Rho GTPases家族是Ras超家族的一个亚家族,也是细胞骨架调节通路中的一部分[9]。因此,笔者推测AURKB可能通过Rho/ROCH-ACTN4信号通路介导骨肉瘤的侵袭、迁移。
ACLY是ATP柠檬酸裂解酶,是脂肪酸生物合成过程中的关键酶,是糖代谢和脂肪酸合成的连接点。ACLY 位于脂质代谢通路最上游,其催化产生的乙酰 CoA 是合成脂肪酸和胆固醇等脂类物质的主要原料,能提高脂肪酸合成酶(FASN)的活性[10]。下调ACLY表达能抑制肿瘤细胞的增殖[11]。据报道,ACLY受到PI3K-Akt信号通路的调控,Akt还能通过激活胆固醇调节元件结合蛋白 1(SREBP-1)上调ACLY mRNA水平[12]。SREBP-1是脂质代谢重要的核转录因子之一,主要调控脂肪酸、三酰甘油和胆固醇的生物合成[13]。另外,SREBP-1能够与FASN启动子上的SREBP结合位点E-box序列强烈结合,通过 Akt-(SREBP-1)-FASN 信号通路使得FASN的表达增加[14]。笔者前期的研究已经证实抑制FASN可通过PI3K/Akt信号通路降低OS细胞的恶性表型[15],相反,Akt的抑制亦能降低FASN的活性[16]。目前的研究并未证实AURKB与FASN之间是否存在相关性。因此,笔者推测ACLY可能是AURKB与FASN协同调控的连接点,AURKB可能通过PI3K/Akt-(SREBP-1)-ACLY/FASN信号通路介导骨肉瘤的恶性表型。
TRP是一种瞬时受体电位阳离子通道蛋白,是一种参与离子转运的蛋白质。TRP通道可以作为细胞内外刺激,诸如缺氧等的传感器和效应器,从而介导相应的细胞反应,这些细胞反应常常涉及升高的迁移活性和/或细胞因子的产生和分泌[17]。TRP参与了多种肿瘤细胞的迁移和侵袭,包括胃癌[18]和前列腺导管癌[19]等。研究报道,TRP通过ERK/NF-κβ介导肿瘤细胞恶性表型,通过ERK介导capase-3级联反应拮抗细胞凋亡[20]。但是TRP在OS中的作用机制未见相关报道。笔者推测TRP/ERK/NF-κβ信号通路可能同样在AURKB介导OS的侵袭、转移中发挥作用,但有待后续实验进一步研究。
综上所述,AURKB可能通过3条信号通路介导骨肉瘤恶性表型,即:Rho/ROCH-ACTN4信号通路、PI3K/Akt-(SREBP-1)-ACLY/FASN信号通路和TRP/ERK/NF-κβ信号通路。本研究为进一步研究AURKB促进OS恶性表型的分子机制提供了方向。尽管无标记定量蛋白组学技术有助于丰富和识别与疾病有关的机制,然而这些关键基因的确切功能还需要今后更大样本量的实验研究。
