miR-193a在肝癌中的表达水平及临床意义
2019-04-25李宝华戈海泽刘树业
李宝华,戈海泽,刘树业
(天津市第三中心医院检验科 300170)
肝细胞癌(hepatocellular carcinoma,HCC)是一种全球常见的恶性肿瘤,也是致死率排名第3的肿瘤,不良预后和高发病率使它成为世界关注的恶性肿瘤之一[1-2]。目前,临床上对于早期肝癌的治疗方式主要有手术切除和原位肝移植这两种,但这些疗法存在很大的局限性,只对部分患者适用,而且也未能达到预期的疗效[3-4]。因此,临床上需要治疗肝癌的新策略。
肝癌的发病机制是一个极其复杂的过程;研究表明一些致病因子可促使慢性肝炎进一步恶化,并伴随有基因表达水平和表观遗传修饰的改变,这很可能是导致抑癌基因沉默和原癌基因激活的主要原因;在肝癌发生发展的过程中某些微RNAs(microRNA,miRNAs)的表达水平也变得异常[5-6]。目前,很多研究想通过基因疗法来得到可靠的癌症检测指标和治疗靶点;但是,这些分子标志物由于很多原因在临床上并没用被广泛应用[7];因此,这些不足更促使医学者们想进一步地了解肝癌的发病机制。
miRNA是一类广泛存在于动植物中的单链非编码的小RNA,由内源基因编码,长度在18~22个核苷酸,其主要作用于基因的转录后调控。研究表明,在肿瘤相关的疾病中,miRNA对细胞的增殖、分化、凋亡、迁移和侵袭等起重要的调控作用[8],miRNA的表达差异造成了肿瘤的发展变化。因此,miRNA在癌症研究方面具有非常重要的意义[9-10]。已有研究发现,miR-214[11]和miRNA-491-5p[12]等表达的失调与肝癌的发生发展有着密切的联系。miRNA可靶向作用特定的抑癌或致癌基因,通过改变它们的表达量来调控肝癌的进程[10]。本试验主要探讨miR-193a在肝癌组织和癌旁组织中的表达水平,以及其对肝癌细胞Huh7的增殖、迁移、侵袭能力及KRAS表达的影响。
1 材料与方法
1.1材料 本研究中的肝癌组织和其配对的癌旁组织均取自本院检验科。所有标本的获取都经过患者的知情同意,并且得到本院医学伦理道德委员会的批准。术后立即将标本置于液氮罐内备用。人肝癌细胞Huh7购自上海奥陆生物科技有限公司。DMEM培养基和胎牛血清均购于美国HyClone公司;胰酶购于日本Taraka公司;转染试剂Lipofectamine 2000、TRIzol试剂和反转录试剂盒均购于美国Invitrogen 公司;CCK-8购于上海碧云天生物有限公司;实时荧光定量 PCR试剂盒购于瑞士Roche公司;蛋白裂解液RIPA购于北京普利莱基因技术有限公司;KRAS和GAPDH抗体购于美国Cell Signaling Technology公司。
1.2方法
1.2.1细胞培养和转染 Huh7细胞用含有10%胎牛血清,100 U/mL青、链霉素的DMEM培养基,置于37 ℃、5% CO2的细胞培养箱中培养。取对数生长期细胞,分别按照6孔板5×104/孔或者96孔板5×103/孔的量铺板,18~24 h后按照Lipofectamine 2000试剂盒说明书转染,分为miR-NC和miR-193 mimics组,按既定的时间做相关的试验。
1.2.2CCK-8检测细胞增殖 细胞转染0、24、48、72 h后每孔加入10 μL CCK-8试剂,避光培养2 h后测定450 nm处吸光度(OD)值,细胞活性按照CCK-8试剂盒说明书计算并作图。
1.2.3集落形成试验 Huh7细胞转染24 h后收集并计数,按照500/孔的数量接种在12孔板内,每3天更换培养基1次,大约2周后处理细胞。先用1×PBS清洗1遍,再用结晶紫染料染色并计数。
1.2.4细胞迁移试验 Huh7细胞转染24 h后,将miR-NC和miR-193 mimics组细胞用无血清的DMEM重悬,各取200 μL加到Transwell小室中,每孔5×104个Huh7细胞,下室加600 μL含有20%胎牛血清的DMEM培养基,每组设3个复孔,48 h后用4%的多聚甲醛室温固定并用0.1% 结晶紫染色,拭去未迁移的细胞后拍照并计数。
1.2.5细胞侵袭试验 用无血清DMEM以1∶8的比例稀释Matrigel,用预冷的枪头吸100 μL加到Transwell 小室中,在细胞培养箱放置1 h使之聚合。后续试验步骤同细胞迁移试验。
1.2.6实时荧光定量PCR检测miR-193a mRNA和KRAS mRNA的表达水平 患者组织加液氮研磨后用TRIzol法提取总RNA。转染后的细胞经过48 h后用TRIzol法提取总RNA。用分光光度计检测总RNA的纯度。合格后反转录成cDNA,以U6为内参进行荧光定量PCR分析,试验步骤按照试剂盒说明书进行。试验中所需的引物序列如下:miR-193a 正向引物5′-GTC GTA TCC AGT GCA GGG TCC GAG GTG CAC TGG ATA CGA CTC ATC TC-3′;反向引物:5′-TGC GGT GGG UCA AAG CGG GC-3′;U6正向引物:5′-TGC GGG TGC TCG CTT CGG CAGC-3′;U6反向引物:5′-TGC GGG TGC TCG CTT CGG CAG C-3′;U6-RT:5′-GTC GTA TCC AGT GCA GGG TCC GAG GTA TTC GCA CTG GAT ACG ACA AAA TAT GGA AC-3′;Oligo-dT:5′-TTT TTT TTT TTT TTT TTT-3′;KRAS正向引物5′-GGG TGT TGA TGA TGC CTT CT-3′;KRAS反向引物5′-TAC TGG CAC TTA GAG GAA-3′。
1.2.7Western blot检测KRAS蛋白的表达水平 细胞收集后用1×PBS洗1遍,加入RIPA裂解液重悬后冰上裂解30 min,中间再混匀1次,4 ℃、12 000 r/min离心10 min,收集上清液,用BCA蛋白浓度定量试剂盒完成浓度检测。变性后的蛋白用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转移到聚偏氟乙烯(PVDF)膜,5%的脱脂奶粉室温封闭1 h,加一抗(1∶1 000)4 ℃敷过夜,1×TBST洗3遍,每遍10 min;室温敷二抗(1∶1 000)1 h,1×TBST洗3遍,每遍10 min。最后滴加发光液并在暗室曝光。

2 结 果
2.1miR-193a在肿瘤组织中表达水平 在GEO数据库中分析miR-193a的表达水平,结果发现与相应的癌帝组织比较,miR-193a在肝癌组织中低表达(图1A)。在TCGA数据库分析异常表达的miR-193a患者的生存率,结果发现,在miR-193a低表达组(n=573)和高表达组(n=418)中,miR-193a高表达组的个体存活率有所延长(图1B)。TCGA数据库分析结果表明,与相应的癌旁组织比较,miR-193a在肝癌组织中是低表达的(图1C)。本研究对21对肝癌患者的肝癌组织和癌旁组织进行研究发现,有19例患者的肝癌组织中miR-193a的表达量均低于癌旁组织(图1D)。这些结果表明,miR-193a在肝癌组织中的表达水平较癌旁组织低。
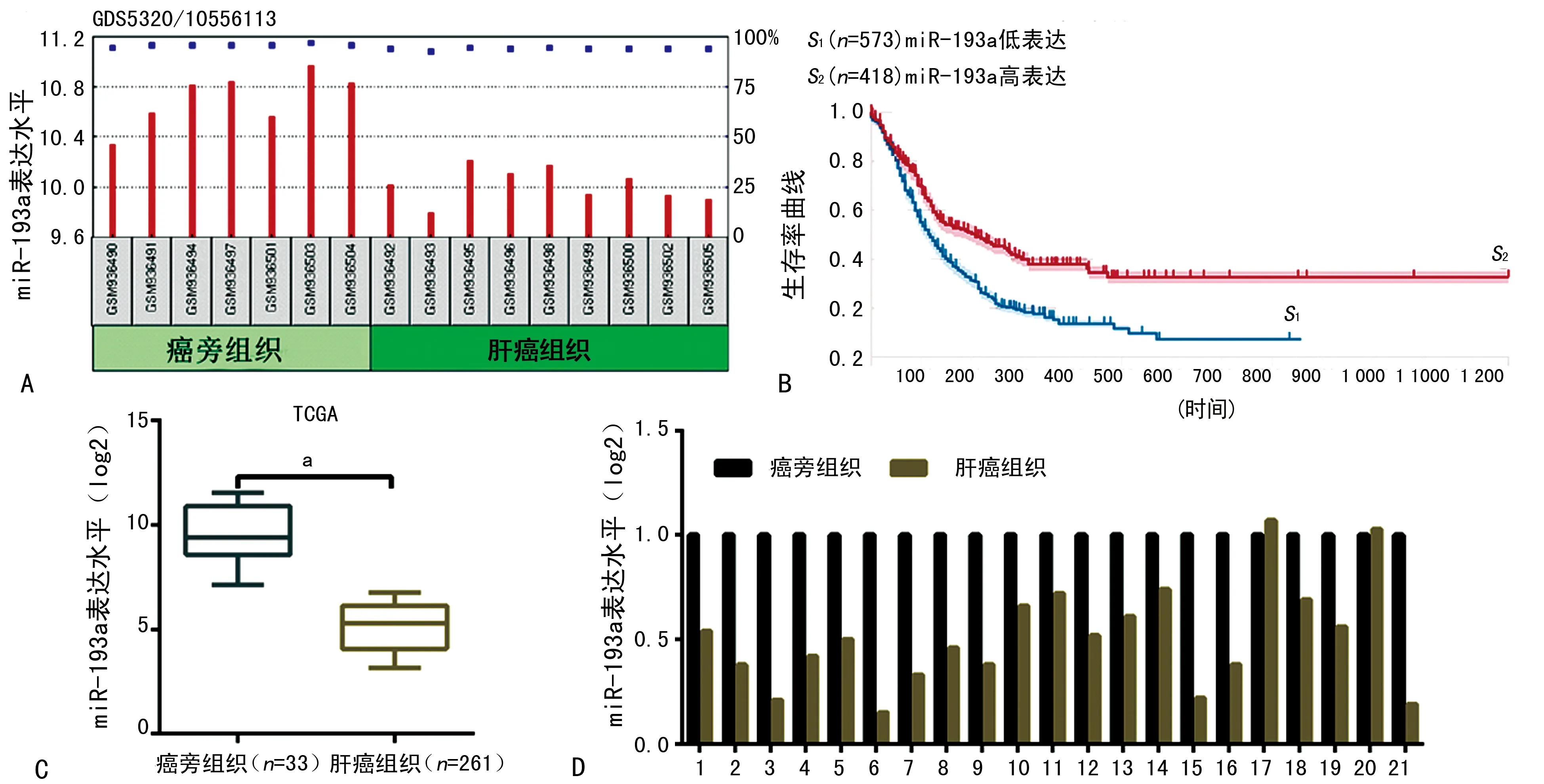
A:GEO数据库分析结果;B:miR-193a的表达对患者个体生存时间的影响;C:TCGA数据库分析结果;D:RT-qPCR分析肝癌组织和癌旁组织中miR-193a的表达水平;a:P<0.05,与癌旁组织比较
图1 miR-193a在肿瘤组织中的表达
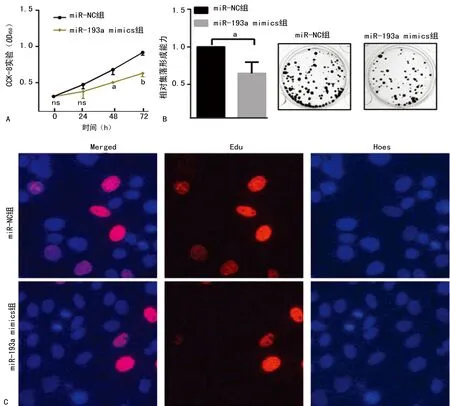
A:CCK-8试验;B:集落形成试验;C:EdU细胞增殖试验;a:P<0.05,b:P<0.01,与miR-NC组比较
图2 miR-193a对不同组Huh7细胞增殖的影响
2.2miR-193a对Huh7细胞增殖能力的影响 Huh7细胞转染miR-NC和miR-193a mimics后,CCK-8试验表明,miR-193a mimics组的细胞活性明显低于miR-NC组(图2A)。集落形成试验探讨miR-193a对Huh7细胞集落形成能力的影响,试验结果表明,miR-193a mimics组Huh7细胞的集落形成能力较miR-NC组受到了明显的抑制(图2B)。EdU细胞增殖试验发现,与miR-NC组比较,miR-193a mimics组Huh7细胞增殖能力明显受抑制(图2C)。上述结果表明miR-193a会降低Huh7细胞的活性和集落形成能力。
2.3miR-193a对Huh7细胞迁移和侵袭能力的影响 Transwell试验发现,miR-193a mimics组中Huh7细胞的迁移和侵袭能力都低于miR-NC组,见图3。表明高表达miR-193a抑制了Huh7细胞的迁移和侵袭能力。
2.4miR-193a直接靶定并下调KRAS 为了进一步研究miR-193a作用于Huh7细胞可能相关的分子机制,笔者采用TargetScan human7.1、miRNA.org和miRDB等生物信息学软件进行分析显示,KRAS可能是miR-193a的一个候选靶基因(图4A)。采用RT-PCR和Western blot验证,结果显示,miR-193a mimics组KRAS在mRNA和蛋白水平都低于miR-NC组(图4B、C)。这表明miR-193a抑制了KRAS的表达,进而影响肿瘤细胞的增殖等特性。
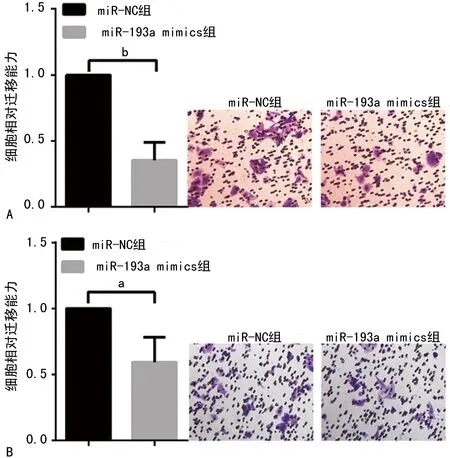
A:Transwell试验检测miR-193a对Huh7细胞迁移能力的影响;B:Transwell试验检测miR-193a对Huh7细胞侵袭能力的影响;a:P<0.05,b:P<0.01,与miR-NC组比较
图3 miR-193a对不同组Huh7细胞迁移和侵袭的影响
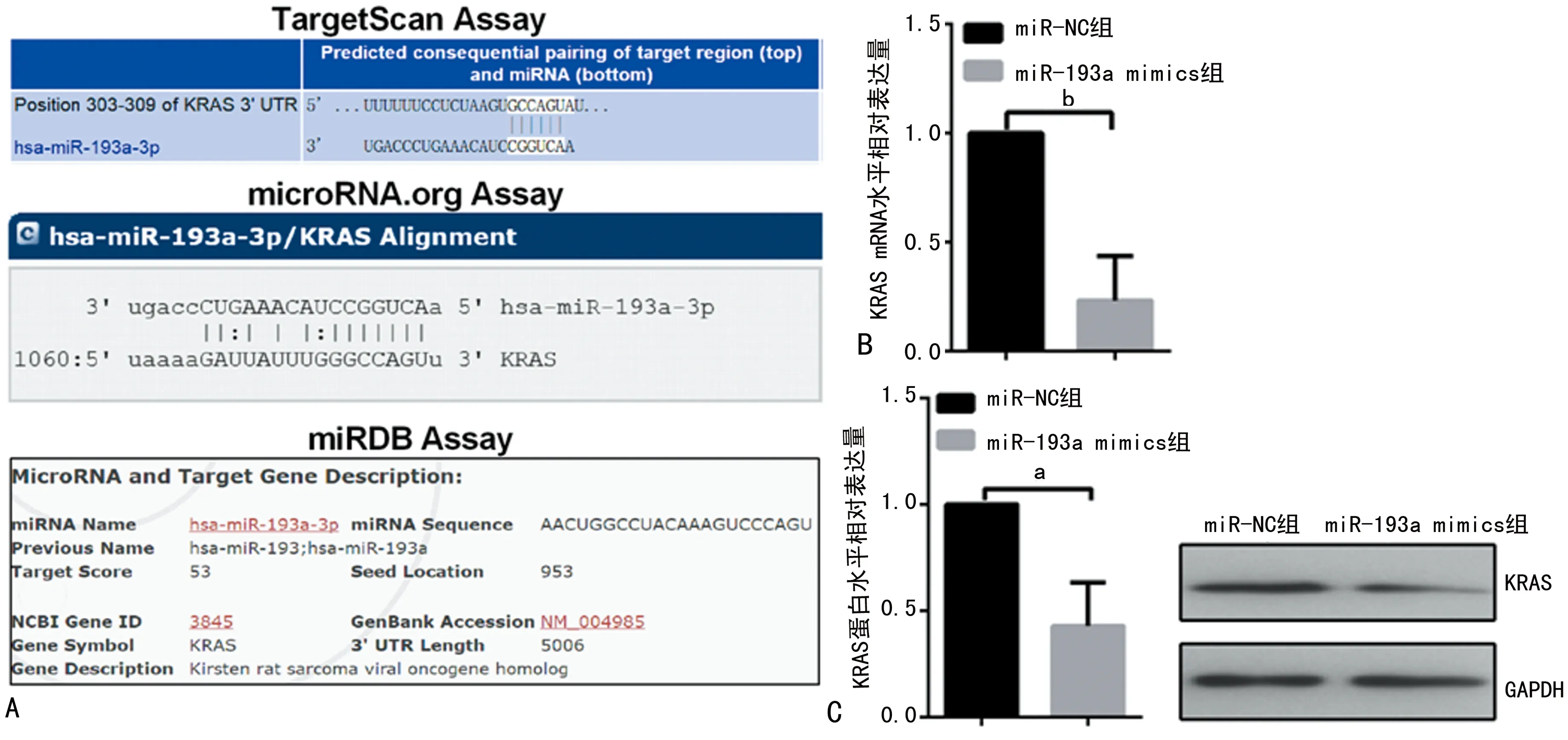
A:生物信息学软件预测miR-193a可能的靶点;B:miR-193a对KRAS mRNA水平的影响;C:miR-193a对KRAS 蛋白水平的影响;a:P<0.05,b:P<0.01,与miR-NC组比较
图4 miR-193a对KRAS表达的影响
3 讨 论
随着对miRNA在不同肿瘤或相关疾病中的研究不断深入,研究者发现miRNA的差异表达与疾病的发生发展有着密切的联系,miRNA可能具有抑癌或促癌的作用。例如,miR-144和miR-122-3p分别通过靶向RUNX1和FOXO,使卵巢癌细胞OC和肺癌细胞A549的增殖等特性受到严重抑制[13-14],而miR-1468和miR-451在不同的肿瘤中却起到促癌作用[15-16]。说明miRNA在将来可能会作为癌症进程中临床检测指标和治疗靶点[17]。
很多研究表明,miR-193a可能是1种抑癌的miRNA,与癌细胞的增殖、分化和迁移密切相关[18-19]。已有研究表明,miR-193a在肿瘤中的表达水平明显低于癌旁组织,且肿瘤细胞的增殖及集落形成能力也被miR-193a所抑制[20]。miR-193a队具有抑癌作用以外,也有报道称,在人类胃癌组织和胃癌细胞系中miR-193a的表达水平有所升高,证明它可能在不同的组织中也有促癌作用[21]。因此,研究miR-193a的表达水平及作用是必要的。
本研究探索了miR-193a对肝癌的作用及相关的机制。试验表明与癌旁组织比较,miR-193a在肝癌组织中的表达显著降低;通过转染miR-NC和miR-193a mimics,发现Huh7细胞的增殖、迁移和侵袭能力明显被miR-193a表达的升高所抑制。这表明miR-193a起到了抑制肝癌发展的作用。
为了更进一步的探讨miR-193a在肝癌发展过程中的作用,笔者用生物信息学方法预测了miR-193a的下游靶点为KRAS,RT-PCR和Western blot两种试验结果都表明过表达miR-193a后降低了KRAS mRNA和蛋白水平的表达。
综上所述,本研究证明miR-193a在肝癌中的表达水平有明显的降低,进而发挥抑制肝癌细胞增殖、迁移和侵袭的作用,而这一作用可能是由miR-193a直接靶向KRAS引起的。
