先天性甲状腺发育异常相关致病基因的突变分析*
2019-04-25戴静宜杨宇奇秦志强
孔 静,戴静宜,龙 伟,杨宇奇,周 红,虞 斌,秦志强△
(1.南京医科大学附属常州妇幼保健院实验室,江苏常州 213003;2.江苏大学医学院,江苏镇江 212013)
先天性甲状腺功能减低症(CH)是一种常见的新生儿内分泌疾病,江苏地区发病率约为0.05%(1/2 119)[1],高于国外水平,基本与全国水平持平。尽管CH的筛查和诊断较为成熟,但发病机制研究仍显不足。国外研究发现,CH根据致病机制的不同,主要分为甲状腺发育异常和甲状腺素合成障碍两种病理类型,其中甲状腺发育异常是造成先天性CH的最主要原因,约占80%,但其原因尚未阐明,遗传因素可能占较大比例[2]。本课题组在前期研究基础上设计了针对甲状腺发育异常相关致病基因的靶向测序panel,旨在分析江苏地区甲状腺发育异常致病基因的突变特点,为探讨CH的分子发病机制提供研究基础。
1 资料与方法
1.1一般资料 收集2012-2017年常州市新生儿疾病筛查中心确诊的89例CH患者的资料,合并有其他先天性异常的病例未纳入本研究。89例CH患者年龄9~51 d,男43例,女46例。本研究经南京医科大学附属常州妇幼保健院医学伦理委员会批准。
1.2方法
1.2.1CH确诊方案 按照《新生儿疾病筛查技术规范(2010版)》,在新生儿出生72 h之后、充分哺乳6次后足跟采集4个血斑(滤纸片Schleicher &Schuell 903),血片采集后悬空平置自然干燥成深褐色,并采用时间分辨荧光免疫法测定新生儿足跟血促甲状腺激素受体(TSH)水平。对TSH≥9 mIU/L的新生儿进行召回复查,对复查结果再次异常或初次筛查TSH≥20 mIU/L的新生儿采集静脉血,采用化学发光法检测血清TSH和血清游离甲状腺素(FT4)的水平。若TSH≥10 mIU/L,FT4<7.77 pmol/L则确诊为CH。
1.2.2靶向基因测序 收集CH病例的静脉血标本,采用QIAamp DNA blood kit试剂盒提取基因组DNA,基于Illumina Truseq Custom Amplicon v1.5 kit设计包含如促甲状腺素受体(TSHR)、PAX8、甲状腺转录因子1(TTF1)、甲状腺转录因子2(TTF2)、NKX2-5等基因的外显子及外显子-内含子交界区域的靶向测序panel,采用Illumina Miseq 2000平台进行测序。
1.2.3生物信息学分析 通过SnpEff 软件对结果进行注释,通过查询相关文献报道及ClinVar、dbSNP等数据库并利用PolyPhen-2、SIFT、Mutation Taster和GERP++对突变进行预测分析,有两种或两种以上生物信息学工具认为该突变致病或可能致病时认为该突变是潜在致病突变。dbSNP和ESP6500数据库中等位基因频率≥1%的SNP位点未经分析。
2 结 果
2.1测序结果的一般情况 89例CH患者中有19例检出甲状腺发育异常致病基因致病突变,70例未检出相关潜在致病突变,总体突变检出率为21.35%(19/89);共检出23个潜在致病突变,包括17个TSHR突变,2个TTF1突变,2个PAX8突变及TTF2、NKX2-5突变各1个。THRA突变未检出。19例存在潜在致病突变的CH患者中,有13例存在TSHR突变,2例存在TTF1突变,2例存在PAX8突变,以及存在TTF2、NKX2-5突变各1例。根据突变位点数目统计,有4例CH患者为TSHR基因双位点突变,其余均为单位点突变。
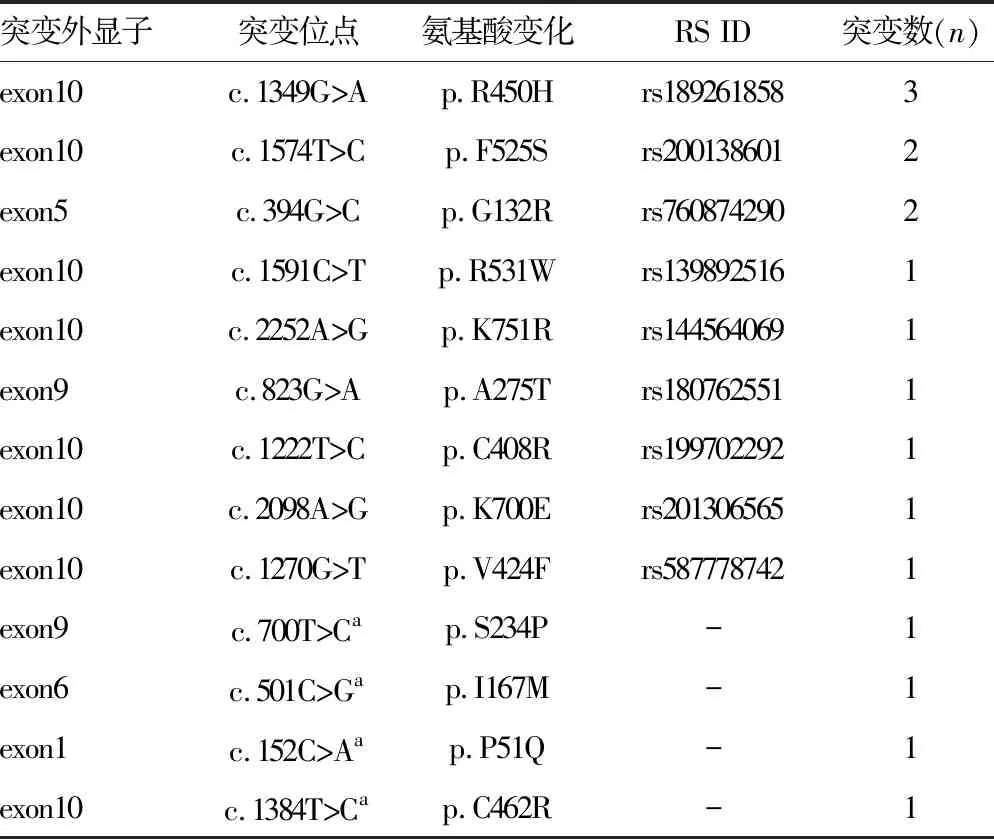
表1 TSHR基因突变情况
-:无数据;a:未报道突变位点

表2 TTF1、TTF2、PAX8和NKX2-5基因突变情况
-:无数据;a:未报道突变位点
2.2TSHR基因(NM_000369)的突变情况 89例CH患者中共检出17个TSHR突变,包括4个新突变,结果见表1。有关CH患者TSHR突变的文献报道较少且散在分布,c.394G>C[3]、c.2252A>G[4]、c.823G>A[4]和c.1270G>T[5]、c.1349G>A[6]突变在中国人群中见报道,与甲状腺发育不良和异位有关。c.1574T>C[7]和c.1591C>T[8]等在韩国人群或英国人群中见报道,其余突变暂未检索到与CH有关的文献报道。
2.3TTF1、TTF2、PAX8和NKX2-5的突变情况 89例CH患者中共检出2个TTF1突变,2个PAX8突变,以及TTF2、NKX2-5突变各1个(表2),PAX8基因c.398G>A[9]在日本人群中见报道,因单倍剂量不足致病,其余基因突变均未见报道。
3 讨 论
根据已有的研究,甲状腺发育异常是造成先天性CH的最主要原因,约占80%[10],多见于女孩(男女比例为1∶2)。其中,1/3病例为甲状腺缺如,其余为发育不全或在下移过程中停留在异常部位形成易位甲状腺,导致甲状腺部分或完全丧失其功能。造成甲状腺发育异常的原因尚未阐明,遗传因素可能占较大比例[11]。有研究报道,与发育相关基因的突变与甲状腺发育异常有关,如TSHR、PAX8、TTF1、TTF2和NKX2-5等基因[12-13]。这些基因在甲状腺的生长和发育中起着重要的作用,基因突变阻止或破坏了腺体的正常发育,导致异常或缺失的腺体不能产生正常量的甲状腺激素而致病。
由于导致先天性CH的原因较多,因此筛选其致病基因变的极为困难。以往的研究主要采用连锁分析(linkage analysis)对先天性CH家系进行分型,筛选在家系中与疾病产生共分离的遗传标记,进而在候选基因组区域内对所含基因进行Sanger测序,筛查与疾病共分离的突变位点。尽管连锁分析在实际研究中已经证实可靠有效,但在对于复杂疾病的研究中,却存在很大的局限性[14]。因为先天性CH绝大多数为散发性病例,家族性遗传性病例相对较少[15],因此对于先天性CH这样的复杂性疾病,采用连锁分析筛查新的致病基因显然不太合适,故急需一种可对尽可能多的基因进行分析的高通量测序分析技术。目前已经得到广泛应用的第2代测序技术(NGS)可同时对一个物种基因组中全部外显子区域进行测序(exome-seq,外显子组测序),直接发现与蛋白质功能变异相关的遗传突变,故可以用于发现新的先天性CH致病因素,以及研究已知致病因素在人群中频谱分布。
现有的报道均为针对欧美疾病人群的研究成果。报道认为绝大部分的先天性CH(约80%)是由于TSHR、PAX8、TTF1、TTF2和NKX2-5基因突变导致甲状腺生成异常而引起的。我国对先天性CH的分子水平研究鲜有报道。本研究采用靶向测序的方法探讨江苏地区CH相关致病基因突变频谱,结果发现甲状腺发育异常致病基因致病突变率仅占所有先天性甲状腺低下症的21.34%,远远低于国外的研究报道。这提示,江苏地区先天性CH的致病因素与欧美人群相比,可能存在较大的差异。因此,筛选江苏地区先天性CH的致病基因及致病因素在人群中的频谱分布,降低疾病的发生频率十分重要。
本研究在文献复习的基础上,研究目前国内外报道的甲状腺发育异常相关致病基因的热点突变的外显子及外显子-内含子交界区域设计靶向测序panel,包括TSHR、TTF1、TTF2、PAX8、NKX2-5和THRA基因,采用靶向捕获测序技术进行检测。研究共发现23个潜在致病突变,包括17个TSHR突变,2个TTF1突变,2个PAX8突变,以及TTF2、NKX2-5突变各1个,THRA突变未检出。共发现8个新突变,包括4个TSHR突变,1个TTF1突变,2个PAX8突变和1个NKX2-5突变。这对我国CH致病基因突变频谱数据库是一个重要的补充。
综上所述,本研究发现江苏地区人群中CH相关致病基因突变中约20%与甲状腺发育异常有关,与国外文献相比存在较大的地域差异。本研究所建立的靶向捕获测序技术可以快速有效地为CH患者进行基因诊断与基因治疗提供分子标记。
