转基因食物中常见外源基因PCR检测方法的建立
2019-04-25
(长春理工大学 生命科学技术学院,长春 130022)
自1996年转基因作物在美国首次商业化大规模种植以来,转基因技术在农业生产领域得到了快速的应用与发展,并且随着其种植面积的不断扩大,已经对现代农业的生产方式产生了巨大而深刻的影响。根据国际农业生物技术应用服务组织(ISAAA)于2018年6月发布的最新统计数据,2017年种植转基因作物的国家已经达到24个,并且全世界转基因作物种植面积由1996年的174万公顷增加到2017年的1.898亿公顷,增长种植面积超过了110倍[1]。随着转基因作物的迅猛发展,关于转基因生物及其产品成分食用和环境安全性的争议也与日俱增,世界各国都在不同程度上制订了相应的管理制度,主要包括转基因的安全性评价制度和转基因成分标识制度等[2-4]。目前,国内外对转基因作物及其相关制品的检测主要是针对其含有的外源蛋白和外源核酸展开的,并且已经建立了一系列转基因定性和定量检测技术,如酶联免疫吸附技术(ELISA)、PCR技术、等温扩增技术(LAMP)、基因芯片技术(gene chip)及数字PCR技术(digital PCR)等[5-6]。
我国对待转基因采取比较谨慎的态度,于2001年相继颁布了《农业转基因生物安全管理条例》及一系列管理办法,对农业转基因生物及其产品实行安全评价、产品标识、生产许可、经营许可、进口许可、加工许可等方面管理[7-8]。目前我国实施的是没有阈值的标识制度,规定来源于玉米、大豆、番茄等五种作物的17种转基因产品必须进行标识[9-12]。然而市场上一些散装售卖的农作物加工品普遍存在缺乏明显标识的现象,且深加工制品一般核酸会受到不同程度的破坏,不便于检测与监管[13]。
本文参照国家标准中提供的植物基因组提取方法,通过对试剂盒法、胍-氯仿法和CTAB法提取食品中基因组DNA效果进行比较,选择出DNA回收率高、纯度高的方法用于后续的PCR检测,然后针对转基因食品中一些常见的外源基因及调控元件设计出特异性引物,构建普通PCR的检测方法,并且扩增片段都小于200bp以适用于深加工品的检测,为监管部门对转基因食品标识的监管提供技术支持。
1 实验材料
1.1 实验样品
非转基因玉米种子黏垦、非转基因大豆种子合丰、阳性质粒pUC57-TP(见图1)为本实验室保存,转基因玉米MON89034、MIR162,转基因大豆GTS40-3-2(5%),阳性质粒pBJGMM001(见图2)均由中国农业科学院生物技术研究所提供[14],豆浆粉、豆芽购自超市。
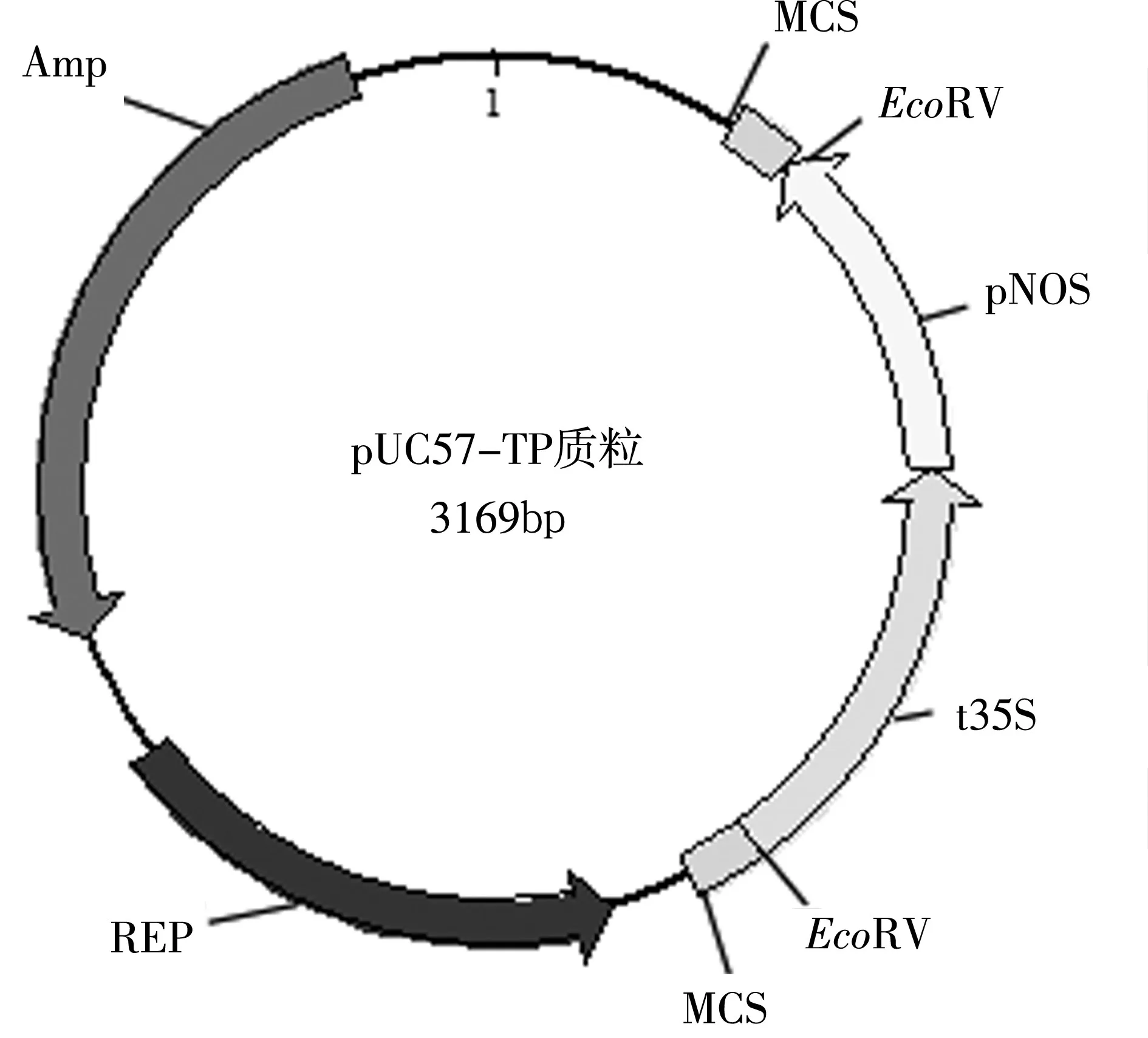
图1 pUC57-TP质粒结构

图2 pBJGMM001质粒结构
1.2 实验药品
PCR反应试剂(上海生工生物工程股份有限公司),EDTA、异丙醇、NaOH(天津光复科技发展有限公司),NaCl、无水乙醇、氯仿、异戊醇(北京化工厂),PVP40000(宝泰克生物科技公司),Proteinase K(Genview),Tris(BioFroxx),CTAB(上海源叶生物),β-巯基乙醇、Tris饱和酚(北京鼎国生物)、质粒提取试剂盒(北京天根生物科技公司)、植物基因组提取试剂盒(艾德莱生物)。
1.3 实验仪器
PCR仪(LifeTouch公司),离心机(Eppendorf公司),电泳槽,电泳仪,凝胶成像仪Azure c300(azure biosystems公司),微量核酸测定仪Nanodrop One(美国Thermo Fisher公司)。
2 实验方法
2.1 基因组DNA提取
参照GB/T 19495.3-2004中基因组DNA的CTAB提取方法[15]、胍-氯仿法,及购买的植物基因组提取试剂盒分别对豆芽、豆浆粉、大豆种子的基因组进行提取,每种方法设置两组重复。将DNA沉淀用去离子水溶解,-20℃保存备用。
通过凝胶电泳实验判断所提取植物及其加工品基因组DNA的完整度,再用微量核酸及蛋白测定仪Nanodrop One对提取DNA的浓度和纯度进行测定分析。
2.2 阳性质粒分子的提取
从-80℃冰箱中取出冻存的菌株,将其按1∶100接种到氨苄青霉素终浓度为100μg/mL的5mL LB培养基中,在37℃下180rpm振荡过夜,再将菌液在4℃下离心分离,使用天根Mini Plasmid Kit提取大肠杆菌中的质粒,操作步骤参照试剂盒的说明书。
将质粒溶液保存在1.5mL离心管中,通过凝胶电泳实验判断质粒DNA的提取情况。
2.3 引物设计与合成
根据CaMV35S启动子、NOS终止子、CaMV35S终止子、NOS启动子、FMV35S启动子、Hpt、CP4-EPSPS、Cry1A.105、Cry2Ab2九种不同基因的核苷酸序列,使用Oligo 7.0设计出特异性引物,玉米内参zSSIIb、大豆内参Lectin的引物序列参照国家标准GB/T19495.4-2004《转基因产品检测核酸定性PCR检测方法》[16],引物的详细信息见表1,并由长春库美生物公司合成和纯化,用去离子水稀释成100μM备用。
2.4 PCR反应体系及条件
PCR反应体系见表2,PCR反应条件见表3。

表1 引物序列

表2 PCR反应体系

表3 PCR反应条件
2.5 电泳检测
吸取PCR产物10μL,在2%琼脂糖凝胶中电泳,缓冲液为0.5×TBE电泳缓冲液,设置水空白对照、阴性对照、阳性对照,以DL2000 DNA Marker作为标准尺,在100V电压下电泳30min,通过EB染色[17-18],在凝胶成像仪中观察结果。
3 实验结果
3.1 不同基因组提取方法比较
分别用植物基因组试剂盒法、CTAB法和盐酸胍-三氯甲烷法对豆芽、豆浆粉、大豆种子中的基因组DNA进行提取,从电泳结果和核酸含量测定中可以看出,相同质量的样品用CTAB法提取到的基因组DNA的含量和纯度最高,后续实验将采用CTAB法提取食品中DNA进行PCR检测验证。

图3 三种不同方法对不同样品基因组提取结果
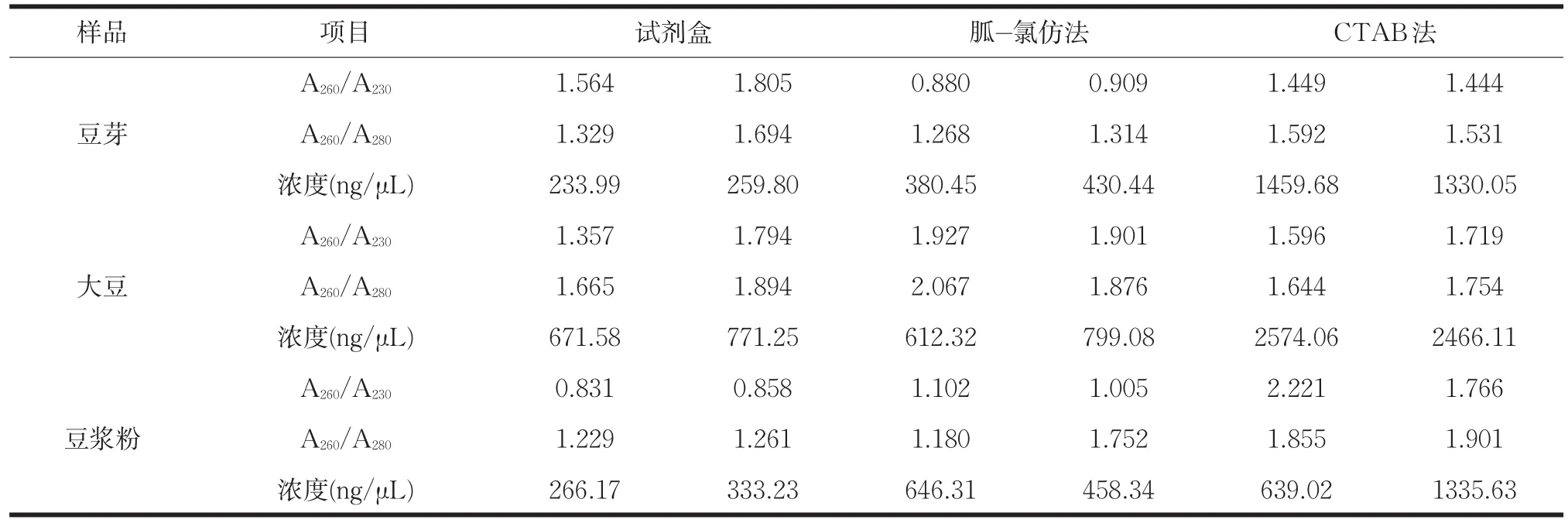
表4 不同方法提取核酸含量测定结果
3.2 阳性质粒提取
从图4、图5电泳结果可以看出,所提取的阳性质粒条带明亮清晰,可适用于后续的PCR检测。

图4 pUC57-TP质粒提取结果
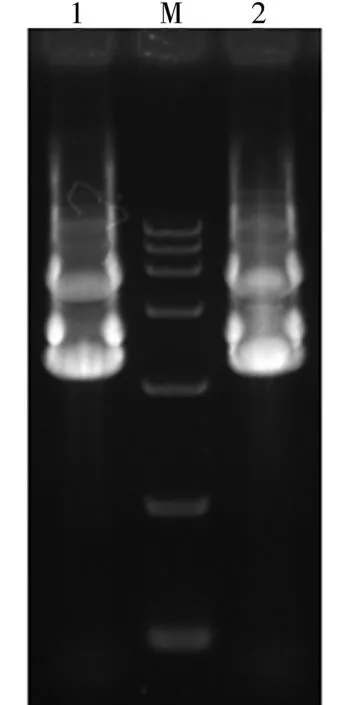
图5 pBJGMM001质粒提取结果
3.3 PCR检测方法特异性验证
以空白对照(水)、阴性样本、阳性样本(或阳性质粒)作为实验材料,分别对9种基因的PCR检测方法进行特异性验证,结果如图6所示。从中可以看出9种基因的检测方法均能从阳性样本(或阳性质粒)中得到预期大小一致的扩增产物,而在阴性样本、空白对照及不含目标基因的转基因样本中均未出现扩增(部分有引物二聚体出现),说明该检测方法具备高度特异性。
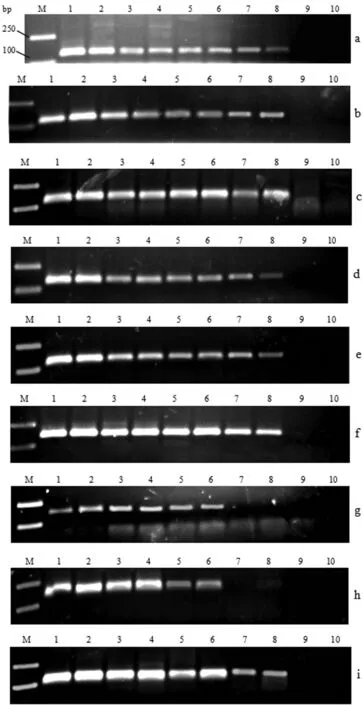
图7 不同基因PCR检测方法的灵敏度

图6 PCR检测方法特异性结果
3.4 PCR扩增产物的测序验证
将PCR扩增得到的9种扩增产物送去生工公司测序,测序结果与已知的目标基因序列进行比对分析,发现9种PCR产物的测序结果与已知序列基本一致,验证了扩增产物的正确性。
3.5 PCR检测方法的灵敏度试验
将提取的基因组DNA稀释至200ng/μL,那么50ng/反应,因为玉米基因组大小为2500Mbp,所以约18242 copies/反应,pBJGMM001质粒与pUC57-TP质粒大小分别为5078bp、3169bp,200ng/μL玉米基因组拷贝数分别等同于质粒40.623×10-5ng/μL、25.351×10-5ng/μL,然后将阳性质粒与阴性玉米混合成不同的百分含量,同时也将MON89034、GTS40-3-2、MIR162与非转基因样品按质量比进行混合,制备成5%、1%、0.5%、0.1%的梯度,进行灵敏度测试。从图7结果中可以看出,p35S、tNOS、Hpt、t35S、pNOS、pFMV35S、Cry2Ab2的PCR检测方法均可从含量0.1%的样品中扩增出与预期大小一致的PCR产物,而CP4-EPSPS、Cry1A.105能从含量0.5%的样品中得到扩增(详细信息见表5),能够满足对食品中转基因成分的检测。其中,MIR162中由于含有的t35S片段太短与引物序列不一致,所以并未得到扩增。

表5 9种检测方法检测限与适用性
4 结论
本研究通过对CTAB法、胍-氯仿法和试剂盒法三种植物基因组提取方法进行比较,筛选出提取率最大、提取纯度最高的CTAB法用于本实验样品基因组的提取。以Lectin基因、zSSIIb基因分别为大豆、玉米的内标准基因,针对转基因作物中9种常见的外源基因序列为模板,设计出9对引物,建立了定性PCR的检测方法,该方法具有高度的特异性,检测灵敏度可达0.1%~0.5%,满足转基因产品的检测要求。
随着转基因技术的进一步发展,转基因作物的种类也在不断增加,据ISAAA于2018年发布的最新统计数据表明,转基因玉米单品系现有44种,转基因大豆单品系现有25种。目前,国家发布的相关标准文件中公布了18种筛选检测基因、15种大豆品系、23种玉米品系PCR检测方法的推荐标准,本文就其中p35S、tNOS、Hpt、t35S、pNOS、pFMV35S、CP4-EPSPS、Cry1A.105、Cry2Ab2九种基因构建了定性PCR检测方法,后期将进一步增加筛选检测和品系检测的覆盖范围,并开发出定量检测的荧光PCR和数字PCR方法检测转基因,为我国的转基因监管提供依据和技术基础。
