3β-HSD基因在福建牡蛎性类固醇激素合成机制中的表达研究
2019-04-25倪健斌谭强来
曾 臻,倪健斌,史 博,谭强来*
(1.厦门医学院,福建 厦门 361023;2.厦门大学近海海洋环境科学国家重点实验室,福建 厦门 361102)
福建牡蛎(Crassostreaangulata)是我国南方贝类养殖的主要种类,近年来其商业价值不断增加,对福建牡蛎生殖调控的研究在养殖中具有重要的应用价值[1]。此外,牡蛎是分析河口污染情况的环境指示种,养殖环境中大量的污染物可以通过扰乱牡蛎的内分泌调节影响牡蛎的生理活动,因此对牡蛎内分泌机制的研究显得格外重要。然而目前国内外有关贝类生殖内分泌的研究却十分有限。
类固醇激素(Steroid hormone)是最主要的一类性腺激素,包括雄激素、雌激素和孕酮等。目前,在包括头足纲、双壳纲和腹足纲在内的不少软体动物组织中均检测到类似脊椎动物性类固醇激素物质的存在[2-3]。研究发现这些性类固醇激素参与了贝类的生殖调控,在贝类的性腺发育过程中发挥着重要作用。然而,关于类固醇激素在贝类中是如何发挥作用的机制还不甚清楚。Wang等[4]用放射性配体结合实验的方法在海扇贝(Placopectenmagellanicus)性腺组织中检测到2个雌激素结合位点,竞争性结合实验进一步证明这两个结合位点具有特异性结合雌激素的能力,并且这种作用在配子发生的早期更加明显。另外,Wang等[5-6]还发现用脊椎动物类固醇激素受体拮抗剂(如1.25 μM它莫西芬、2.5 μM氟他胺、1.00 μM美服培酮)可以阻断类固醇激素在海扇贝中的生物学作用。这些研究结果表明在贝类中可能同样存在由雌激素介导的生殖调节机制,并且可能是通过激活其受体来发挥作用的。
研究发现,贝类中类固醇激素合成的底物与脊椎动物同样是胆固醇和孕烯醇酮[7-8]。但目前有关贝类中类固醇激素合成和代谢机制的研究较少,而且比较零散。其中3β-羟化类固醇脱氢酶(3β-Hydroxysteroid dehydrogenases,3β-HSDs)为类固醇激素合成代谢通路中的一种关键酶。3β-HSD可以催化孕烯醇酮或脱氢表雄酮生成有活性的孕酮和雄烯二酮。研究者在蜗牛(HelixpomatiaL.)[9]、真蛸(Octopusvulgaris)[10]、紫贻贝(Mytilusedulis)[11]和海蛞蝓(Ariolimaxcalifornicus)[12]等软体动物的性腺组织提取物中也检测到了3β-HSD的这种活性。此外,Krusch等[9]还发现蜗牛卵巢中3β-HSD在产卵前的活性明显高于排卵后,这预示了其在蜗牛生殖活动中的重要功能。
本研究拟通过对福建牡蛎性类固醇激素合成相关酶3β-HSD的基因进行结构和功能探究,分析其时空表达特征,以及在牡蛎细胞中的定位,为阐明牡蛎内源性类固醇激素的合成机制奠定基础,为进一步研究牡蛎生殖内分泌机理提供参考。
1 材料与方法
1.1 实验动物
实验用福建牡蛎购自福建省漳州市斗美村渔排,重量为3.8~14.0 g/只。参考Foighil等[13]和Folmer等[14]的方法,根据线粒体COI基因片段序列特征进行种的鉴定,确定所采样品为福建牡蛎。根据形态学观察[15],将所采样品分为四个阶段:增殖期、生长期、繁殖期和排放期,每个时期选取15只雄性和15只雌性作为本研究的实验对象。打开牡蛎壳后,取每个时期牡蛎不同组织(性腺、闭壳肌、外套膜、鳃、内脏团)放入液氮中速冻后保存于-80℃冰箱中备用,同时取一小块成熟期性腺组织固定于4%多聚甲醛溶液中(4℃固定过夜)。
1.2 RNA提取
分别将样品置于Trizol®Reagent(Invitrogen,USA)匀浆。按照Trizol使用说明书,分别从牡蛎不同组织提取总RNA,通过1%变性琼脂糖凝胶电泳检测其完整性,结合Nanodrop ND-2000分光光度计检测RNA的浓度和纯度。
1.3 3β-HSD基因cDNA全长序列的克隆
根据反转录试剂盒(TIANGEN,China)步骤分别对所得的RNA进行反转录以获得cDNA。基于本实验室构建的福建牡蛎转录组文库中筛选获得的3β-HSD基因的序列片段,按照Full-RACE Core Set Ver.2.0 试剂盒(TAKARA,China)要求,分别设计并合成5′和3′ RACE特异性引物(引物序列见表1),按照试剂盒说明书对福建牡蛎3β-HSD基因进行5′和3′ RACE扩增,将所得序列产物进行纯化,并送至广州英韦创津(Invitrogen)生物技术公司进行测序分析。
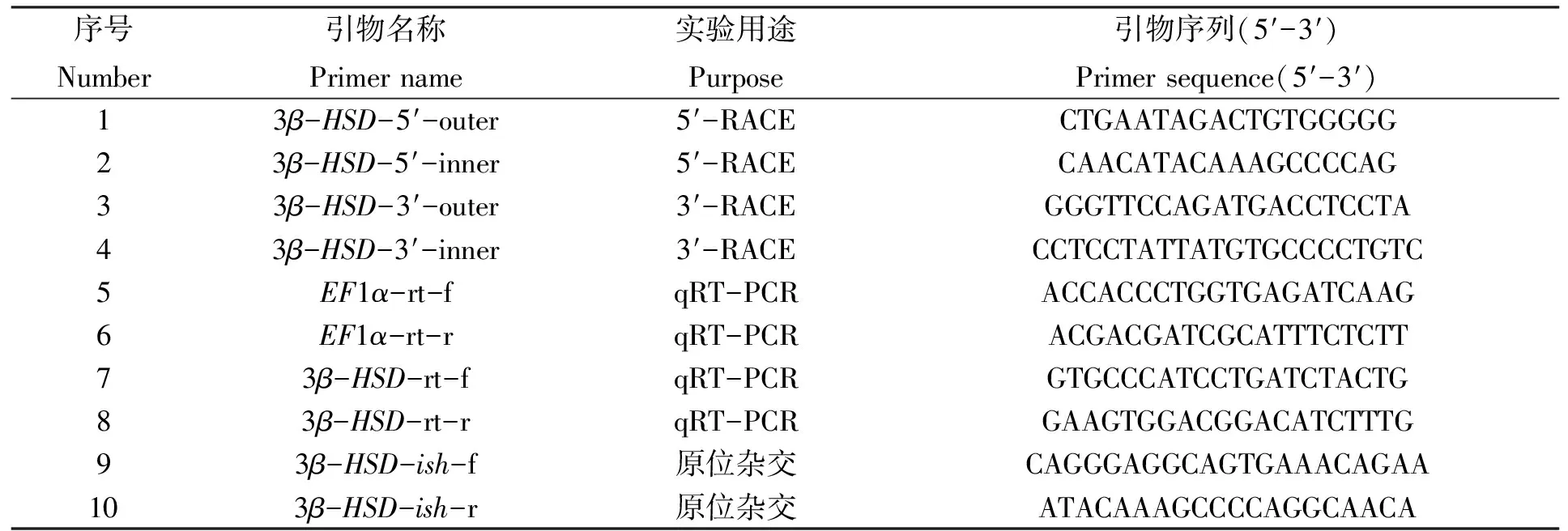
表1 实验所用引物序列
1.4 实时荧光定量PCR(qRT-PCR)
根据Quanta cDNA第一链合成试剂盒(TIANGEN,China)的说明书,以2 μg总RNA为模板,Oligo-dT15为引物,通过Quanta反转录酶合成cDNA第一条链。以cDNA第一条链为模板,以牡蛎Elongationfactor1α基因(EF1α,GenBank accession No.BQ426516)作为内参基因[16],同时预实验也证明该内参基因在福建牡蛎不同组织及不同性腺发育阶段的表达量十分稳定(表1)。运用SYBR GreenⅠ染料法在ABI 7500 fast system real-time PCR系统(Applied biosystems,USA)上定量分析不同时期牡蛎3β-HSD基因的mRNA表达变化。每个实验组设置5个平行样,每个样品设置3个重复孔。每轮反应均设有cDNA实验组、阴性对照组(用DNaseⅠ处理过,但没有进行反转录的RNA)和空白对照组(PCR水)。通过系列梯度稀释样品构建标准曲线法,计算本次qRT-PCR中所用引物的扩增效率E范围均处在95%~100%(R2>0.99)(表1)。qRT-PCR扩增产物经琼脂糖凝胶电泳检测均为150 bp大小的单一产物。本实验所使用的试剂盒为SYBR Green qPCR Kit(Thermo,USA),反应条件如下:预变性95℃ 10 min;95℃ 20 s,52℃ 20 s,72℃ 20 s,35个循环。反应结束后对每个基因的熔解曲线进行分析。
所得数据用ABI 7500 system SDS 软件(Version 1.4,Applied biosystems)进行分析,用2-ΔΔCT法(ΔCt=CtcaVg-CtEF1α,ΔΔCt=ΔCt实验组-ΔCt校准组)计算目的基因的相对表达量[17-18]。
1.5 原位杂交
根据获得的3β-HSD基因序列,设计杂交探针的引物(表1),参考Ni等[19]的方法对1.1中固定于4%多聚甲醛溶液中(4℃固定过夜)的成熟性腺组织进行原位杂交。
1.6 目的基因的生物信息学分析
用BLAST软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列同源性比对;用DNAMAN软件进行比对拼接,得到基因的全长序列;用Compute pI/Mw tool(http://web.expasy.org/protparam/)预测等电点和分子量;用SignalP 3.0 软件(http://www.cbs.dtu.dk/services/SignalP/)寻找信号肽;用TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM)预测蛋白跨膜结构域;用Predict Protein 软件(http://www.predictprotein.org/)预测蛋白质功能结构域;用CLUSTALX软件进行多重序列比对;用MEGA 4.0软件中的邻接法(1000 bootstrap replicates)构建系统进化树。
2 结果
2.1 福建牡蛎3β-HSD基因的序列全长及特征
如图1,福建牡蛎3β-HSD基因(ca3β-HSD)cDNA序列全长1 444 bp,5′-UTR(5′-Untranslated region)长165 bp,3′-UTR长210 bp,开放阅读框(Open reading frame,ORF)长1 068 bp。该基因可编码356个氨基酸,预测蛋白分子量为39.796 kDa,等电点为8.32。经SignalP和TMHMM软件预测可知ca3β-HSD的氨基酸序列在AA274~AA296存在1个跨膜结构。ca3β-HSD的氨基酸序列含有3β-HSD保守的结构域(AA3-AA348),该结构域包括了1个酶活性中心YGGTE(AA149~AA153)和1个辅酶结合位点TGGAGFLG(AA7~AA14),其中YGGTE结构是短链脱氢酶保守的结构特征。
2.2 福建牡蛎3β-HSD基因的同源性和系统发育分析
多重序列比对的结果表明,ca3β-HSD氨基酸序列与其他动物的相似性为33%~99%,其中与太平洋牡蛎(Crassostreagigas)相似性最高(图2)。用MEGA 4.0软件以邻接法(1 000 bootstrap replicates)构建系统进化树分析ca3β-HSD与其他物种的同源关系。进化树显示,3β-HSDs分别在脊椎动物和无脊椎动物聚为两大枝。而在无脊椎动物中,两种牡蛎的3β-HSDs最先聚类,接着再与其他无脊椎动物如节肢动物、棘皮动物和脊索动物等聚类(图3)。


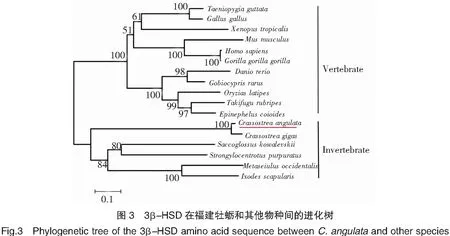
图2、3中各物种3β-HSD氨基酸序列在NCBI上的登录号如下:太平洋牡蛎(Crassostreagigas),EKC29143;紫海胆(Strongylocentrotuspurpuratus),XP_797239;捕食螨(Metaseiulusoccidentalis),XP_003746390;硬蜱(Ixodesscapularis),XP_002434360;柱头虫(Saccoglossuskowalevskii),XP_002738669;家鼠(Musmusculus),NP_694873;斑马鱼(Daniorerio),AY279108;草雀(Taeniopygiaguttata),NM_001048264;红鳍东方鲀(Takifugurubripes),XM_003962237;非洲爪蟾(Xenopustropicalis),XM_002940984;红原鸡(Gallusgallus),NM_205118;稀有鮈鲫(Gobiocyprisrarus),JN858104;青鳉(Oryziaslatipes),NM_001137565;智人(Homosapiens),AAA51831;斜带石斑鱼(Epinepheluscoioides),FJ807731;西非低地大猩猩(Gorillagorillagorilla),XP_004026492。
2.3 福建牡蛎3β-HSD基因在不同组织中的表达
如图4所示,3β-HSD基因在福建牡蛎性腺、外套膜、闭壳肌和内脏团中均有表达,而在鳃组织中几乎没有表达,性腺中3β-HSD基因的表达量最高,约为其他组织的2~10倍(P<0.05),卵巢中的表达量略高于精巢。

注:*表示差异显著。
Notes:*was significant difference.
2.4 福建牡蛎3β-HSD基因在生殖周期中的表达模式
图5反映了福建牡蛎生殖周期中性腺3β-HSD基因的表达量变化。从增殖期到成熟期,3β-HSD基因的表达量持续增高,并在成熟期达到最大值(P<0.05),但在配子排放后,其表达量急剧下降(P<0.05)。3β-HSD基因的这种表达量变化趋势在雌性个体和雄性个体中基本一致。
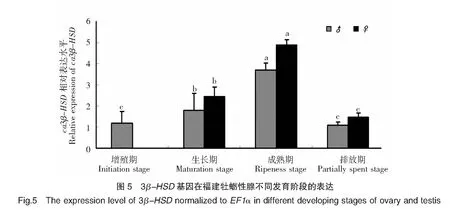
注:不同小写字母表示差异显著,相同字母表示无显著差异。
Notes:Different lowercase letters indicated significant difference,otherwise the same was no significant olifference.
2.5 福建牡蛎3β-HSD基因在卵巢中的细胞定位
原位杂交结果显示3β-HSD基因在福建牡蛎卵巢中呈现出细胞定位,能与DIG标记的3β-HSD基因的反义RNA探针杂交,显色后呈蓝黑颜色的阳性信号主要分布在卵细胞周边的个体小的滤泡细胞上,而在成熟卵细胞上没有发现有阳性信号(图6),这说明3β-HSD基因主要表达在福建牡蛎卵巢组织的滤泡细胞中。

注:a为常规HE染色结果;b为用反义探针杂交的阳性结果;c为用正义探针杂交的阴性对照;Fc为滤泡细胞;Oo为卵细胞。
Notes:a was hematoxylin-eosin staining;b was antisense probe;c was sense probe;Fc was follicle cell;Oo was oocyte.
3 讨论
3β-HSD可以通过催化3β位上酮基和羟基间的转化,能分别将孕烯醇酮或脱氢表雄酮转化为有活性的孕酮和雄烯二酮。催化反应分为二步完成,第一步为3β位羟基脱氢,氧化辅酶NAD+为NADH;第二步为NADH激活△5-3-酮类固醇中间体构象转变为稳定的△4-3-酮类固醇构象[20]。脊椎动物的3β-HSD具有不同的亚型,如人类3β-HSD具有2种亚型[21],而大鼠有6种亚型的3β-HSD[22]。不同亚型的3β-HSD具有不同的组织分布特点和生物学功能,其中人类Ⅱ型3β-HSD和大鼠Ⅰ型、Ⅱ型3β-HSDs主要参与了类固醇激素的合成调节[23]。研究者在一些无脊椎动物(如绦虫和孢子虫)的体内也检测到3β-HSD的活性,并发现它能参与调节类固醇激素的合成,对生长和发育具有促进作用。海兔、紫贻贝、真蛸和蜗牛等软体动物的性腺组织提取物中也被证明含有能将孕烯醇酮、17α-羟基孕烯酮醇、脱氢表雄酮催化形成孕酮的3β-HSD活性[9-12]。Krusch等[9]还发现蜗牛卵巢中3β-HSD的活性变化与生殖活动紧密联系,其在产卵前的活性显著高于排卵后。以上结果表明3β-HSD可能同样参与了贝类中类固醇激素的合成过程。Zhang等[24]在对太平洋牡蛎全基因组测序时获得太平洋牡蛎中两个亚型的3β-HSDs基因序列,分别是3β-HSD1型和3β-HSD2型,但氨基酸比对后发现这两种亚型的3β-HSD同源性高达96%。除此之外,国内外未见其他关于贝类3β-HSD基因研究的报道。本实验用基因克隆的方法获得了福建牡蛎3β-HSD基因全长序列,这是在贝类中获得的首个3β-HSD基因全长。ca3β-HSD氨基酸序列具有酶活性中心和辅酶结合位点等结构域,而这些都是3β-HSD家族基因典型的结构特征。氨基酸序列比对结果显示,福建牡蛎3β-HSD与其他物种具有较高的同源性。本次研究发现,福建牡蛎3β-HSD基因在性腺中高量表达,这与人、大鼠、鳗鱼中Ⅰ型和Ⅱ型3β-HSD基因的组织分布特征相似[23],也与性腺是贝类重要的生殖内分泌器官是相对应的。原位杂交的结果进一步表明其主要表达在卵巢的滤泡细胞上,这与Matsumot等[25]、王丹等[26]、许茜等[27]用免疫组化的方法获得的结果一致。此外,3β-HSD基因在福建牡蛎的生殖周期中呈现出与其他部分脊椎动物相似的表达模式[23],并且与性类固醇激素水平的变化显著相关,这预示了3β-HSD在福建牡蛎性类固醇激素的合成过程中可能发挥了重要作用。此外,福建牡蛎3β-HSD基因在雌、雄个体中表达量没有明显差别,这可能是由于3β-HSD的催化产物雄烯二酮或孕酮是雌二醇和睾酮合成共同的前体物质。
本研究通过分子生物学的方法克隆获得了福建牡蛎性类固醇激素合成酶重要基因3β-HSD的全长,并研究了其序列结构特征和时空表达模式,证明了该基因指导合成的3β-羟化类固醇脱氢酶是牡蛎性类固醇激素合成过程中的关键酶,对调节牡蛎性类固醇激素的合成起着重要的作用;同时进一步证明了贝类具有合成内源性类固醇激素的能力。
