双液电池在实验探究中的解题思路分析
2019-04-25林耀昆
林耀昆
(福建省泉州市第十七中学,福建泉州 362121)
引 言
教育部新颁发的《普通高中化学课程标准(2017年版)》提出,高中学生应具有“科学探究与创新意识”的学科核心素养,学生要能认识到科学探究是进行科学解释和发现、创造与应用的科学实践活动;能发现和提出有探究价值的问题;能从问题和假设出发,依据探究目的,设计探究方案,运用化学实验、调查等方法进行实验探究;勤于实践,善于合作,敢于质疑,勇于创新[1]。笔者在研究高考试题过程中发现,近几年北京市高考或高三质检的化学命题中多次出现了利用双液电池进行实验的探究。本文以改编后的北京市高考和高三质检化学实验探究题为例,探讨双液电池在实验探究中的解题思路。
一、应用双液电池进行实验探究的主要考查内容
电化学学习的基础知识是氧化还原反应,同时电化学的应用是对氧化还原反应知识的一种升华。物质的氧化性或还原性强弱受离子浓度、介质酸度、温度等因素的影响。对于电池电动势比较小的反应,离子浓度的改变可能会引起反应方向的改变[2]。在高考命题中,应用双液电池进行实验探究的考查内容主要是离子浓度、介质酸度的改变如何影响物质的氧化性或还原性,以及氧化还原可逆反应的方向等。
二、双液电池在实验探究中的解题思路
控制变量法在探究实验中的应用较多,利用双液电池,控制或改变浓度、介质酸度等因素探究物质的氧化性或还原性强弱就是其中的一种应用。笔者认为,在高考复习中,教师可以教给学生采用以下思维模型进行解题,如图1所示。
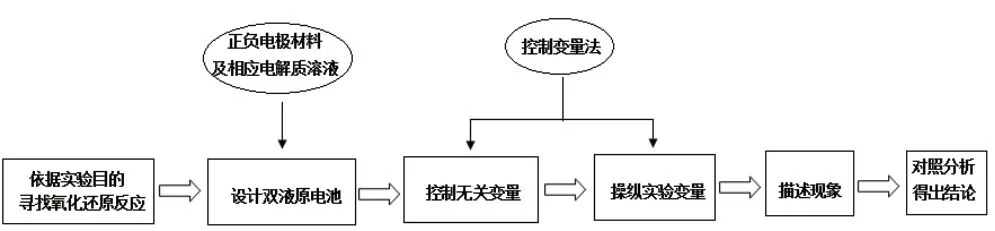
图1
三、案例分析
例1.(2015年高考北京卷第28 题,有适当的删减和改编)
为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I-2Fe2++I2”,反应中Fe3+和Fe2+的相互转化。实验如表1。

表1
(1)根据氧化还原反应的规律,该同学推测i 中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用图2装置(a、b 均为石墨电极)进行实验验证。

图2
①K 闭合时,指针向右偏转,b 作_______极,a 电极区对应溶液为___________。
②当指针归零(反应达到平衡)后,向U 型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是 ____________________________。
(2)按照(1)的原理,该同学用图2装置进行实验,证实了ii 中Fe2+向Fe3+转化的原因,
①转化原因是________________________________________________________________________。
②与(1)实验对比,不同的操作是_________________________________。
【答案】
(1)①正0.01 mol/L KI 溶液;②左管产生黄色沉淀,指针向左偏转。
(2)①Fe2+随浓度增大,还原性增强,使Fe2+还原性强于I-;②向U 型管右管中滴加1mol/L FeSO4溶液。
【解题思维模型分析】
1.依据实验目的,得到氧化还原反应为2Fe3++2I-2Fe2++I2。
2.设计双液原电池:根据提供双液电池的图形,结合上述氧化还原反应及题目实验操作,可以得出a 电极区对应溶液为0.01 mol/L KI 溶液。
3.控制无关变量:KI 溶液的浓度为0.01 mol/L,Fe2(SO4)3溶液的浓度为0.005 mol/L,温度相同。
4.操纵实验变量:本实验探究的实验变量为外加Ag+浓度和外加Fe2+浓度,通过改变I-浓度和Fe2+浓度,使电池电动势比较小的反应2Fe3++2I-2Fe2++I2的反应方向发生改变。所以,第(1)小题的②实验操作是“向U 型管左管滴加0.01 mol/L AgNO3”,第(2)小题的②实验操作是“向U 型管右管中滴加1mol/L FeSO4溶液”。
5.现象和结论:由第(1)小题结论“外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+”反推出②实验现象为“左管产生黄色沉淀,指针向左偏转”。
例2.(2017年北京市西城区一模考试题,有适当的删减和改编)
某化学小组研究盐酸被MnO2氧化的条件,进行如表2实验。
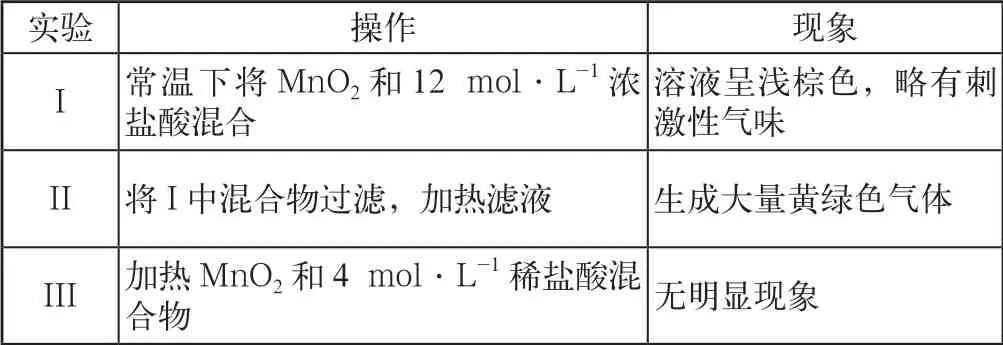
表2
(1)III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验IV 进行探究:
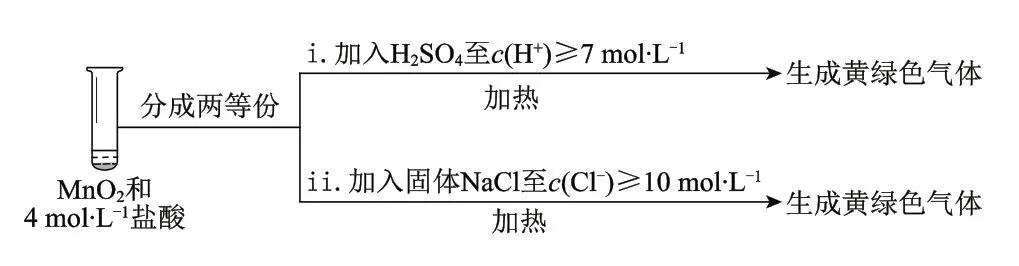
①将实验III、IV 作对比,得出的结论是__________________________;
②将i、ii 作对比,得出的结论是_______________________________________。
(2)用图3装置(a、b 均为石墨电极)进行实验V:

图3
K 闭合时,指针向左偏转;
向右管中滴加浓H2SO4至c(H+)≥7 mol·L-1,指针偏转幅度变化不大;
再向左管中滴加浓H2SO4至c(H+)≥7 mol·L-1,指针向__________左偏转幅度增大。
将i 和ii、iii 作对比,得出的结论是__________________________________。
【答案】
(1)①III 中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化。
②MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-)。
(2)HCl 的还原性与c(H+) 无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强。
【解题思维模型分析】
1.依据实验目的,得到氧化还原反应为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。
2.设计双液原电池(本题已经提供双液电池的图形,只要判断双液电池的正负极就可以了)。
3.控制无关变量:MnO2的质量,c(Cl-)为4mol/L,且温度相同。
4.操纵实验变量:本实验探究的实验变量为H+的浓度,H+的浓度大小到底会影响Cl-的还原性或是会影响MnO2的氧化性呢?所以实验操作为“向右管中滴加浓H2SO4至c(H+)≥7 mol·L-1”和“再向左管中滴加浓H2SO4至c(H+)≥ 7 mol·L-1”。
5.现象和结论:由现象“向右管中滴加浓H2SO4至c(H+)≥7 mol·L-1,指针偏转幅度变化不大”,而“再向左管中滴加浓H2SO4至c(H+)≥7 mol·L-1,指针向左偏转幅度增大”得出的结论是“HCl 的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强”。
结 语
近几年,高考化学实验题的考查更注重实用性和开放性,控制变量法的探究实验是考查学生“科学探究与创新意识”的学科核心素养及科学探究能力、综合解决实际问题的能力的最重要的题型之一。因此,化学教师在高考复习中要求学生会用电化学知识与氧化还原反应、控制变量法,且结合一定的思维模型去解决有关双液电池的实验探究题。
