3T3-L1前体脂肪细胞诱导分化方法优化的初步探讨
2019-04-22郑美丽钟久昌杨新春
赵 蕾 郑美丽 杨 梅 钟久昌 杨新春
(首都医科大学附属北京朝阳医院心脏中心 北京市高血压重点实验室, 北京 100020)
肥胖是一项世界性健康难题,往往导致内分泌系统和心血管系统疾病的发生。阐明肥胖发生的分子机制并以此为基础治疗肥胖是目前医学研究的热点[1]。小鼠3T3-L1前体脂肪细胞是最常用来研究脂肪细胞的细胞系之一,通过序贯加入一定剂量的诱导剂,即经典鸡尾酒法,可得到分化成熟的脂肪细胞[2]。然而,传统鸡尾酒法包括的诱导剂,即3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine, IBMX)、地塞米松、胰岛素,使用后存在诱导效率低、分化效果不理想的问题[3]。因此,本研究旨在优化诱导3T3-L1前体脂肪细胞分化过程,通过比较不同成分诱导剂诱导分化成熟脂肪细胞的效率,以期获得一种高效的前体脂肪细胞诱导方法。
1 材料与方法
1.1 材料与试剂
小鼠前体脂肪细胞3T3-L1购自国家实验细胞资源共享平台、中国医学科学院基础研究所细胞中心。高糖DMEM、新生小牛血清(new calf serum, NCS)、0.25%(质量分数)胰酶、Penicillin-Streptomycin (双抗)(10 000 U/mL)购自美国Gibco公司,胎牛血清(fetal bovine serum, FBS)购自美国Hyclone公司,IBMX、胰岛素、地塞米松、吲哚美辛、罗格列酮购自德国Sigma公司,油红O染色液试剂盒购自北京索莱宝公司,三酰甘油测试盒购自南京建成生物工程研究所。
1.2 诱导分组
细胞按照不同诱导剂A组成成分,分为4组:(1)对照组(经典鸡尾酒法):IBMX(0.5 mmol/L)、胰岛素(10 mg/L)、地塞米松(1.0 μmol/L);(2)罗格列酮干预组:在经典鸡尾酒成分基础上,加用罗格列酮(2.5 μmol/L);(3)吲哚美辛干预组:在经典鸡尾酒成分基础上,加用吲哚美辛(0.2 mmol/L);(4)罗格列酮和吲哚美辛联合干预组:在经典鸡尾酒成分基础上,加用罗格列酮(2.5 μmol/L)和吲哚美辛(0.2 mmol/L)。
1.3 3T3-L1前体脂肪细胞诱导分化
小鼠3T3-L1前体脂肪细胞在含有10%(体积分数)NCS、100 U/mL Penicillin-Streptomycin的DEME培养基中培养,当细胞汇合度达到90%左右,传代并以5×105密度接种于6孔板中,待细胞生长至完全汇合后,接触抑制2 d,计为诱导分化0 d,更换新鲜培养基DMEM+10%(体积分数)FBS(2.5 mL/孔),分组加入诱导剂A,混匀,3 d更换诱导剂B(胰岛素10 mg/L),继续培养2 d后更换基础培养基DMEM+10%(体积分数)FBS,培养至11 d,得到诱导分化成熟的脂肪细胞。
1.4 油红O染色
分别于5、7、9、11 d显微镜下观察各组细胞形态变化,于11 d收集细胞并行油红O染色。采用索莱宝公司油红O染色液试剂盒,具体操作步骤如下:(1)移除培养基,PBS洗3次,加入ORO Fixtative固定液固定30 min;(2)弃去固定液,用去离子水洗2次;(3)加入60%(体积分数)异丙醇浸洗5 min;(4)弃去60%(体积分数)异丙醇(1 ml/孔),加入ORO Stain染液,浸染20 min;(5)弃去染色液,去离子水洗5遍,直到无多余染液,置于显微镜下观察、拍照,并运用Image Pro Plus 6.0图像处理软件统计经油红O染色后脂滴直径、数量以及脂滴面积。去除油红O染液,PBS洗3遍,每孔加入600 μL 60%(体积分数)异丙醇,室温静置30 min后,将溶液转移至96孔板中,酶标仪读取510 nmA值。
1.5 三酰甘油含量测定
于11 d收集各组细胞培养液,1 000 r/min,离心10 min,取上清后,参照三酰甘油测定试剂盒说明书,分别在96孔板中加入蒸馏水、校准品、待测样品以及工作液后,37 ℃孵育10 min,酶标仪读取510 nmA值,测得细胞分泌的三酰甘油浓度。收集各组细胞,PBS洗2遍,1 000 r/min,离心10 min,留取细胞沉淀,加入细胞裂解液100 μL,冰上裂解细胞30 min,裂解好的液体不离心,直接参照三酰甘油测定试剂盒说明书步骤,酶标仪读取510 nmA值。采用BCA法进行细胞内蛋白浓度定量后,根据公式计算得到细胞内三酰甘油浓度。
1.6 统计学方法

2 结果
2.1 3T3-L1前体脂肪细胞诱导分化后细胞形态学变化
3T3-L1前体脂肪细胞诱导分化前呈梭形,胞质均一无脂滴,诱导5 d后,各组细胞从梭形逐渐变成椭圆形,胞质饱满,体积较诱导前增大。诱导7 d,细胞体积继续增大,其中罗格列酮干预组、吲哚美辛干预组以及联合干预组的细胞胞质中开始出现零散的较明显的小脂滴,而对照组细胞不仅体积较小,同时未见明显脂滴形成。诱导9 d,各组细胞胞质中脂滴进一步增加,主要分布于细胞核周围,形成“戒环”,此时罗格列酮干预组、吲哚美辛干预组以及联合干预组细胞形成的脂滴分布较均匀,且形成的脂滴数量也明显较对照组多,与罗格列酮干预组、吲哚美辛干预组以及联合干预组相比,对照组不仅形成脂滴少,而且脂滴也偏小。11 d,各组细胞脂滴进一步增大,多个脂滴融合,形成大脂滴,相比罗格列酮干预组、吲哚美辛干预组以及联合干预组,对照组脂滴少且小(图1)。
2.2 油红O染色
油红O染色鉴定成熟脂肪细胞形成。如图2所示,罗格列酮干预组和联合干预组细胞形成的脂肪脂滴较对照组和吲哚美辛干预组多。定量检测结果显示,罗格列酮干预组酶标仪510 nm测得的A值为2.22±0.17,联合干预组1.67±0.04,两组A值均明显高于对照组0.75±0.03(P<0.001)。吲哚美辛组测得的A值为0.89±0.02,与对照组比较,差异无统计学意义(P>0.05)。

图1 3T3-L1前体脂肪细胞诱导分化过程中形态学变化Fig.1 Morphological changes during 3T3-L1 preadipocytes differentiation (100×)Control: normal control; Ros: rosiglitazone; Indo: indometacin; Ros+Indo: rosiglitazone+ indometacin.
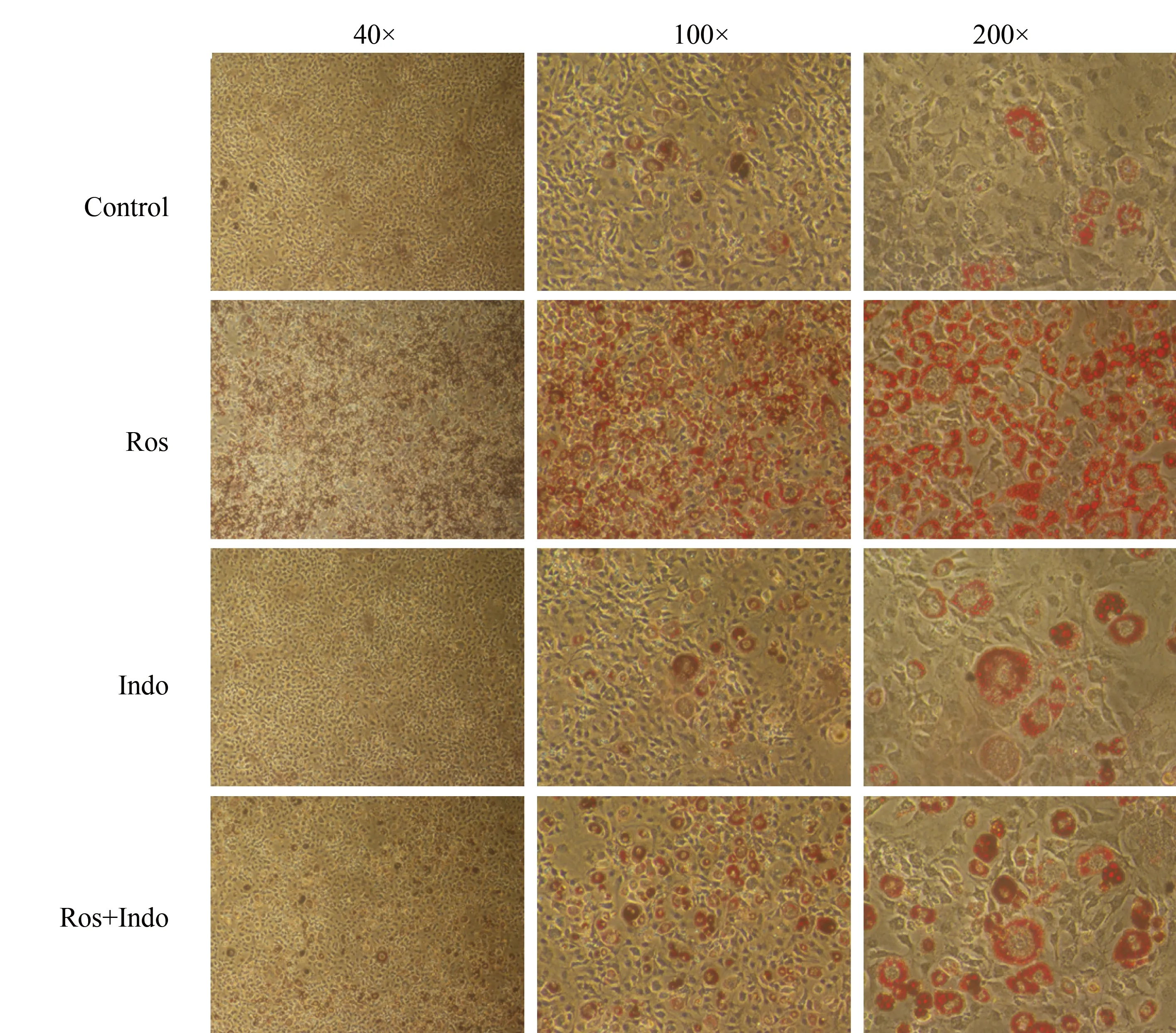
图2 3T3-L1前体脂肪细胞诱导分化为成熟脂肪细胞后油红O鉴定Fig.2 Adipocyte formation determined by oil red stainingControl: normal control; Ros: rosiglitazone; Indo: indometacin; Ros+Indo: rosiglitazone+ indometacin.
采用Image Pro Plus 6.0软件统计经油红O染色后的脂滴,如表1所示,一个视野下脂滴数量和脂滴总面积对照组均明显小于其余3组。单个脂滴具体参数中,罗格列酮组的平均直径大于对照组[(7.36±0.21)μmvs(5.60±0.26)μm,P<0.05],平均面积大于对照组[(54.92±4.49)μmvs(21.97±2.26)μm2,P<0.05],最大直径大于对照组[(10.49±0.39)μmvs(7.45±0.43)μm,P<0.01]。联合干预组的脂滴平均直径大于对照组[(7.86±0.23)μmvs(5.60±0.26)μm,P<0.001],平均面积大于对照组[(65.31±5.37)μmvs(21.97±2.26)μm2,P<0.01],最大直径大于对照组[(10.40±0.34)μmvs(7.45±0.43)μm,P<0.05]。而吲哚美辛组与对照组比较,差异无统计学意义(P>0.05)。罗格列酮组和吲哚美辛组相比,罗格列酮组形成脂滴的最大直径大于吲哚美辛组,联合干预组形成脂滴的平均直径和平均面积,均大于吲哚美辛单独干预组,而与罗格列酮单独干预组,差异无统计学意义(P>0.05, 图3)。

表1 3T3-L1成熟脂肪细胞脂滴参数Tab.1 Parameters of mature 3T3-L1 adipocyte

图3 3T3-L1成熟脂肪细胞各组脂滴参数Fig.3 Parameters of mature 3T3-L1 adipocyte in each group
A: mean diameter of adipocyte;B: mean area of adipocyte;C: maximum diameter of adipocyte;*P<0.05,**P<0.01,***P<0.001;Control: normal control;Ros: rosiglitazone;Indo: indometacin;Ros+Indo: rosiglitazone+ indometacin.
2.3 3T3-L1细胞中三酰甘油含量测定
油红O染色后定量检测间接反映胞内三酰甘油含量,罗格列酮干预组和联合干预组明显高于其他组(图4A)。通过试剂盒直接检测细胞内形成的三酰甘油含量,对照组(0.19±0.02)mmol/g,罗格列酮组(0.51±0.11)mmol/g,吲哚美辛组(0.50±0.18)mmol/g,联合干预组(0.77±0.07)mmol/g,其中联合干预组明显高于对照组(P<0.05)(图4B)。最后检测培养基中三酰甘油含量,对照组的三酰甘油含量为(0.08±0.04)mmol/g,罗格列酮组(0.28±0.06)mmol/g,吲哚美辛组(0.30±0.07)mmol/g,联合干预组(1.17±0.65)mmol/g,各组间差异无统计学意义(F=0.92,P=0.47)。
3 讨论
3T3-L1前体脂肪细胞作为一种小鼠胚胎成纤维细胞,具有一定的定向分化潜能。当给予一定剂量的诱导剂,激活脂肪细胞分化信号通路,可以在诱导剂作用下促使3T3-L1前体脂肪细胞分化成为成熟脂肪细胞[4-5],而如何得到数量较多且分化程度较高的成熟脂肪细胞对于后续实验的进行也是至关重要。本研究在经典鸡尾酒诱导剂的基础上,分别加用罗格列酮和/或吲哚美辛,观察对于3T3-L1前体脂肪细胞诱导分化的影响,并通过油红O染色鉴定、三酰甘油含量测定评价各组诱导分化效率。研究[5]显示,罗格列酮加用后前体脂肪细胞诱导分化效率明显提高,而加用吲哚美辛的效果不及罗格列酮。

图4 诱导分化成熟的3T3-L1脂肪细胞中三酰甘油含量Fig.4 Triglyceride (TG) contents in mature 3T3-L1 adipocyte
A: absorbance at 510 nm of quantified oil red staining;B: intracellular TG contents determined by enzymatic assay;*P<0.05,**P<0.01,***P<0.001;Control: normal control;Ros: rosiglitazone;Indo: indometacin;Ros+Indo: rosiglitazone+ indometacin;TG:triglyceride.
3T3-L1前体脂肪细胞在诱导分化过程中,主要通过调控一系列诱导分化的转录因子表达实现成脂过程[6],其中过氧化物酶体增生因子活化γ型受体(peroxisome proliferator-activated receptor, PPAR-γ)是关键因子之一[7]。PPAR是调控目标基因表达的核内受体转录因子超家族,根据结构不同,分为α、β、γ 3种类型,其中PPAR-γ主要调控脂肪细胞分化和胰岛素抵抗[8]。罗格列酮,属于噻唑烷二酮类胰岛素增敏剂,也是特异性PPAR-γ高效激动剂[9]。
本研究中,在经典鸡尾酒诱导剂基础上加用罗格列酮后,3T3-L1前体脂肪细胞更早出现脂滴,形成的脂滴也较对照组多,同时三酰甘油含量也较多,提示罗格列酮通过进一步激活PPAR-γ促进成脂过程。吲哚美辛,属于非甾体类抗炎药,已有研究[10]显示,非甾体类抗炎药也可以与PPAR-γ结合并使其活化。本研究中加用吲哚美辛后,前体脂肪细胞也较早形成脂滴,但是脂滴直径与面积以及三酰甘油浓度与对照组差异无统计学意义(P>0.05),因此,相比罗格列酮,吲哚美辛激动PPAR-γ能力较弱。在三酰甘油生成含量的测定中,虽然油红O染色间接定量中,加用PPAR-γ激动剂后生成含量增加,但是直接法测定的胞外三酰甘油浓度经过蛋白含量校正后,4组间差异无统计学意义。而在同时加用吲哚美辛和罗格列酮的诱导剂诱导过程中,细胞内形成的三酰甘油浓度高于对照组,单用以上两种药物生成的三酰甘油浓度并没有任何优势,因此提示可以适量加用两种及以上药物共同激动PPAR-γ表达,促进成脂过程,增加胞内三酰甘油浓度。如何进一步提高胞外三酰甘油浓度以及药物浓度是否影响诱导分化过程亟须进一步明确。
本研究初步提示在经典鸡尾酒诱导剂基础上适量加用PPAR-γ受体激动剂,可有效提高3T3-L1前体脂肪细胞分化效率,增加三酰甘油浓度,为后续以脂肪细胞为基础的实验提供一个较理想的细胞模型。有关PPAR-γ受体激动剂的选用,目前推荐噻唑烷二酮类罗格列酮,较非甾体类抗炎药诱导分化效果更好。
