荔枝核有效成分富集物抑制细胞摄取胰岛素的机制
2019-04-22满淑丽
满淑丽,王 莹,马 江,王 媛,马 龙
(天津科技大学生物工程学院,天津 300457)
2型糖尿病是由多种病因引起的胰岛素分泌缺陷或/和胰岛素作用障碍所导致的糖、蛋白质、水、脂肪和电解质等代谢紊乱综合征,临床上以高血糖为主要标志.目前临床上常用的口服降血糖药主要包括胰岛素分泌促进药物(磺酰脲类、瑞格列奈)、α-糖苷酶抑制剂、胰岛素增敏药(双胍类)等.荔枝核为无患子科植物荔枝(Litchi chinensis Sonn.)的干燥成熟种子,具有行气散结、祛寒止痛作用,能够用于治疗寒疝腹痛、睾丸肿痛,性甘、微苦、温,归肝、肾经[1].《本草纲目》记载:“荔枝核治癫疝气痛,妇人血气刺痛”.含有荔枝核(litchi semen,LSE)的复方合剂对降低糖尿病小鼠血糖、血脂的效果与临床降糖药二甲双胍效果相似[2],二甲双胍可以通过激活肌肉等组织中的腺苷酸活化蛋白激酶(AMPK)[3],抑制因脂肪酸诱导产生的胰岛素抵抗(IR)[4].荔枝核提取物可以通过改善糖尿病大鼠的氧化应激、炎症损伤[5]、脂代谢等以减轻对大鼠器官的损伤程度[6].前期实验[6]发现其与糖代谢、脂代谢相关,而 AMPK是调控糖代谢、脂代谢通路的直接蛋白.因此,猜测荔枝核提取物对脂代谢的调节主要是通过对组织器官中 AMPK的含量进行调节.本文构建了胰岛素抵抗细胞模型,深入探讨荔枝核提取物对 IR细胞 AMPK的转录和翻译表达量的影响.
1 材料与方法
1.1 原料、试剂与仪器
干燥的荔枝种子(核)于2014年12月购自云南,经天津科技大学生物工程学院王春霞老师鉴定为药典正品.人肝癌细胞 HepG2由中国协和医科大学基础医学研究所提供.
甲醇、二甲基亚砜和乙腈,分析纯,天津市康科德科技有限公司;芦丁根皮苷,四川省维克奇生物科技有限公司;薯蓣皂苷,上海研拓生物科技有限公司;磷酸钾、二甲基亚砜(DMSO),天津市化学试剂二厂.
9700型 PCR扩增仪,美国 Applied Biosystems公司;Agilent 7980A型气相色谱仪、Agilent 5975C型质谱检测器,安捷伦公司;凝胶成像仪,美国Pharmacia Biotech公司;TGL-16C型台式离心机,上海安亭科学仪器厂;D-101型大孔树脂,河北翔泰蓝星精细化工有限公司.
1.2 荔枝核有效成分提取方法及含量测定
称取荔枝核 1kg洗净,烘干破碎,依次用 95%、60%、30%乙醇和去离子水煮 2h,每种溶剂重复两次,收集所有液体混合,浓缩.使用大孔树脂柱[4,6]富集荔枝核不同极性层,依次用去离子水和体积分数为30%、50%、70%的乙醇为洗脱液依次洗脱.对洗脱液分别旋转蒸发,烘干后获得 3种提取层记为LSE30、LSE50、LSE70,准确称量并记录.
总多酚含量的测定:以 0.1g/mL没食子酸的水溶液为标准品,绘制标准曲线.分别取 10mg LSE30、LSE50、LSE70,加蒸馏水定容至 10mL.取1mL置于10mL容量瓶中,加入6mL蒸馏水,溶解均匀后,再加入 0.5mL福林试剂,1min后加入 10%碳酸钠溶液1.5mL,混匀定容.75℃水浴加热10min,在 765nm 处测定吸光度,进行 3组平行实验.利用回归方程计算供试液中多酚的含量[4].
总黄酮含量的测定:以 0.6g/mL芦丁甲醇溶液为标准品,在 510nm 处测定吸光度,绘制标准曲线.配制0.5mg/mL LSE甲醇溶液,取1.0mL置于试管中,依次加入 5%的亚硝酸钠溶液 1mL、十水硝酸铝溶液 0.5mL,每种试剂加完后静置 5min,混匀后补加4%的氢氧化钠溶液5mL,加蒸馏水至12.5mL,混匀,15min后测量其吸光度,进行 3组平行实验.利用回归方程计算供试液中黄酮的含量[7].
总皂苷含量的测定:用甲醇配制 0.4g/mL薯蓣皂苷[7]为标准品,在 535nm 处(全波段扫描 535nm处有最大吸收峰)测定吸光度,绘制标准曲线.取10mg LSE加蒸馏水溶解,定容至10mL,取50µL水浴挥干,加入 4%香草醛冰醋酸溶液 40µL、高氯酸160µL,混匀后塞紧试管塞.在 55℃烘箱中反应15min,冰水浴 3min,加入 1mL冰醋酸摇匀,测定吸光度,进行 3组平行实验.利用回归方程计算供试液中皂苷的含量.
总多糖含量的测定:在 620nm 处测定吸收峰,以 100µg/mL葡萄糖水溶液为标准品,绘制标准曲线.准确称量 10mg LSE,加水定容至 10mL.取1mL置于试管中,将试管置于冰水中,加入 4mL蒽酮-硫酸试液,冷却后在沸水中煮沸 7min,重复之前冷却操作,降至室温,测定吸光度,进行 3组平行实验.计算总多糖含量[8].
原花青素含量的测定:以 1mg/mL甲醇原花青素B溶液为标准品溶液,绘制标准曲线.1mg/mL样品溶液 20µL、4%香兰素溶液 120µL、浓盐酸 60µL混合,30℃暗处反应 20min.在 500nm 波长处测定吸光度,进行 3组平行实验.利用回归方程计算供试液中原花青素的含量[9].
1.3 HepG2细胞胰岛素抵抗模型建立
胰岛素最佳浓度的确定:取对数生长期的 HepG2细胞,胰蛋白酶消化[7],将含 2%胎牛血清的 DMEM培养基置于 96孔板,细胞密度约为 106L-1.设置空白组(不包含细胞)、模型组,培养 24h.待细胞单层贴壁后,更换新鲜培养基,模型组的胰岛素终浓度分别为 10、1、10-1、10-2、10-3µmol/L,37℃、5% CO2培养箱中孵育 36h.更换无血清培养基孵育 24h,检测培养基上清液中剩余葡萄糖含量.
胰岛素最佳作用时间的确定:设置空白组和模型组,模型组加入新鲜配制的胰岛素最佳浓度的培养基,37℃、5% CO2培养箱中孵育 24、36、48h,更换无血清培养基孵育24h,测定葡萄糖含量.
1.4 荔枝核提取物对胰岛素耐受细胞的作用
分别设空白组(无细胞)、对照组(正常细胞)、模型对照组(胰岛素抵抗细胞,不加药)和模型加药组(胰岛素抵抗细胞,加药 2.5、5.0mg/mL).药物作用1d后,分别检测培养基中葡萄糖含量,计算各组细胞的耗糖量.
1.5 MTT法检测胰岛素抵抗模型的细胞凋亡
按照上述方法获得具有胰岛素抗性的HepG2细胞,使用血细胞计数板计数,接种于 96孔板内,分组,分别加入 LSE30、LSE50、LSE70;作用 24h后弃去药液,加入 0.5mg/mL MTT,置于培养箱中 4h后弃去上清液;加入 100µL DMSO,待结晶完全溶解后,使用酶标仪在波长 570nm 下测定吸光度,并计算细胞存活率.
1.6 Real-time PCR基因表达分析
称取糖尿病模型大鼠肝组织 50.0mg,在液氮作用下碾碎,迅速加入1mL Trizol充分研磨,向EP管中依次加入提取的 mRNA 1~5µg、Oligo(dT)12-18 2µL,2.5mmol/L dNTP 混合物(pH 中性)8µL,灭菌蒸馏水补足至 15µL;70℃加热 5min,冰上冷却2min;依次加入 5×First-Strand缓冲液 4µL和TIANScript M-MLV 1µL(200U),混匀.再向 200µL的离心管中加入 Template(<1µg)、Primer1(10µmol/L) 1µL、Primer2(10µmol/L)1µL、10×Tap Buffer 5µL、DNTP Mixture(2.5µmol/L) 4µL、DNA Polymerase(2.5U/µL)1µL ,灭菌蒸馏水补足至50µL,进行 PCR 反应.GAPDH 上游引物为 5′-ATTCAACGGCACAGTCAAGG-3′,下游引物为 5′-CTCACCTCCTCCAAGTTATT-3′;AMPKα2 上游引物为 5′-GCAGAAGGGGCGGAGATGA-3′,下游引物为 5′-TCAGATGGGCTTATACAGC-3′.
1.7 免疫印迹实验(Western blot)蛋白表达分析
100mmol/L 苯甲基磺酰氟(PMSF)用 RAPI裂解液稀释 100倍.称取 100mg肝组织冰上研磨,加入10倍体积的含有PMSF和RAPI的裂解液,将液体转入 EP管在冰上裂解 30min,12000r/min离心15min.取上清液,加入 3倍体积的 4×SDS上样缓冲液,100℃水浴 5min,冷却至室温.进行 SDSPAGE电泳实验,电流为 150mA,时间 40min.将转好的 PVDF膜放入封闭液中,室温封闭 1h.然后将一抗按说明书稀释,把膜放入一抗中室温下孵育2h,TBST洗 5次,每次 5min.将二抗按说明书稀释,把 PVDF膜放入二抗中,室温下孵育 1h,TBST洗3次,每次10min;用PBS洗1次,红外Odessy扫描仪扫描.
1.8 数据处理
采用 IBM SPSS statistics软件进行数据处理,*表示组间具有显著差异(P<0.05).
2 结果与分析
2.1 荔枝核提取物定量分析结果
按照 1.2节分别获得 LSE30、LSE50和 LSE70的质量分别为 10.30、99.08、74.58g.通过紫外-可见分光光度法分别测得 LSE30、LSE50、LSE70中的总多酚、总黄酮、总皂苷、总多糖和原花青素的含量见表 1.LSE50中总多酚、总黄酮、总皂苷和原花青素的提取产率最高,而总多糖的提取产率随乙醇浓度的增加而下降.
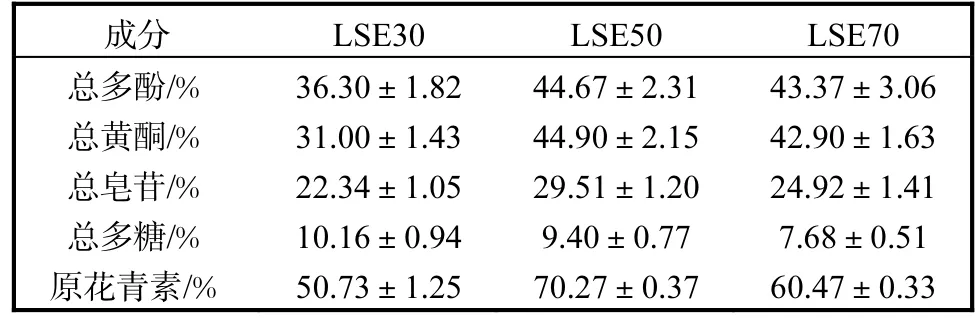
表1 荔枝核提取物各成分总含量Tab. 1 Total content of each component in LSE
2.2 胰岛素抵抗模型的建立
体外胰岛素抵抗作用的间接反映就是细胞对葡萄糖的利用率降低.对比图 1(a)各组葡萄糖浓度,胰岛素浓度为1μmol/L时,培养基中葡萄糖浓度最高,细胞对胰岛素的抵抗作用最强,因此选择此胰岛素浓度为细胞建模的最佳浓度.
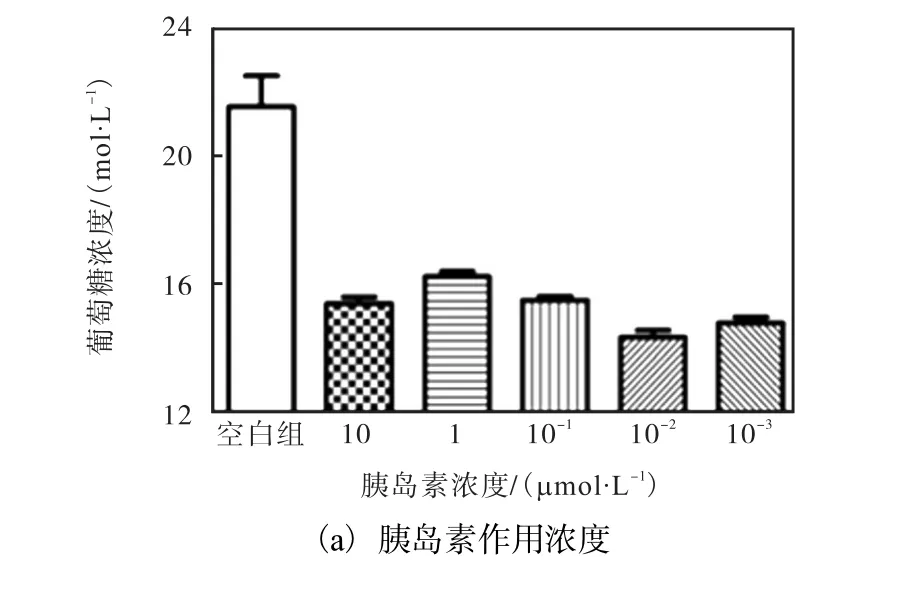
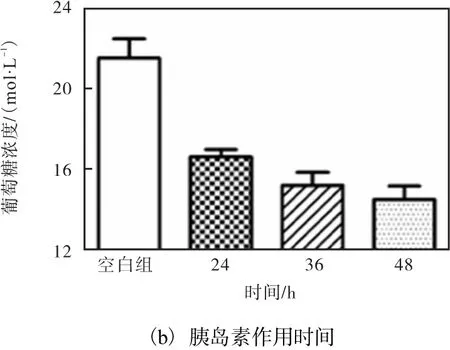
图1 HepG2细胞胰岛素抵抗模型的建立Fig. 1 Insulin resistance model established with HepG2 cell
由图 1(b)可知,作用 24h细胞对葡萄糖的利用率最高,随着时间的推移,细胞对葡萄糖的利用率逐渐降低,因此选择24h为细胞建模的最佳时间.综上所述,浓度为 1μmol/L胰岛素对 HepG2细胞作用24h后的细胞即为胰岛素抵抗模型细胞.
2.3 MTT法测定成模细胞的活力
采用 MTT法测定荔枝核的提取物对 HepG2细胞活力的影响,结果见表 2.随着药物浓度的升高,细胞的存活率逐渐降低;在相同浓度下,LSE50和LSE70的细胞存活率基本相同且低于 LSE30.为准确量化 3种样品对细胞杀伤能力的大小,应用 SPSS 20.0软件计算存活率达到 50%的时候的 IC50值.LSE30、LSE50和 LSE70的 IC50值分别为 24.60、11.70、12.02μg/mL.IC50值越小,则证明该样品对HepeG2细胞杀伤能力越强.LSE50和 LSE70对HepG2细胞的杀伤能力近似相等且远远强于LSE30.这可能与其黄酮、多酚类物质的含量较高有关系.
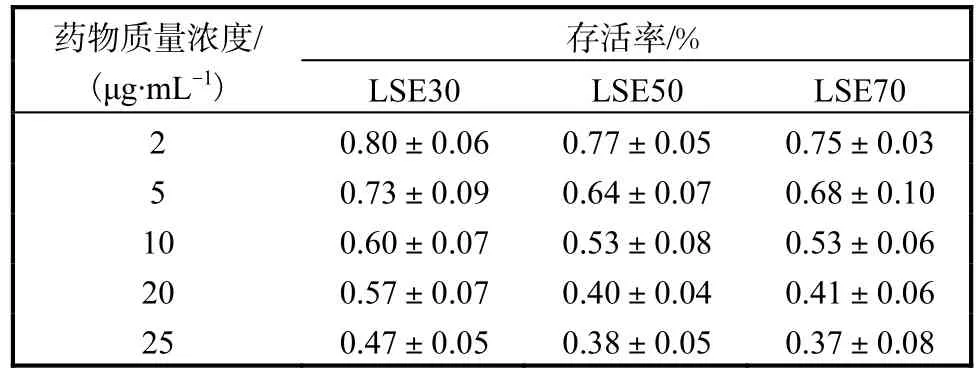
表2 各实验组HepG2细胞存活率(n=4)Tab. 2 HepG2 cell survival in every experimental group(n=4)
2.4 荔枝核提取物对体外胰岛素抵抗细胞模型的作用
荔枝核提取物对胰岛素抵抗模型细胞的作用如图 2所示,*表示与模型组相比有显著差异(P<0.05).5.0、2.5 µg/mL的 LSE70和 LSE50都有降糖活性,组间不存在显著差异,但与模型组相比存在显著差异(P<0.05);随着药物浓度的升高,降糖效果会逐渐增强,但药效增强的同时,会造成对细胞的损伤.以上实验证明,LSE50和 LSE70活性均很好,由表 1可知组成也相当,所以下面以 LSE70实验组为例,开展下述实验.
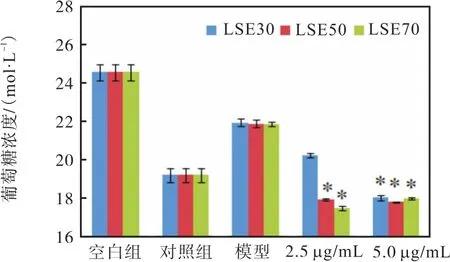
图2 荔枝核提取物对胰岛素抵抗细胞模型摄取葡萄糖的促进作用Fig. 2 Effect of LSE on glucose uptake of HepG2 cells with insulin resistance
2.5 荔枝核提取物对 AMPK基因转录和蛋白表达的影响
以生物能量代谢调节的关键分子AMPK为出发点,从细胞能量代谢的角度分析降糖机制.由于AMPK 的α 亚基起催化作用,α 2亚单元在肝脏、骨骼肌和心肌中表达较高,本实验使用的细胞为肝细胞,所以在AMPK三聚体中选择α 2亚单元进行基因和蛋白水平的分析.用 Real-time PCR法和 Western blot法检测相关基因和蛋白的表达,结果如图3和图4所示.由图3和图4可知:LSE组可逆转因高浓度胰岛素诱导而导致的 AMPKα 2基因水平下降以及逆转因高浓度胰岛素诱导而导致的 p-AMPK蛋白水平的下降.
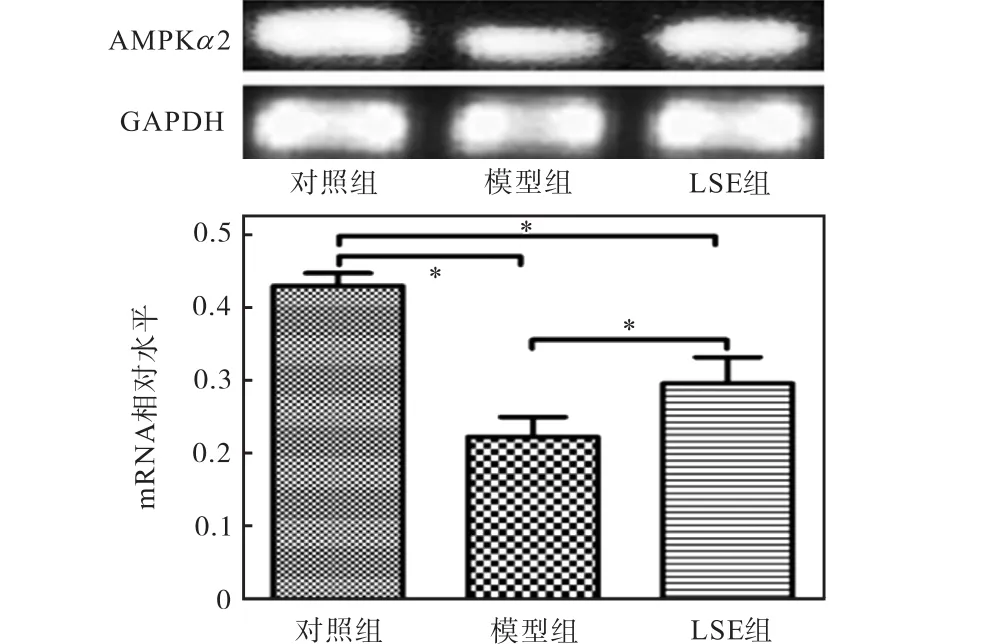
图3 荔枝核提取物对 HepG2细胞中 AMPK基因转录的影响Fig. 3 Effect of LSE on AMPK gene transcription in HepG2 cells
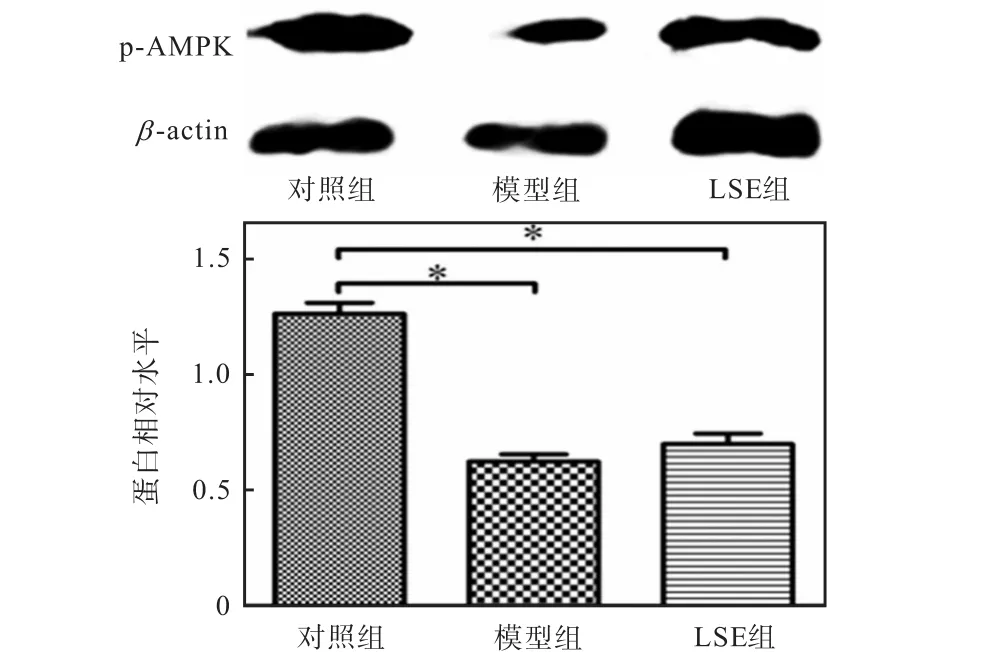
图4 荔枝核提取物对 HepG2细胞中 AMPK蛋白表达的影响Fig. 4 Effect of LSE on AMPK protein expression in HepG2 cells
3 讨 论
糖尿病是威胁人类健康的主要疾病之一,病死率仅次于肿瘤和心血管疾病,且其在发达国家和发展中国家均以指数形式增加,年轻化趋势明显.荔枝核中富含有黄酮[8]、多酚、皂苷和多糖类化合物.荔枝核对血清中升高的丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)活性具有抑制作用,并能提高肝组织血清超氧化物歧化酶(SOD)的活力[10],使肝细胞免受损伤,从而达到治疗肝损伤目的[11].荔枝核提取物有调节血糖、改善糖尿病糖脂代谢紊乱和预防糖尿病并发症发生的作用[6].2型糖尿病是由肝脏葡萄糖产生增加、利用葡萄糖异常及胰岛素分泌不足引起的,以胰岛素抵抗和胰腺 β细胞功能失常为特征的疾病.AMPK是一种保守的异源三聚体,其酶活力能够被腺嘌呤核糖核苷酸(AMP)上调.该蛋白质激酶能够通过感受细胞能量状态来维持真核细胞的三磷酸腺苷(ATP)生成和消耗的平衡,即形成能量稳态.AMPK是机体保持葡萄糖平衡所必需的.由于分子机制十分复杂,药物分子激活 AMP是一个巨大的挑战,但其激活能改善由 2型糖尿病引起的代谢失衡.同时,AMPK 在调控细胞生长和增殖、建立和稳定细胞极性、调节动物寿命、调控生理节律等方面也起着重要作用.目前有报道[6]称荔枝核提取物可以显著调节餐后血清中的脂类和胆固醇的含量,前期实验发现其与糖、脂等代谢通路相关,而AMPK是其调控通路的直接蛋白,本实验验证了这一思路.Qi等[12]通过用不同体积分数的乙醇对荔枝核中不同极性层的有效成分进行提取比较后,对使用荔枝核提取物灌胃治疗的糖尿病大鼠的肝脏组织的 AMPKα 2和 p-AMPK的表达量进行了比较及分析.文献[5]报道用乙酸乙酯萃取的方法并不能对荔枝核中的原花青素起到富集的作用,但是可以起到富集荔枝核提取物中多酚和类黄酮类成分的作用.LSE50和 LSE70的化学成分和生物活性都极其相似,工业生产中可以将LSE50和LSE70两层合并提取.AMPK通路的激活能改善由 2型糖尿病引起的代谢失衡.本研究发现,荔枝核提取物可以阻止因高浓度胰岛素诱导而导致的 AMPKα 2水平降低,调节和改善能量代谢.因此可以推测,荔枝核提取物对糖尿病模型大鼠的降糖作用可能与 AMPK的表达变化有关,相关的机制还需要进一步研究.
