HDAC抑制剂SAHA抑制人乳腺癌细胞MCF-7的迁移和增殖
2019-04-22姚海淋霍丽红郝云鹏来永巍段慧鑫欧国芳何红鹏
姚海淋,霍丽红,郝云鹏,来永巍,段慧鑫,欧国芳,何红鹏
(天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
乳腺癌是女性中最常见的恶性肿瘤之一[1],从美国癌症协会(ACS)统计的数据分析,乳腺癌患者人数预计占所有新诊断癌症患者的 1/2,乳腺癌已成为全球范围内危害女性身体健康的头号杀手[2-3].乳腺癌主要是由于乳腺上皮细胞在致癌因子的作用下发生基因突变,成为不受调控、可以无限增殖的癌细胞而导致的[4].
以组蛋白为代表的蛋白质乙酰化修饰是表观遗传学研究的重要内容,通过乙酰化修饰改变蛋白质空间构象和所带电荷,从而增强或削弱蛋白质的生物学功能[5].乙酰化修饰是可逆的生物学反应,行使去乙酰化功能的组蛋白去乙酰化酶(histone deacetylase complex,HDAC)更是临床肿瘤抑制剂研发的热点[6].通过抑制 HDAC活性,诱导组蛋白的适度乙酰化状态,将高度有序的染色体打开,促进转录因子与DNA结合,从而使受抑的肿瘤抑制基因得到表达,起到治疗肿瘤的作用[7].
组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)通过抑制 HDAC 的活性而使组蛋白过乙酰化,进而通过抑制血管新生、细胞周期阻滞、诱导细胞凋亡、调节转录因子活性等作用而产生较强的抗肿瘤效应,因此在抗肿瘤方面有良好的应用前景.SAHA(suberoylanilide hydroxamic acid)是继HMBA(hexamethylene bisacetamide)之后的第二代氧肟酸类组蛋白去乙酰化酶抑制剂,它比 HMBA具有更高的活性,在微摩尔(µmol/L)水平即对肿瘤细胞有很大的杀伤效果[8].SAHA 是小相对分子质量(<300)线性肟酸,是广谱组蛋白去乙酰化酶抑制剂,可以抑制Ⅰ类和Ⅱ类 HDAC的活性,其作用机制为通过结合到酶的活性位点而抑制HDAC的活性[9-10].
SAHA是目前研究最多、最深入的组蛋白去乙酰化酶抑制剂,在一些疾病的研究与治疗中已有重要应用.多数研究认为 SAHA的抗肿瘤机制与上调 p21基因表达有关:王筝等[8]研究表明SAHA可以通过促进 p21基因和 Bax基因的表达,能够在体外抑制人卵巢癌SKOV3细胞的生长并促进其凋亡;于涛等[11]研究表明 SAHA可以诱导骨髓瘤细胞的凋亡,选择性诱导细胞周期负调控子p21的表达,从而阻滞细胞周期,诱导多种肿瘤细胞的分化和凋亡.以往对SAHA抗肿瘤作用研究主要集中于其对细胞增殖和凋亡的影响.本研究用SAHA处理乳腺癌细胞,分别从细胞水平、蛋白水平以及 RNA分子水平上观察SAHA对乳腺癌细胞迁移和增殖的影响.
1 材料与方法
1.1 细胞株和细胞培养
人乳腺癌细胞 MCF-7、人脐静脉内皮细胞HUVEC细胞为本实验室保藏.细胞用 DMEM/F12培养基(Gibco公司),添加 10%灭活胎牛血清(FBS)、100U/mL青霉素和100µg/mL链霉素,37℃、5% CO2培养箱中培养,用0.25%的胰酶消化传代.
1.2 主要试剂
青链霉素,Gibco公司;胎牛血清,天津康源生物技术有限公司;GAPDH单克隆抗体、CyclinD1抗体、CDK4抗体、p21抗体,Santa公司;MYL9抗体,Abcam 公司;M-MLV 逆转录酶、Trizol 裂解液、RNA 酶抑制剂,Invitrogen 公司;Fast SYBR Green Master Mix,Applied Biosystems公司;SAHA、DMSO,上海赛金生物科技公司.
1.3 细胞划痕实验
将 MCF-7细胞接种于 6孔板,培养 18~24h.在每孔中央用 10µL吸头垂直划两条宽度为300~500µm的无细胞交叉划痕区.用PBS清洗,加入含 1% FBS的 DMEM/F12培养基继续培养.将DMSO 溶液加入对照组中,将 SAHA 按照 2.5、5、10、20µmol/L的浓度加入实验组中.每隔 12h在荧光倒置显微镜下观察每孔中划痕宽度变化情况,拍照并记录划痕宽度(愈合快慢),愈合快慢代表 MCF-7细胞在培养板上迁移率大小.

1.4 Transwell实验
按每孔约5×105个细胞铺在24孔Transwell上层小室中,下室加含药培养基(含 10% FBS)500~600µL;培养 16h后,将孔板取出,PBS洗 3次;用500~600µL含 4%多聚甲醛溶液固定小室下层细胞20min;PBS洗3次;500~600µL 100%甲醇放在24孔板中,小室浸在其中,室温放置 20min;PBS洗 3次;吉姆萨染色,通过激光扫描共聚焦显微镜计数上、下、左、右、中这5个视野下的细胞数并拍照.
1.5 免疫印迹(Western blot)检测
收集处理组及阴性对照组 MCF-7细胞,加入200µL SDS 细胞裂解液,4℃裂解20min,用细胞刮刀收集蛋白于1.5mL EP管中,煮沸5min,取蛋白进行SDS-PAGE电泳.电泳完毕,利用半干转膜仪将蛋白转移至 NC膜上,用质量分数为 5%的脱脂奶粉室温封闭 1h,一抗于 4℃下孵育过夜.然后用 PBS 缓冲液(PBST)漂洗 NC膜 3次,每次5min.洗完后于室温下二抗避光孵育 1h,PBST漂洗 3次,每次5min.洗完后,用 Odyssey红外激光成像系统成像,以甘油醛-3-磷酸脱氢酶(GAPDH)作对照.
1.6 细胞 RNA的提取及逆转录实时荧光定量 PCR(RT-qPCR)
收集细胞,Trizol法提取总 RNA后逆转录成cDNA,以此为模板进行实时荧光定量 PCR.在Invitrogen公司合成以下引物:GAPDH上、下游引物5′-ATTCAACGGCACAGTCAAGG-3′和 5′-GCAGAA GGGGCGGAGATGA-3′,产物大小 213bp;p21 上、下游引物 5′-GACACCACTGGAGGG TGACT-3′和5′-CAGGTCCACATGGTCTTCCT-3′,产 物 大 小172bp;CyclinD1 上、下游引物 5′-GCTGCGAAGTG GAAACCATC-3′和 5′-CCTCCTTCTGCACACATT TGAA-3′,产物大小 135bp.
1.7 MTT实验
收集对数期细胞,调整细胞悬液浓度,将其加入96孔板中,每孔加入 100µL,使待测细胞密度为1000~10000个/孔.过夜培养,加入浓度梯度的药物,设置 3~5个复孔.孵育 24h,倒置显微镜下观察.每孔加入 10µL MTT溶液(5mg/mL,即 0.5%MTT),避光条件下进行,继续培养4h.终止培养,吸去孔内培养液,每孔加入100µL二甲基亚砜,置摇床上低速振荡 10min,使结晶物充分溶解.在酶联免疫检测仪 490nm 处测量各孔的吸光度(A),按照式(2)计算存活率.

1.8 克隆形成实验
将胰酶消化后的单个细胞以适当密度接种于 6孔板中,每孔接种 100~200个细胞进行培养.细胞贴壁后,将浓度梯度的药物加入到 6孔板中.待培养皿中出现肉眼可见的克隆时,终止培养.用PBS清洗3次.向每孔中加 4%的多聚甲醛,固定细胞 15min.去除固定液,加适量吉姆萨染色液染色 10~30min,然后用去离子水缓慢洗下染色液,将6孔板倒扣在滤纸上,干燥.再将 6孔板倒扣在一张白色的纸上,拍照并比较克隆数.
1.9 数据分析
采用Graphpad Prism 6软件进行数据处理,与对照组相比进行显著性分析:*表示 P<0.05,**表示P<0.01,***表示 P<0.001.
2 结果与分析
2.1 SAHA作为HDAC抑制剂的有效剂量范围
为了确定SAHA发挥HDAC抑制剂作用的有效浓度,用 SAHA处理 MCF-7细胞,进行了免疫印迹实验,检测组蛋白的乙酰化,结果如图1所示.

图1 SAHA阻断组蛋白的去乙酰化Fig. 1 Histone deacetylation blocked by SAHA
由图1可知:相对于对照组,当SAHA的浓度由2.5µmol/L增加到 20µmol/L时,组蛋白 H4的乙酰化水平(acH4)是逐渐上调的.这表明组蛋白去乙酰化反应被阻断,SAHA在此浓度范围可以抑制HDAC活性,且具有浓度依赖性.
2.2 SAHA对乳腺癌细胞MCF-7迁移的影响
为了检测SAHA对MCF-7细胞迁移的影响,进行了体外划痕实验与 Transwell实验.以不加 SAHA的MCF-7细胞作为对照组,与对照组相比,加药48h后,随着SAHA浓度的升高,MCF-7细胞划痕愈合明显减慢(图2);Transwell实验中,相对于加DMSO的对照组,加SAHA的实验组MCF-7细胞的跨膜迁移的个数比较少(图 3).这表明 SAHA 对细胞的迁移具有抑制作用.

图2 划痕实验检测SAHA对MCF-7细胞迁移的影响Fig. 2 Wound healing assay to detect the effects of SAHA on the migration of MCF-7 cells

图3 Transwell 实验检测 SAHA对 MCF-7细胞迁移的影响Fig. 3 Transwell assay to detect the effects of SAHA on the migration of MCF-7 cells
2.3 SAHA对MCF-7细胞迁移相关基因表达的影响
为了探索 SAHA抑制 MCF-7细胞迁移的分子机制,检测了SAHA对MCF-7细胞中与迁移关系密切的MYL9基因表达的影响,如图4所示.相对于对照组,加SAHA的实验组的迁移相关基因 MYL9蛋白的表达量是逐渐下调的,这说明 SAHA可以抑制迁移相关基因蛋白的表达.

图4 SAHA抑制迁移相关基因MYL9的表达Fig. 4 SAHA inhibiting the expression of MYL9
2.4 SAHA对乳腺癌细胞MCF-7增殖的影响
为了检测SAHA对MCF-7细胞增殖的影响,分别进行了 MTT实验与克隆形成实验(吉母萨染色,记录克隆数).图 5是验证 SAHA对肿瘤 MCF-7细胞与非肿瘤HUVEC细胞存活影响的实验.

图5 MTT实验检测 SAHA对 MCF-7和 HUVEC细胞增殖的影响Fig. 5 MTT assay to detect the effects of SAHA on proliferation of MCF-7 and HUVEC cells
由图 5可见:SAHA对MCF-7细胞的存活具有抑制作用,随着药物浓度的增加,MCF-7细胞的存活率逐渐降低.而对于 HUVEC细胞,只有在高浓度时,其存活率下调明显.因此,这表明 SAHA可以抑制肿瘤 MCF-7细胞的存活,对非肿瘤细胞 HUVEC存活抑制不明显.
图6和图7是SAHA对MCF-7与HUVEC细胞增殖影响的实验.用 SAHA处理 MCF-7细胞时,当药物浓度在 2.5µmol/L与 5µmol/L两个较低的浓度时,形成的克隆数目就已经很少,当浓度较高时,便已不能形成克隆,这说明SAHA可以抑制MCF-7细胞的增殖(图 6).而对于 HUVEC细胞,只有在高浓度时(20µmol/L),其克隆形成数目下降明显;在低浓度时,SAHA对HUVEC细胞的克隆形成数目影响不大(图 7).因此,这表明 SAHA 可以抑制 MCF-7细胞的增殖,且肿瘤细胞 MCF-7比非肿瘤细胞HUVEC对SAHA更加敏感.

图6 克隆形成实验检测SAHA对MCF-7细胞增殖的影响Fig. 6 Colony forming assay to detect the effects of SAHA on proliferation of MCF-7 cells


图7 克隆形成实验检测 SAHA对 HUVEC细胞增殖的影响Fig. 7 Colony forming assay to detect the effects of SAHA on proliferation of HUVEC cells
2.5 SAHA对乳腺癌细胞 MCF-7增殖相关基因表达的影响
为了检测 SAHA对增殖相关基因 CyclinD1、CDK4与 p21的影响,运用实时荧光定量 PCR和免疫印迹方法从 mRNA和蛋白表达水平上进行了检测,以加DMSO的为对照组,结果如图8和图9所示.

图8 SAHA对增殖相关基因蛋白的影响Fig. 8 Effects of SAHA on the protein expression of cell proliferation related genes
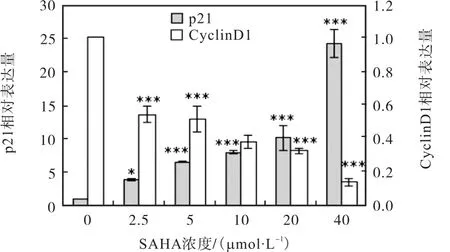
图9 SAHA对MCF-7细胞增殖相关基因RNA的影响Fig. 9 Effects of SAHA on the RNA expression of cell proliferation related genes
CyclinD1是细胞周期蛋白,CDK4是细胞周期蛋白依赖性蛋白激酶,而p21蛋白可以抑制CDK复合物活性.图 8和图 9结果表明:与对照组相比,加药组的CyclinD1、CDK4在蛋白以及RNA的水平上表达量均下调,但 p21的表达量上调,并且蛋白的表达量变化随药物浓度的降低具有浓度梯度依赖性.由以上的结果说明:SAHA抑制了肿瘤 MCF-7细胞过度增殖相关基因的表达,促进了抑癌基因表达.
3 讨 论
一般情况下,细胞中组蛋白的乙酰化与去乙酰化可维持动态平衡并受到严格调控,但当这种平衡被外界因素打破时,就常常会导致基因表达紊乱,进而引起疾病的发生,特别是容易引起肿瘤的发生[12].在多种肿瘤发现 HDAC过量表达,SAHA能够通过抑制HDAC的活性而使组蛋白过乙酰化,进而通过细胞周期阻滞、诱导细胞凋亡等作用机制而产生较强的抗肿瘤效应,因此在某些肿瘤治疗方面展现了良好的应用前景[13],但 SAHA对乳腺癌细胞迁移和增殖的影响及机制未见报道.
蛋白质乙酰化修饰相关的表观遗传学改变是造成肿瘤发生的一个很重要的因素,而高迁移,异常增殖是肿瘤细胞的标志,本研究使用小分子化合物SAHA处理细胞,分别从乳腺癌细胞 MCF-7的迁移和增殖角度,阐述其抗乳腺癌作用机制,最终发现SAHA在分子水平上抑制促增殖和迁移相关基因、增强抑增殖基因表达;在细胞水平上,可以抑制 MCF-7的迁移与增殖,具有显著的抗乳腺癌作用.本研究对乳腺癌新药研发具有一定的意义.
