有氧运动联合黑果枸杞色素补充对非酒精性脂肪肝病小鼠肝脏脂肪酸氧化功能的干预效果
2019-04-22陈伊琳谢军陈嘉勤朱彦陈锐屈红林
陈伊琳 谢军 陈嘉勤 朱彦 陈锐 屈红林
1湖南师范大学体育学院体适能与运动康复湖南省重点实验室(湖南长沙410012)
2宜春学院体育学院(江西宜春336000)
脂质合成增多的同时脂肪酸氧化减少,造成肝脏中大量脂质蓄积,是影响非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)发生、发展的重要因素,其生化基础可能是脂肪酸氧化途径受到破坏,抑制脂肪酸的氧化及极低密度脂蛋白装配所需的脂蛋白的合成[1-2]。脂肪酸氧化主要发生在三个细胞器:线粒体和过氧化酶体的β氧化及微粒体ω氧化,线粒体β氧化负责代谢短、中、长链脂肪酸,过氧化物酶体β氧化负责代谢极长链脂肪酸。此外,极长链脂肪酸还可以通过细 胞 色 素 P4504A(cytochromeP450, family4,CYP4A)亚家族进行氧化分解为双羧酸。
黑果枸杞色素是黑果枸杞中分离提取的天然原花青素,具有清除自由基、抗氧化功能[3];可降低血脂并抑制脂质过氧化水平,提高小鼠抗疲劳能力,延长运动时间[4-5];有氧运动能够改善NAFLD大鼠线粒体形态结构及功能,降低肝脏脂质蓄积并抑制氧化应激水平[6-7],但是有氧运动联合黑果枸杞色素补充改善NAFLD肝脏脂肪酸氧化功能的研究较少,具体机制尚不明确。本研究通过有氧运动及黑果枸杞色素对NAFLD小鼠进行干预,观察肝脏线粒体脂肪酸氧化速率、氧化应激水平以及脂肪酸氧化相关因子的表达,探讨有氧运动联合黑果枸杞色素补充干预NAFLD的效果及可能机制,为促进NALFD良性转归及黑果枸杞资源的进一步开发利用提供理论依据。
1 研究对象与方法
1.1 实验对象及分组
3周龄昆明(KM)种雄性小鼠48只,动物批号:43004700016394,由湖南省斯莱克景达实验动物有限公司提供;生产许可证:SCXK(湘)2011-0003,体重19~21 g,室温23~25℃饲养,自然光照,动物实验室、饲养用具定期消毒灭菌。适应性饲养4天,分为空白组(SCD组,8只)及高糖高脂组(HFD组,40只,持续7周高糖高脂膳食建立非酒精性脂肪肝模型)。小鼠普通饲料购自湖南省斯莱克景达实验动物有限公司,产品许可证号:SCXK(湘)2014-0002,执行标准B级。在参考Zou等[8]非酒精性脂肪肝动物高脂乳剂灌胃模型基础上稍有修改:80%普通饲料、10%花生油、10%蔗糖。建模周期结束后,检测SCD组与8只HFD小鼠肝功能相关指标及肝脏组织学改变,检验建模效果,余32只HFD小鼠随机均分为模型组(MX组)、有氧运动组(E组)、黑果枸杞色素组(C组)、黑果枸杞色素联合有氧运动组(EC组),每组8只。
1.2 实验方案
E组与EC组采用水平动物跑台有氧运动,第1~3天为适应性跑台训练30 min,速度8 m/min,第4~6天逐渐递增至60 min,速度12 m/min,维持此运动量至第7周,每周6次。黑果枸杞由青海诺木洪农场提供,采用改进的超声波与微波萃取等高效工艺提取、分离并纯化黑果枸杞色素,利用蒽酮法测得其浸膏中色素含量为38.51%(β胡萝卜素标准品,比色法),按人与小鼠体表面积折算等效剂量经口灌胃。C、EC组于建模成功后给予黑黑果枸杞色素灌胃(200 mg/kg体重,溶于生理盐水0.5 ml),同时MX、E组灌服同体积生理盐水,均每天1次,每周6天,共7周。干预结束后禁食过夜,次日取肝脏和血液备用。
1.3 动物一般行为学观察
建模成功后每天观察小鼠生活情况,所有动物每周称重记录以便调整剂量,观察并记录动物的饮食、活动、毛色、死亡等情况。
1.4 取材
7周干预实验结束后,各组小鼠禁食过夜并称重,10%水合氯醛麻醉后摘眼球取血,断颈处死,迅速取肝组织并称量湿重,分别取肝右叶相似部位,约1 cm×1 cm大小置于10%多聚甲醛溶液(0.1M,pH=7.4)固定12小时以上,石蜡包埋待测;另取部分用于线粒体提取、肝脏总RNA提取及组织匀浆。血液样本4℃、6000 r/min离心10 min,取上清-20℃保存备用。
1.5 肝组织病理切片
厚度5 μm石蜡切片,脱蜡、脱水,苏木素和伊红染色,脱水,透明、中性树胶封片,光学显微镜下观察肝组织形态学。
1.6 指标检测及方法
连续测定法检测血清谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST),COD-PAP法检测总胆固醇(serum total cholesterol,TC)、甘油三酯(triglyce-ride,TG),直接法检测高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)。
肝右叶100 mg,生理盐水清洗后吸干并制成10%匀浆,考马斯亮蓝法测定肝组织蛋白含量。ELISA检测肝脏TG含量,比色法检测肝脏谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-px)含量,羟胺法监测肝脏超氧化物歧化酶(superoxide dismutase,SOD)活性,通过测定硫代巴比妥酸反应性底物(thiobarbituric acid reactive substance,TBARS)含量监测肝脏脂质过氧化物浓度。另取肝右叶100 mg,生理盐水清洗后吸干,按线粒体提取试剂盒说明提取肝脏线粒体。以牛血清白蛋白为标准,Bradford法测定线粒体蛋白浓度,比色法监测线粒体β氧化速率。
1.7 免疫组化染色检测
石蜡切片常规脱蜡复水,柠檬酸修复抗原,SABC法检测过氧化物酶体增殖物激活α受体(peroxisome proliferator-activated receptors α,PPARα)、肿瘤坏死因子α(tumor necrosis factor-α,TNFα)的阳性表达,苏木素轻度复染后常规脱水、透明、封片。PPARα、TNFα阳性表达计算:每组选片12张,每张切片镜下(×400)随机取5个视野,利用Simple PCI生物显微分析图像系统计算5个视野的阳性表达区域的总面积。
1.8 总RNARNA提取
组织总mRNA提取采用Trizol法:采集肝脏标本20 mg至EP管,加入Trizol液1 ml剪碎、混匀静置5 min、加0.2 ml氯仿、4℃冰箱静置10 min、3000 r/min离心10 min、取上清液至EP管、加异丙醇混匀静置10 min、3000 r/min离心10 min、弃上清液、加75%冰乙醇洗涤、3000 r/min离心10 min、弃上清液、加DEPC水溶解。
1.9 反转录及real-time PCRe PCR
反转录:反应条件:42℃ 20 min,95℃ 5 min,5℃5 min;聚合酶反应:5×PCR Buffer 10 μl,Takara Ex Taq HS 0.25 μl;上游PCR与下游 PCR引物均为0.5 μl,灭菌蒸馏水 28.65 μl,加入反转录反应液 10 μl。反应条件:94℃ 2 min,94℃ 30 s,56℃ 30 s,72℃ 2 min,共 35个循环。检测PPARα、脂酰辅酶A氧化酶(acetyl-coenzyme A oxidase,AOX)、长链乙酰辅酶A脱氢酶(long-chain acyl-CoA dehydrogenase,LCAD)、肉碱棕榈酰转移酶Ⅰ(carnitine palmitoyltransferaseⅠ,CPT1)、TNFα、细胞色素 P450亚型 4A10(cytochrome P450,family 4,subfamily A,polypeptide 10,CYP4A10)、细胞色素 P450亚型 4A12(cytochrome P450, family 4, subfamily A, polypeptide 12,CYP4A12)表达。
RT-PCR:仪器:ABI 7900HT,试剂:SYBR®Premix Ex Taq™Ⅱ(Takara)试剂盒。根据Gene Bank核酸数据库中血管各因子cDNA序列,基因引物均由上海生工生物工程技术服务有限公司设计合成,试剂均购于上海生工公司(引物合成序列见表1)。采用2-ΔΔCt表示mRNA相对表达量,每个样本设立3个平行管,看家基因为GAPDH。
ΔΔCt=实验组(Ct目的基因-Ct内参基因)-校正组(Ct目的基因-Ct内参基因)

表1 RT-PCR引物序列
1.10 统计分析
计量资料用均数±标准差(x±s)表示,数值比较采用成组设计的One-Way ANOVA单因素方差分析,组间比较采用LSD检验。有氧运动、黑果枸杞色素做多因素方差分析,检测有氧运动与黑果枸杞色素之间交互效应,如果有交互效应选择简单效应分析。P<0.05为差异具有统计学显著意义,P<0.01为差异具有统计学非常显著意义。
2 实验结果
2.1 高糖高脂膳食构建NALFDNALFD模型结果
高糖高脂模型构建过程中,小鼠无死亡情况,与SCD小鼠相比,HFD小鼠出现行动迟缓、食欲增加、尿黄。建模结束时,与SCD小鼠相比,HFD小鼠体重、肝脏湿重及肝指数显著增加(P<0.01),血清TG、TC、LDLC含量增加(P<0.01),ALT、AST活性上升(P<0.01),HDL-C含量下降(P<0.01),肝细胞体积增大,排列紊乱,细胞质出现明显的脂质空泡,肝索结构紊乱、消失,肝细胞核出现变形并且位置发生偏移,出现炎性细胞浸润,汇管区未见坏死灶及点状坏死灶(表2,图1)。

表2 空白组与高糖高脂组体重、肝湿重、血生化指标变化
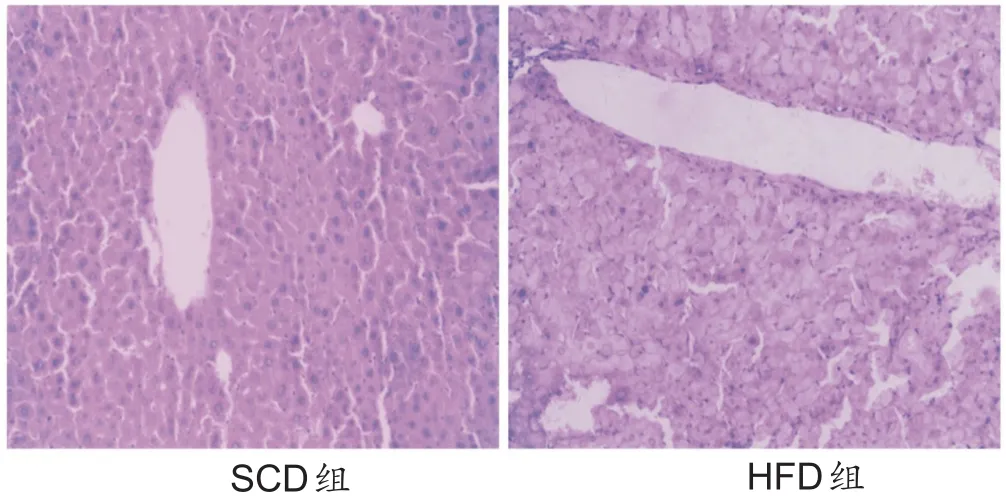
图1 空白组与高糖高脂组小鼠肝脏HE染色(×200)
2.2 干预后各组NAFLDNAFLD小鼠体重、肝湿重及肝指数的变化
如表3所示,与MX组相比,E、EC组体重、肝湿重下降(P<0.01),C组体重无显著性差异,肝湿重下降(P<0.01)。有氧运动与黑果枸杞色素对肝湿重存在协同效应(表4)。

表3 干预后各组NAFLD小鼠体重、肝湿重及肝指数变化(x±s,n=8)

表4 有氧运动及黑果枸杞色素对NAFLD小鼠体重、肝湿重交互效应分析
2.3 干预后各组NAFLDNAFLD小鼠肝脏组织形态学观察
如图2所示,光镜下MX组肝小叶结构破坏严重,细胞内出现大量脂滴空洞,肝细胞索模糊,乃至消失,肝细胞出现浊肿,细胞核变形并位于细胞边缘;E、C、EC组肝小叶结构受损减轻,仅少数肝细胞存有小泡样脂滴,肝细胞索较为清晰,脂质变性程度减轻。
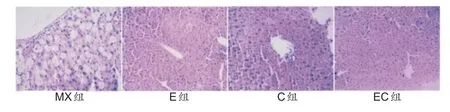
图2 干预后各组NAFLD小鼠肝组织HE染色(×200)
2.4 干预后各组NAFLDNAFLD小鼠血生化相关指标变化
如表5所示,与MX组相比,E组、C组和EC组血清ALT、AST、TG、TC、LDL-C 水平下降(P<0.01或P<0.05),HDL-C水平显著升高(P<0.01)。对于上述指标,除AST外,有氧运动与黑果枸杞色素间存在协同效应(表6)。

表5 干预后各组NAFLD小鼠血脂及血清转氨酶水平变化(x±s,n=8)

表6 有氧运动与黑果枸杞色素对NAFLD小鼠血脂及血清转氨酶交互效应分析
2.5 干预后各组NAFLDNAFLD小鼠肝脏TGTG、GSH-pxSH-px、TBARSTBARS含量、SODSOD活性及β 氧化速率的变化
如表7所示,与MX比较,E组、C组和EC组肝脏TG含量和脂质代谢产物TBARS含量显著下降(P<0.01),线粒体β氧化速率上升(P<0.05或P<0.01),肝脏过氧化物分解酶GSH-px含量、SOD活性显著上升(P<0.05或P<0.01);对于上述指标,有氧运动与黑果枸杞色素间存在协同效应(表8)。

表7 干预后各组NAFLD小鼠肝脏氧化损伤相关指标变化(x± s,n=8)
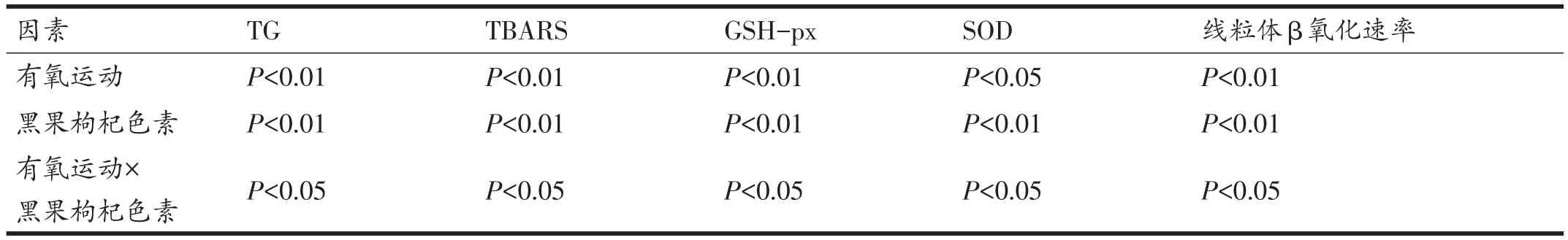
表8 有氧运动及黑果枸杞色素对NAFLD小鼠肝脏氧化损伤相关指标交互效应分析
2.6 干预后各组NAFLDNAFLD小鼠肝脏脂质氧化相关因子基因表达水平的变化
如图3和表9所示,与MX组比较,E、EC、C组的肝组织PPARα基因表达上调,TNFα基因表达下降(P<0.05),有氧运动与黑果枸杞色素对于PPARα mRNA表达存在协同效应。与MX组比较,E、EC、C组的下游基因AOX、CPT1、LCAD、CYP4A10、CYP4A12 mRNA表达均上调(P<0.05)。有氧运动与黑果枸杞色素对于CPT1、CYP4A10 mRNA表达存在协同效应。

图3 干预后各组NAFLD小鼠肝脏脂质氧化相关因子mRNA表达的变化

表9 有氧运动及黑果枸杞色素对NAFLD小鼠肝脏脂质氧化相关因子mRNA表达交互效应分析
2.7 干预后各组NAFLDNAFLD小鼠免疫组织化学染色观察与变化
小鼠肝脏TNFα、PPARα免疫组织化学阳性染色呈棕色(图4、图5黑色箭头所示)。与MX组相比,E、EC、C组小鼠肝脏中TNFα蛋白表达降低,PPARα表达升高(P<0.01,表10)。对于TNFα蛋白表达,有氧运动与黑果枸杞色素间具有协同效应(表11)。

图4 干预后各组NAFLD小鼠TNFα蛋白阳性表达(×400)

图5 干预后各组NAFLD小鼠PPARα蛋白阳性表达(×400)

表10 干预后各组NAFLD小鼠肝脏PPARα、TNFα免疫组织化学染色显微图像分析

表11 有氧运动及黑果枸杞色素对NAFLD小鼠PPARα、TNFα蛋白阳性表达水平交互效应分析
3 讨论
脂质氧化代谢异常在肝脂肪变发生、发展过程中占有重要位置,脂肪酸代谢能力下降,多余的游离脂肪酸酯化成甘油三酯并在肝脏中蓄积,导致肝细胞内脂滴增多,产生肝细胞脂肪变。PPARα属于核受体家族,是配体激活的转录因子,主要表达于肝脏、肾皮质、心脏等具有丰富线粒体和脂肪酸β氧化活性的器官,可转录调节编码过氧化物酶体、微粒体和某些线粒体脂肪酸代谢酶的基因如AOX、LCAD、CPT1等,从而在脂肪酸的氧化代谢过程中发挥重要的调控作用,同时,PPARα可上调CYP4A基因表达,催化饱和、不饱和脂肪酸的羟化,加速脂肪酸氧化,减少肝脏脂质变性,PPARα表达减少可能引起一系列与脂质代谢有关的酶表达减少,进而导致游离和酯化脂肪酸沉积[9-10]。研究发现,游泳运动能够上调心梗大鼠PPARα表达水平,并且可能与炎症标记物TNFα、核转录因子Kappa B(nuclear factor kappa-light-chain-enhancer of activated B cells,NF-κB)表达下调有关[11]。TNFα是NAFLD易感因子,可下调PPARα基因表达,降低脂肪酸的氧化,促进脂肪酸的蓄积。目前,对于运动与PPARα表达的研究结果不一。部分学者发现,中等强度持续运动和大强度间歇运动可能通过改变体内SREBP-1c、PPARα、CPT1等基因的表达改善脂质合成和β氧化,预防肥胖小鼠肝脏脂质堆积[12]。长期中等强度的运动训练可以上调PPARα基因和蛋白表达水平[13]。但是也有不同观点,如陈敏等[14]研究发现耐力有氧运动可以提高大鼠肝脏、心肌和腓肠肌中PPARα的蛋白表达水平,但PPARα基因表达无明显改变;李庆雯等[15]发现,有氧耐力运动后,正常大鼠骨骼肌PPARα基因表达显著提高,而高脂饮食大鼠在进行耐力运动后PPARα基因表达未出现显著性变化。本实验结果表明,7周中等强度有氧运动及黑果枸杞色素干预能够提高NAFLD小鼠肝脏中上游调控基因PPARα基因表达和蛋白表达,并且这种提高可能与TNFα基因表达和蛋白表达下降有关(表10,图3-4)。对于PPARα基因表达和TNFα蛋白表达,有氧运动与黑枸枸杞色素间存在协同效应(表9、11),有氧运动联合黑果枸杞色素作用效果最佳。
脂肪酸氧化主要发生在线粒体,线粒体脂肪酸氧化能力下降是引起脂肪代谢紊乱、导致脂肪肝的主要机制。通常线粒体β氧化包括3个连续步骤,即长链脂肪酰进入线粒体;随后是脂肪酸的持续β氧化,产生了短链乙酰辅酶A和辅酶A,并且使氧化型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)和黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)转换为烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotid,NADH)和还原型黄素腺嘌呤二核苷酸(reduced flavin adenine dinucleotide,FADH2);最终通过线粒体呼吸链(mitochondrial respiratory chain,MRC)将NADH和FADH2重新氧化为NAD和FAD。CPT1是介导长链脂肪酰进入线粒体进行β氧化的关键酶,可特异性催化长链脂肪酸与肉碱转变成长链酯化酰基肉碱,长链酯化酰基肉碱在载体蛋白作用下进入线粒体内膜基质中,在LCAD的催化作用下进行β氧化[16-17]。LCAD是脂肪酸β氧化过程的起始催化酶,对C6到C20-CoA都具有催化活性,另外LCAD能够催化支链脂肪酸的氧化并能对二十二碳六烯酸-CoA、花生四烯酸等不饱和脂肪酸进行有效脱氢[18-19]。Song等[20]研究发现,高脂膳食可导致SD大鼠骨骼肌中CPT1基因表达下调,4周游泳训练能够提高CPT1基因表达水平,有助于脂质在组织中的清除。耐力运动及间歇运动能够通过提高CPT1基因表达降低骨骼肌中脂质堆积,预防高脂诱导的肥胖[21]。Brenmoehl等发现,运动可以提高DUhTP小鼠皮下脂肪组织中LCAD的表达[22]。本实验结果显示,7周有氧运动及黑果枸杞色素干预后,与MX组相比,E、EC组小鼠体重、肝脏湿重下降,C组体重无显著变化,肝湿重下降,C、EC组肝指数降低,E、C、EC小鼠肝脏TG含量下降,血清TG、TC、LDL-c含量下降,HDL-c含量上升,肝组织脂肪酸氧化上游调控基因PPARα基因表达上调,下游靶基因CPT1、LCAD mRNA表达水平上调,线粒体β氧化速率加快,有氧运动与黑果枸杞色素对线粒体β氧化速率有协同效应(表3-4,图3,表7-8)。提示,7周有氧运动与黑果枸杞色素通过促进线粒体β氧化的第一步和第二步反应,提高NAFLD小鼠线粒体氧化速率,减少脂质在肝脏的堆积,有氧运动与黑果色素联合应用效果最佳。
过氧化酶体β氧化与微粒体ω氧化是脂肪酸氧化的次要代谢途径,激活这两条通路有助于增加脂肪酸代谢,但是代谢过程中同时也会产生大量ROS[23]。AOX是长链脂酰CoA氧化的关键酶,也是过氧化酶体β氧化的限速酶;CYP4A10、CYP4A12是微粒体脂肪酸ω氧化的关键酶,运动对AOX、CYP4A10、CYP4A12的调节相关文献报导少见:游泳训练可显著提高高脂饮食小鼠PPARα、AOX基因表达,预防NAFLD[24];而Knudsen等[25]则发现,敲除骨骼肌中IL-6基因,高脂饮食小鼠肝脏CYP4A10基因表达上调,跑台运动能够降低高脂饮食小鼠肝脏中CYP4A10基因表达。本实验结果显示,通过7周有氧运动与黑果枸杞色素的干预后,与MX组相比,各干预组NAFLD小鼠肝脏中上游调控基因PPARα基因表达上调,下游靶基因AOX、CYP4A10、CYP4A12 mRNA表达上调,GSH-px含量、SOD活性上升,脂质过氧化物产物TBARS含量下降,血清肝损伤指标AST、ALT活性下降。这提示,7周有氧运动及黑果枸杞色素在提高过氧化酶体β氧化及微粒体ω氧化的同时提高机体抗氧化酶含量及活性,促进肝细胞中脂质代谢产物的清除,降低过氧化酶体β氧化及微粒体ω氧化通路产生的氧化损伤,有利于NAFLD转归。
4 结论
7周有氧运动及黑果枸杞色素补充可明显改善NAFLD小鼠肝脏脂质代谢紊乱,可能通过促进肝脏脂肪酸氧化减少肝细胞中脂质蓄积,降低肝脏脂质变性程度及肝脏氧化损伤,促进非酒精性脂肪肝的良性转归,有氧运动与黑果色素联合应用效果最佳。
