四川地区养殖锦鲤浮肿病毒检测与系统进化分析
2019-04-18康慧敏何嘉乐刘晨恺周瑶佳欧阳萍
康慧敏,何嘉乐,刘晨恺,周瑶佳,耿 毅,欧阳萍
(四川农业大学 动物医学院,四川 成都 611130)
鲤浮肿病(carp edema virus disease,CEVD)是由鲤浮肿病毒(carp edema virus,CEV)引起的鲤科鱼类死亡的一种病毒性传染病,病鱼的典型症状为糜烂性或出血性皮肤损伤,腮坏死,皮下组织肿胀,凹眼等[1],病鱼具有明显的反应迟钝、嗜睡等特征,所以又称为鲤鱼睡眠病(koi sleep disease,KSD)[2]。CEV具有很高的特异性,目前的研究发现该病毒仅感染锦鲤和鲤鱼,导致鱼类死亡,幼年鲤鱼死亡率高达60%~100%[3]。鲤浮肿病给全球淡水养殖业带来了巨大的经济损失[4-10]。2015年中国报道鲤浮肿病毒病[11-13],由于其临床症状与锦鲤疱疹病毒病(koi herpes virus disease,KHVD)相似,在生产中很容易被误诊。鲤水肿病是继锦鲤疱疹病毒病之后,又一个对淡水渔业造成巨大威胁的病毒性传染病。
2017年10月,四川某养鱼场锦鲤暴发一种以嗜睡、腹部肿大、鳃肿胀和眼睛凹陷为临床特征的传染病,发病水温为18~23 ℃,累计死亡率为50%。为研究此次疾病的病因和流行发病规律,将病鱼解剖,通过细菌学和寄生虫检查、病理组织观察、PCR鉴定、电镜观察和系统进化分析,为鲤浮肿病毒的起源进化、分类、疾病诊断和防控提供重要依据。
1 材料与方法
1.1 病料来源
病鱼采自四川省某锦鲤养殖场,濒临死亡锦鲤4条,死亡不久的锦鲤2条,编号为1~6。
1.2 主要试剂
大肠埃希菌DH5α由四川农业大学动物医学院鱼病研究中心实验室保存提供。克隆载体PMD19-T购自美国Invitrogen公司;病毒DNA提取试剂盒、小剂量质粒抽提试剂盒、pMD19-T质粒连接试剂盒、组织DNA提取试剂盒、胶回收试剂盒和2×PCR Master Mix购自美国TaKaRa公司。
1.3 临床症状与组织病理学观察
观察鱼池内患病锦鲤的行为特征,对病鱼样品的鳃、体表、眼、鳍条、肛门等部位进行表观症状观察。解剖病鱼,观察内脏器官的变化,采集鳃和肾脏样品,-20 ℃保存备用。
采集病鱼的鳃、肝脏、脑、脾脏、肾脏等组织样本,10%中性福尔马林固定,常规石蜡切片,苏木精-伊红(HE)染色,中性树胶封片后置于光学显微镜下观察。
1.4 细菌分离与寄生虫检测
无菌条件下,从病鱼肝脏、脾脏和肾脏取样于BHIA平板上划线接种,28 ℃恒温培养24~48 h,观察细菌生长状况。采集病鱼的鳃丝、血液和体表黏液分别进行鳃丝压片、血液和体表黏液涂片观察,在光学显微镜低倍镜下进行寄生虫检测。
1.5 PCR检测
采集病鱼的鳃和肾脏,按照组织DNA提取试剂盒操作说明提取基因组DNA。提取的DNA分别用于检测锦鲤疱疹病毒(koi herpes virus,KHV)、鲤浮肿病毒(carp edema virus,CEV)、鲤春病毒血症病毒(spring viremia of carp virus, SVCV)。根据世界动物卫生组织(OIE)推荐检测KHV的Sph基因进行PCR扩增;参考文献[14]进行CEV引物设计及巢氏PCR反应;参考文献[15]进行SVCV检测,使用引物SVCV_F1和SVCV_R2扩增SVCV糖蛋白基因714 bp的DNA片段后,再用引物SVCV_F1和SVCV_R4经半嵌套式PCR扩增出606 bp的DNA片段。
1.6 电镜观察
取病鱼肾脏于2.5%戊二醛磷酸盐缓冲液保存,用磷酸缓冲液漂洗4 h以上,再用1%锇酸溶液固定,梯度乙醇脱水后,采用环氧树脂包埋剂进行浸透,并于65 ℃中聚合24~58 h。将聚合好的样本超薄切片,在透射电镜下观察[16]。
1.7 CEV P4a基因克隆测序及系统发育分析
PCR产物按照DNA纯化试剂盒操作说明书纯化后,连接到pMD19-T载体上,转化大肠埃希菌DH5α感受态细胞中。培养24 h后,挑取单个菌落进行PCR筛选阳性菌株,提取质粒送上海生物工程有限公司进行序列测定。根据GenBank收录的CEV英国株和波兰株的P4a基因序列,使用DNAstar生物学软件Megalign方法进行序列同源性分析,并通过MEGA6邻接法构建系统进化树进行遗传进化分析。
表1PCR扩增引物
Table1Primers for PCR amplification

引物名称Primer name序列Sequence(5′-3′)长度Length/bpKHV_F1GACACCACATCTGCAAGGAG292KHV_R1GACACATGTTACAATGGTCGCCEV_F1ATGGAGTATCCAAAGTACTTAG528CEV_R1CTCTTCACTATTGTGACTTTGCEV_F2GTTATCAATGAAATTTGTGTATTG478CEV_R2TAGCAAAGTACTACCTCATCCSVCV_F1 TCTTGGAGCCAAATAGCTCARRTC714SVCV_R1AGATGGTATGGACCCCAATACATHCANCAYSVCV_F1 TCTTGGAGCCAAATAGCTCARRTC606SVCV_R4 CTGGGGTTTCCNCCTCAAAGYTGY
2 结果与分析
2.1 临床症状及解剖观察
发病锦鲤主要的临床症状为食欲减退,嗜睡或在池塘边的水面上缓慢、漫无目的游动,遇到惊吓后迅速苏醒,游一段距离后很快陷入沉睡,鱼体出现身体肿胀,体表出现溃烂,眼球、腹部充血,单侧或双侧眼球浑浊,鳃丝肿胀、出血甚至坏死,肝脾肾等器官无明显异常(图1)。
2.2 组织病理学观察
通过组织病理学观察,患病锦鲤鳃小片间上皮细胞大量增生,呼吸上皮出现脱落和坏死,鳃小片的间隙消失发生粘连(图2-A);肝细胞变性肿胀,部分肝细胞坏死(图2-B);脑组织可见大量淋巴细胞浸润,神经元细胞变性坏死(图2-C),可见管套现象和噬神经元现象,脑膜发生增厚和充血,表现为增生性脑膜炎(图2-D);肾小管上皮细胞肿胀变性,坏死脱落至管腔中,肾间质中有大量巨噬细胞和单核细胞浸润(图2-E);脾脏病变不明显,有轻微出血现象(图2-F);心脏和肌肉组织未见明显病理改变。

A,患病锦鲤出现KSD典型症状,如嗜睡,侧身躺着不动;B、C,患病锦鲤身体肿胀(白色箭头为正常锦鲤,黑色箭头所指为患病锦鲤);D,体表出现溃疡;E,眼睛充血,眼球浑浊;F,鳃丝肿胀。A, The diseased koi had typical symptoms of KSD, such as lethargy, lying on its side; B and C, The body swelling of the diseased koi (the white arrow was normal koi and the black arrow refered to sick koi); D, Ulcers on the body surface; E, Hyperemia of eyes and turbidity of eyeball; F, Branchial swelling.图1 患病锦鲤临床病变Fig.1 Clinical pathological changes of diseased koi carp
2.3 细菌和寄生虫检测
BHIA培养基上培养48 h(28 ℃)上未见菌落生长。鳃丝压片、血液和体表黏液涂片观察均未发现寄生虫。推测患病鲤鱼不是被已知能在BHIA生长的常见致病菌(链球菌、气单胞菌、耶尔森菌、弧菌等)或寄生虫感染而引发死亡。

A,鳃小片发生粘连,细胞增生,呼吸上皮细胞出现脱落和坏死;B,肝脏细胞出现空泡变性和坏死;C,脑组织可见大量淋巴细胞浸润,毛细血管扩张充血;D,脑膜发生增厚和充血;E,肾脏炎性细胞浸润,细胞出现变性和坏死;F,脾脏有轻微出血。A, Adhesion of gill fragments, proliferation of cells, exfoliation and necrosis of respiratory epithelial cells; B, Necrosis and vacuolar degeneration of liver cells; C, A large number of lymphocytes infiltration in the brian tissue, capillary congestion expansion; D, Meningeal thickening and hyperemia; E, Renal inflammatory cell infiltration, cell degeneration and necrosis; F, Slight bleeding in the spleen.图2 患病锦鲤组织病理学观察Fig.2 Histopathological observation of koi infected by CEV
2.4 PCR检测
分别采集1~6组中锦鲤的鳃丝,通过组织DNA提取试剂盒提取组织DNA,进行PCR检测。根据临床症状和流行情况,首先使用OIE推荐的KHV和SVCV引物进行检测,1~6组样品均为阴性。通过巢氏PCR检测方法,进行了CEV检测,第一步PCR反应扩增出528 bp的特异性条带(图3-A),第二步PCR反应以第一步的PCR产物为模板,扩增出478 bp DNA片段(图3-B),检测结果为CEV阳性。基因测序结果显示该序列与CEV同源性高达99%,因此可诊断该锦鲤养殖区存在CEV感染。
2.5 电镜观察
透射电镜下观察肾脏超薄切片,在肾脏组织中可见大量痘病毒样病毒颗粒,直径为200~240 nm,有囊膜。病毒大小、形状和结构,符合痘病毒科的特征(图4)。
2.6 序列分析与进化树构建
对巢氏PCR扩增产物(P4a基因)进行测序并分析,将序列上传到GenBank得到的序列号为MG787230。根据P4a基因的部分核苷酸序列,对英国和波兰的19条具有代表性的CEV序列进行了多重比对和系统发育分析。结果表明,本次试验分离到的病毒株与英国株R083和CyPP-3的同源性最高,分别为99%和98%(图5)。通过进化树发现现有CEV毒株主要分为2个基因型。

M,DL1000 marker;1,阴性对照;2~7,第1~6号样品。M, DL 1000 DNA marker; 1, Negative control;2-7, Samples of 1 to 6.图3 CEV巢氏PCR检测结果Fig.3 Nested-PCR detection results of CEV
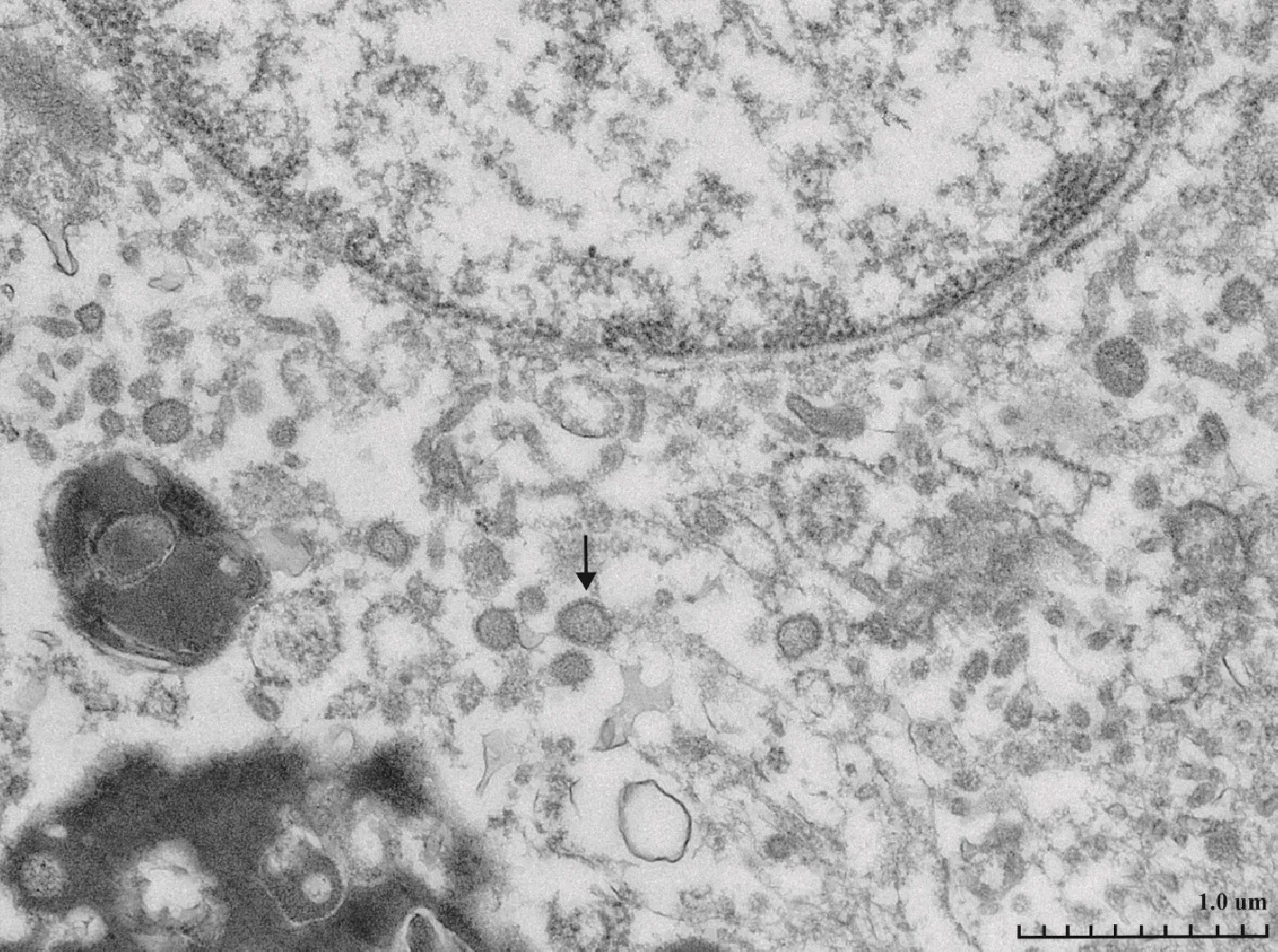
箭头所示为病毒粒子。The arrow showed viral particles.图4 电子显微镜下的肾组织中的病毒粒子Fig.4 Ultrathin sections of the kidney under the electronic microscope
3 讨论
鲤浮肿病是一种严重危害鲤养殖业的疾病,我国各地均有报道[12-13,16]。2017年10月,四川省某养鱼场锦鲤出现大量死亡,养殖场水温18~23 ℃。基于临床症状、组织病理观察、寄生虫和细菌学检测,排除了致病性细菌和寄生虫感染的可能性,由于KHVD和SVCV都具有相似的临床症状及发病水温[17-18],同时进行了KHV、SVC、CEV病毒PCR检测。KHV和SVC的PCR检测结果皆为阴性,巢氏PCR方法检测鲤浮肿病毒(CEV),出现特异性扩增产物,且在肾脏组织中可见大量痘病毒样病毒颗粒,直径200~240 nm,有囊膜,病毒大小、形状和结构符合痘病毒科的特征。基于CEVP4a基因进行系统进化树分析,结果表明本次试验分离到的病毒株与英国株R083同源性最高为99%,证实CEV为引发此次四川地区某养鱼场锦鲤发病的病原。

图5 基于CEV P4a基因序列构建的系统进化树Fig.5 Phylogenetic tree construction based on CEV P4a gene sequence
在患病锦鲤临床症状和组织病理观察中,可见呼吸上皮出现脱落和坏死,鳃和肾脏是主要的病变部位,与国内外的报道相符。温智清等[13]报道,患病锦鲤每250 ng鳃和肾脏组织中CEV病毒载量为250.02~1 332.92,远超其余组织。Ono等[4]报道,鳃是CEV的主要靶器官,皮肤、肝脏、肾脏偶尔也可检测到病毒,患病鲤鱼呼吸上皮严重损伤导致缺氧,患病鲤鱼出现嗜睡症状,表现为侧身浮于水中或在水面上漫游,最终死亡。
CEV特异性很高,主要感染鲤鱼和锦鲤,一般鱼类细胞难以分离到该病毒。在生产中,由于CEVD和KHVD临床症状容易混淆,因此,探究CEV的流行现状、流行株的基因型并进行CEV的诊断和防控具有重要意义。本研究可为CEV进化、分类、疾病诊断和防控提供重要依据。
