MRA与CTA在诊断腹部内脏动脉瘤中的应用
2019-04-17河南省三门峡市中心医院医学影像科河南三门峡472000
河南省三门峡市中心医院医学影像科 (河南 三门峡 472000)
林志军
内脏动脉瘤(viseral artery aneurysm,VAAs)指发生于腹腔脏器各级动脉的瘤样病变,发病率约为0.1~0.2%,在腹部动脉瘤中位居第3,其中约60%为脾动脉瘤(SAA),20%为肝动脉瘤(HAA),6%为肠系膜上动脉瘤(SMAA)、其余依次为胃及胃网膜动脉瘤、空回肠及结肠动脉瘤等[1-2]。VAAs起病隐匿,缺乏特异性症状及体征,临床诊断主要依据影像检查结果,随着影像学技术发展和设备改进,超声、磁共振血管成像(Magnetic resonance angiography,MRA)、CT血管成像(computed tomography angiography,CTA)等均成为临床常用检查方法且各自具有独特优势,为VAAs诊断和治疗水平提升形成重要保障,但现阶段VAAs诊断“金标准”仍是动脉血管造影[3-4]。本研究通过回顾性分析我院MRA与CTA在VAAs诊断中的应用情况和效果来比较两种检查手段优势和不足,为临床选择合理检查方法提供参考依据。
1 资料与方法
1.1 一般资料 选取2013年6月至2018年6月我院104例疑似VAAs患者临床资料进行回顾性分析,其中男性58例、女性46例,年龄29~76岁,平均(56.83±10.24)岁,其中伴手术或创伤史者37例,高血压48例、糖尿病41例。纳入标准:①年龄18~80岁;②临床资料及影像检查结果清晰完整;③患者及家属之效本研究并签署同意书;④同时行MRA及CTA检查。排除标准:①已发生破裂出血者;②无法耐受MRA或CTA检查者;③伴动脉瘤病史。
1.2 研究方法
1.2.1 CTA检查方法:采用64排MSCT(Somatom Definition,德国西门子)自膈顶至盆底扫描腹部及盆部器官组织;采用ulrich高压注射器以2.2ml/s注射碘海醇溶液1.5ml/kg后行增强扫描,其中动脉期、门脉期及平衡期扫描时间分别为造影剂注入后35s、60s和260s;CTA检查方法为以4ml/s注入碘铂醇注射液,剂量1.5ml/kg,启用Definition Flash扫描方案,采用Pre-monitor程序行动脉期扫描,延迟25s为门脉期,再延迟30s为延迟期,完成后将数据导入Siemens工作站,采用3D Virtuoso进行三维重建,层厚1mm,并应用容积再现(volume r e n d e r i n g,V R)、曲面重建(curved planar reformation,CPR)、多平面重建(multi planar reconstruction,MPR)及最大密度投影(maximum intensity projection,MIP)等技术进行后期处理,从多角度显示动脉瘤。
1.2.2 MRA检查方法:采用3.0T MR扫描仪(荷兰Philips)及8通道体部阵列线圈,行常规横轴位及矢状位T1WI和T2WI扫描,层厚5~6mm;MRA检查采用三维容积超快速多期动态增强扫描序列(liver acquisition with volume acceleration,LAVA),参数设置为TR 3.8ms、TE 1.8ms、矩阵256×256、层厚4mm、信号采集0.73次,造影剂为钆喷酸葡胺30ml,采用高压注射器自肘静脉穿刺注入,速度3ml/s,扫描时间由Smart Prep自动扫描技术确定。完成后将数据传到Advantage Window 4.3工作站进行MRP、CRP、MIP和VR等后期处理,根据病灶最佳显示角度重建图像,显示病灶位置、大小及形态。
1.3 统计学方法 数据分析采用SPSS19.0软件,计数资料以率(%)表示,组间对比进行χ2检验,计量资料使用(±s)表示,采用t值检验,诊断价值分析采用Kappa一致性检验,以P<0.05为有显著性差异。
2 结 果
2.1 两组VAAs确诊结果比较以CTA检查结果为“金标准”,确诊VAAs患者79例(75.96%),共检出VAAs病灶95枚,其中SAA患者38例(图1-2),HAA患者12例,RAA、SMAA及胃周动脉瘤患者各7例,胃网膜动脉瘤患者3例,多发性动脉瘤患者5例,1例累及脾和胃十二指肠动脉,1例累及脾和空回肠动脉,另有3例均累及2支以上动脉。
2.2 MRA对VAAs诊断价值分析 79例患者中MRA确诊73例(87枚),灵敏度为92.41%,特异度为92.00%,准确率为92.31%,与CTA相比Kappa值为0.800,具有良好一致性。
2.3 MRA与CTA对VAAs诊断结果比较 MRA与CTA对不同类型VAAs诊断结果差异无统计学意义(P>0.05)。
2.4 MRA与CTA对不同体积VAAs检查结果比较 MRA对≤10mm及10~15mm动脉瘤检出数量低于CTA,差异无统计学意义(P>0.05),MRA测量VAAs病灶平均直径大于CTA,差异有统计学意义(P<0.05)。
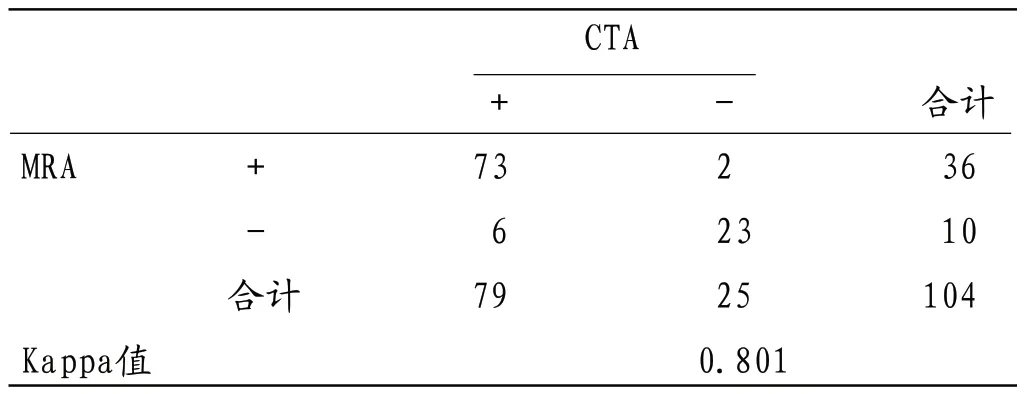
表1 MRA对VAAs诊断价值分析
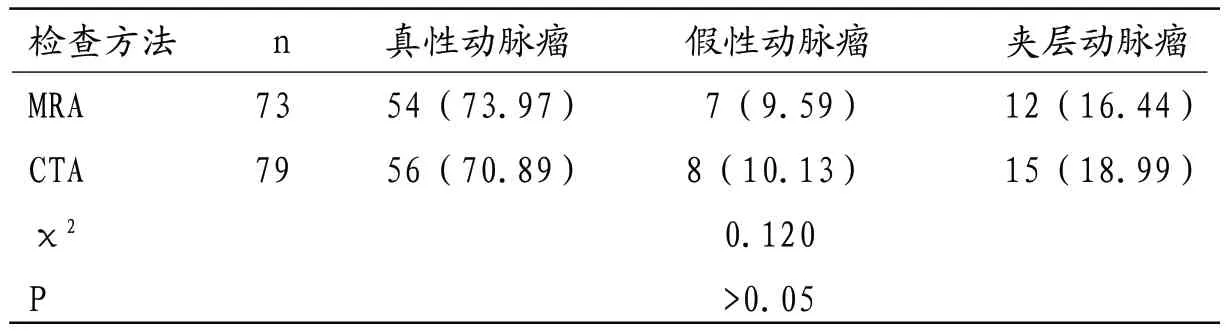
表2 MRA及CTA对VAAs诊断结果比较
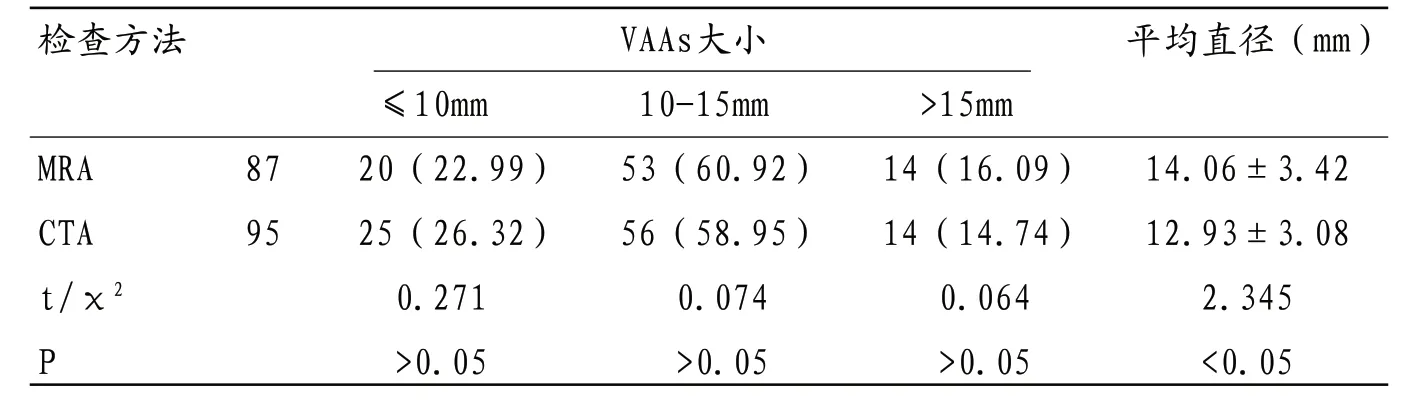
表3 MRA与CTA对不同体积VAAs检查结果比较
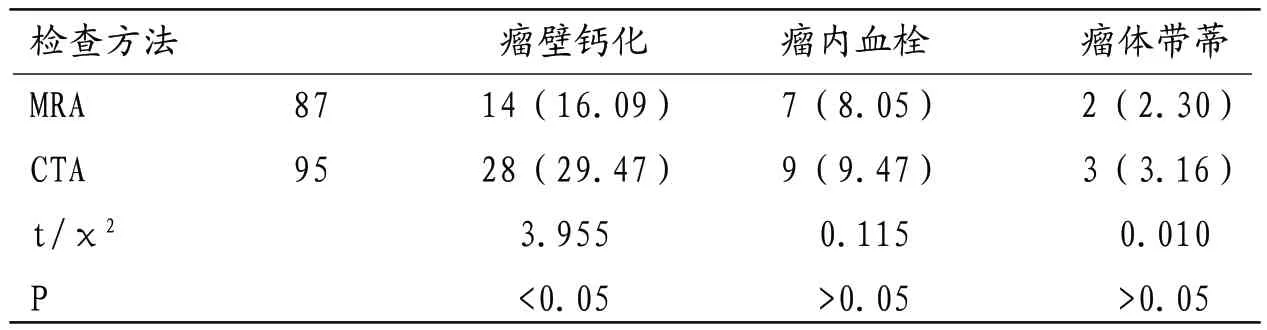
表4 MRA及CTA对不同大小VAA检出率比较
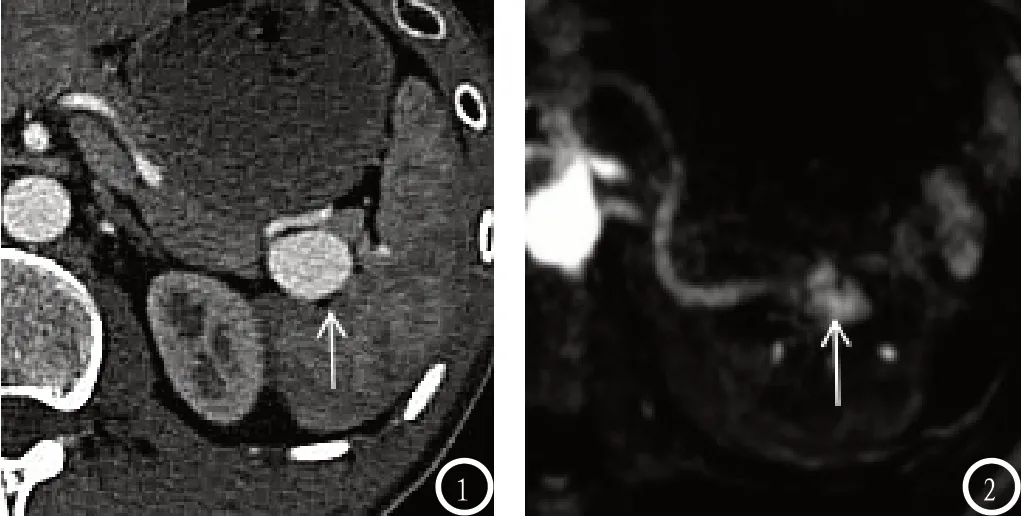
图1-2 脾动脉瘤,患者女性,40岁:图1 CTA示24×18mm大小脾动脉干动脉瘤(箭头);图2所示为MRA检查动脉期不均匀强化病灶(箭头)。
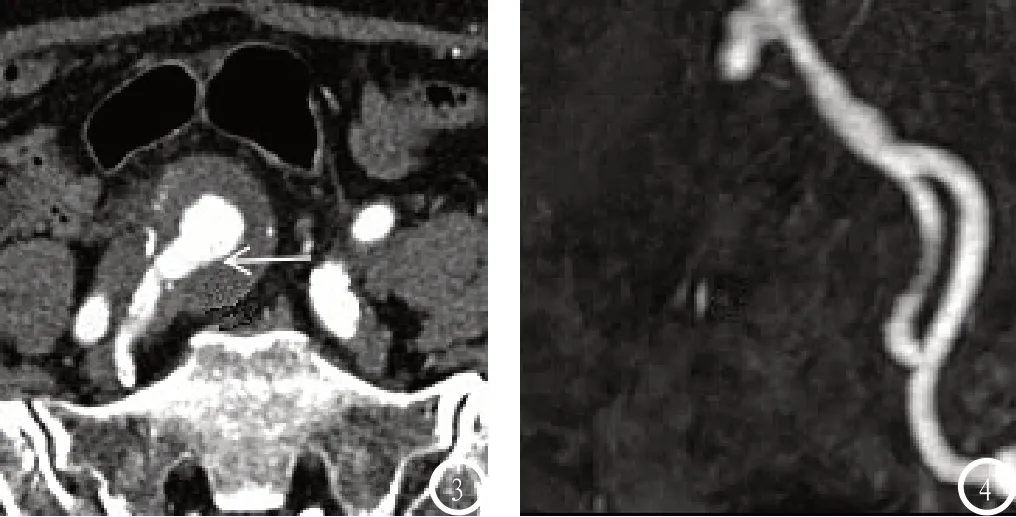
图3-4 右侧髂内动脉瘤,患者女性,80岁:图3 CTA示位于右髂内动脉主干的35×35mm大小动脉瘤伴附壁血栓;图4 MRA检查未见明显异常。
2.5 MRA与CTA检查VAAs显示结果比较 MRA检出瘤壁钙化数量小于CTA,差异有统计学意义(P<0.05),两种方法VAAs瘤内血栓(图3-4)、瘤体带蒂检出率均无明显差异(P>0.05)。
3 讨 论
VAAs发病机制目前尚不明确,推测与感染、创伤及动脉粥样硬化等因素关系密切,近年来随着高血压等心血管疾病增多和检查水平提升,VAAs发病率呈逐年上升趋势,VAAs瘤体具有较高风险出现破裂,导致患者快速大量失血,症状急剧加重,对患者生命安全造成严重威胁,死亡率高达25%~80%[5-6]。随着临床对VAAs重视程度增加,MRA及CTA等安全无创且方便快捷的血管成像技术逐渐受到关注并广泛用于VAAs诊断和筛查中,但如何选择更为有效的检查方法,进一步提升VAAs早期诊断准确率仍为学术界研究热点。
本研究回顾性分析104例疑似VAAs患者检查结果显示,采用CTA检查确诊VAAs者79例,检出病灶数量95枚,MRA确诊VAAs患者73例,检出病灶数量87枚;其中SAA发病率最高,其余分别为HAA、RAA、SMAA胃周动脉瘤、胃网膜动脉瘤及多发性动脉瘤等,以CTA为“金标准”,分析MRA诊断价值显示,MRA诊断VAAs灵敏度为92.41%,特异度为92.00%,准确率为92.31%,一致性Kappa值为0.800,可见MRA对VAAs诊断效能与CTA相近,具有良好诊断价值,与国内外报道一致[2],且两种检查方法对真性动脉瘤、假性动脉瘤及夹层动脉瘤诊断准确率无明显差异,表明MRA也可作为常规检查手段用于VAAs筛查,可作为无条件进行或患者不耐受CTA时的有效补充方法,对CTA或其他检查方法存在疑问时也可利用MRA发现更多细节信息,为临床确诊提供参考信息。研究表明,MRA及CTA诊断VAAs均依赖于后期图像重建和处理,常用技术中MIP主要优势为可清楚显示细小血管分支,但对瘤体及所在动脉解剖关系分辨率较差,且容易造成微小病灶漏检;MPR对VAAs形态和结构显示较为清晰,能准确显示瘤壁有无钙化、瘤内有无血栓形成以及是否与周围组织发生粘连等特点;CPR可在同一层面展开弯曲、缩短或重叠的血管,对分辨动脉瘤自身结构及其与周围组织解剖关系具有重要价值;VR可直观、立体的显示病灶大小、形态、钙化情况及与周围结构空间关系等信息,采用去骨技术还可有效减少高密度骨骼影造成的重叠和遮挡效应,为多角度观察病灶创造条件,但其对瘤内血栓显示效果较差[7-10]。本研究MRA及CTA检查均采用了MPR、MIP、CPR及VR等技术手段,结果显示MRA诊断准确率低于CTA,比较两种检查方法对不同大小动脉瘤检出数量时发现MRA对体积较小的病灶有漏诊现象,且MRA测量动脉瘤直径明显高于CTA测量结果,其原因可能与MRA分辨率偏低有关且易受血管网及胃肠内容物有关。
CAAs诊断明确后需积极治疗以防止瘤体破裂造成严重后果,目前常用治疗方法有腹腔镜手术及血管内介入等,治疗方法选择主要依据病灶大小、位置及钙化或血栓形成等高危因素,有报道显示动脉瘤病灶常伴有不同程度钙化,可对治疗方案选择和患者预后产生明显影响[11]。本研究中MRA检查对瘤壁钙化检出率明显低于CTA,这与其工作原理引起的自身局限性关系密切,提示MRA检查评估患者危险因素及指导治疗方案选择等方面应用价值不如CTA。目前普遍认为CTA诊断VAAs灵敏度已可与DSA媲美,在显示自身结构及与周围血管毗邻关系方面甚至更具优势,但对细小血管显示效果仍稍有欠缺,可能造成微小动脉瘤诊断难度较大[12],因此本研究不足之处为没有DSA作“金标准”,可能因CTA假阳性或假阴性导致研究结果产生一定偏差。
综上所述,MRA对微小病灶和瘤壁钙化显示效果较为欠缺,但诊断准确率与CTA检查一致性良好,因此两种检查均可作为内脏动脉瘤有效检查方法。
