乳腺癌原发灶18FFDG PET-CT代谢参数与患者临床病理特征的关系研究
2019-04-17河南省安阳市人民医院普外科河南安阳455000
河南省安阳市人民医院普外科(河南 安阳 455000)
牛增志
乳腺癌是常见女性恶性肿瘤之一,发病率约为41.64/10万,居女性恶性肿瘤之首,严重危害妇女生命健康[1]。肿瘤原发灶和区域淋巴结的良好控制是提高生存率、改善患者生活质量之关键,而准确临床诊断与分期有助于治疗方案制定。近年来,18F脱氧葡萄糖(fluorodeoxyglucose,FDG)正电子发射计算机断层扫描(positron emission tomograpgy/computed tomography, PET-CT)在临床应用逐渐广泛,其不仅可提供解剖结构信息,还能够获取肿瘤能量代谢信息,已成为肿瘤诊断的重要手段[2]。有研究显示,18F-FDG PET-CT代谢参数与能够反映肿瘤恶性程度。但目前国内关于乳腺癌原发灶18F-FDG PET-CT代谢参数与疾病分期、淋巴结转移情况、肿瘤分化程度等关系的报道尚少[3]。为此,本研究回归性分析45例乳腺癌初诊患者临床资料,旨在探讨18F-FDG PET-CT代谢参数与患者临床病理特征的相关性,现报告如下。
1 资料与方法
1.1 一般资料 收集2013年3月~2018年3月在我院行18F-FDG PET-CT检查并经手术病理证实的45例乳腺癌患者临床资料,均为女性,年龄25~81岁,中位年龄54岁,且均属于浸润性导管癌。所有患者在接受18F-FDG PET-CT扫描前均无任何抗肿瘤治疗史,并于18F-FDG PET-CT扫描后2周内接受手术治疗。乳腺癌分期参照国际抗癌联盟(international union against cancer,UICC)-美国癌症联合委员会(American joint committeeoncancer,AJCC)联合制定的第7版TNM分期标准。
1.2 PET-CT检查 采用德国西门子公司 Biography 64 TruePoint PET-CT扫描仪及安迪科医药集团生产的显像剂18FFDG(放化纯度>95%)。检查前患者需空腹6h以上,控制血糖<7.0mmol/L,经肘静脉注入3.7~4.81MBp/kg的18F-FDG,平卧约60min,排净尿液后采集图像。扫描参数:管电压为120kV,自动管电流,层厚为5.0mm,螺距为0.8,准直为1.5mm,矩阵128×128。PET扫描为2~3min/床位,三维采集,经CT衰减校正、有序子集最大期望值法(ordered-subset expectation maximization,OSEM)迭代法重建,分别获取冠状位、矢状位、横断位CT、PET及PET-CT融合图像。
1.3 图像分析 由2位高年资核医学医师盲法阅片,意见有分歧时,经讨论取得一致。应用肿瘤代谢评估系统处理所获取的CT、PET数据。勾画乳腺病灶感兴趣区(region of interest,R O I),由软件自动计算出R O I的最大标准摄取值(m a x i m u m standardized uptake value,SUVmax)、平均标准摄取值(mean standardized uptake value,SUVmean)、代谢体积(metabolic tumor volume,MTV),并计算病灶糖酵解总量(total lesion glycolysis,TLG),计算公式为TLG=SUVmean×MTV。根据淋巴结18F-FDG代谢水平判断淋巴结转移情况,对于有淋巴结转移者,测定18F-FDG摄取最高的转移淋巴结的SUVmax。
1.4 病理组织学检查 雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor, PR)、p53均以细胞核可见棕黄色颗粒为阳性,其中ER、PR均将>1%细胞数判定为阳性表达,p53均将>10%阳性细胞数判定为阳性表达[4-5]。人表皮生长因子受体2(human epidermal g r o w t h f a c t o r r e c e p t o r 2,HER-2)阳性判断:若免疫组化(+++),则直接判定为阳性;若免疫组化(+)或(-),则直接判定为阴性;而对于(++)者,应再进行基因扩增(荧光原位杂交),有扩增则判定为阳性,无扩增则判定为阴性[6]。
2 结 果
2.1 乳腺癌18F-FDG PETCT代谢参数45例乳腺癌均有较高18F-F D G 摄取,原发灶SUVm ax 为(4.88±1.52),SUVmean为(2.59±0.81),MTV为(8.1 9±2.5 1)c m3,T L G 为(21.96±6.42)g。其中28例有淋巴结转移,转移淋巴结SUVmax为(3.79±1.14)。
2.2 乳腺癌原发灶18F-FDG PET-CT代谢参数与临床病理特点的关系 乳腺癌原发灶SUVmax、MTV、TLG与均肿瘤最大径、组织学分级、T分期、淋巴结转移有明显相关性,表现在肿瘤最大径≥3cm、低分化、T3~T4、有淋巴结转移分别较肿瘤最大径<3cm、中与高分化、T1~T2、无淋巴结转移的原发灶SUVmax、MTV、TLG均明显增高(P<0.05);且ER阴性者较ER阳性者TLG明显增高(P<0.05),PR阴性者较PR阳性者MTV、TLG明显增高(P<0.05)。而乳腺癌原发灶SUVmax、MTV、TLG与年龄、HER-2表达、p53表达无相关性(P>0.05)。见表1。
2.3 乳腺癌转移淋巴结的SUVmax与原发灶18F-FDG PET-CT代谢参数及T分期的相关性 以28例有淋巴结转移的乳腺癌为研究对象,Spearman相关性分析显示,乳腺癌转移淋巴结的SUVmax与原发灶SUVmax、MTV、TLG均呈正相关(r=0.476、0.469、0.437,P<0.05),与T分期亦呈正相关(r=0.613,P<0.05)。典型图像见图1-4。
3 讨 论
既往研究显示,乳腺癌原发灶SUVmax与肿瘤恶性程度呈正相关[7]。近年来,18F-FDG PET-CT代谢参数在临床应用逐渐广泛,但乳腺癌原发灶代谢参数与患者临床病理特征的关系仍存在较大争议。Kaida等[8]对93例乳腺癌患者临床资料进行回顾性分析发现,肿瘤原发灶SUVmax、MTV、TLG随着组织学分级增高而增高;有淋巴结转移的患者SUVmax、MTV、TLG明显高于无淋巴结转移者;ER阴性组较ER阳性组SUVmax、TLG明显增高,而两组MTV无明显差异;同时PR、HER-2阳性与阴性组间SUVmax、MTV、TLG比较差异无统计学意义。而张倩等[9]回顾性分析48例乳腺癌患者18F-FDG PETCT及临床病理资料显示,ER、PR、HER-2阳性与阴性乳腺癌患者SUVmax、MTV、TLG比较均无显著差异。本研究显示,ER阳性者与ER阴性者TLG差异显著,PR阳性者与阴性者MTV、TLG差异显著,而各代谢参数在HER-2阳性者与阴性者间差异无统计学意义。本研究结果与以往报道有差异,分析原因:(1)以往报道是对各种病理类型乳腺癌患者进行分析,而本研究中纳入对象仅为乳腺浸润性导管癌患者。(2)各报道在判定ER、PR及HER-2阳性表达标准上存在差异。(3)乳腺癌原发灶体积过大时,在区分其与腋窝肿大淋巴结上存在较大难度,易引起SUV测量误差。抑癌基因p53作为反映肿瘤增值特性的重要指标,同ER、HR、HER-2一样,亦可用于判定乳腺癌患者预后[10]。有研究表明,p53阳性表达的乳腺癌侵袭性更强,恶性程度更高[11]。但本研究未显示p53表达与18F-FDG PET-CT代谢参数的存在相关性。
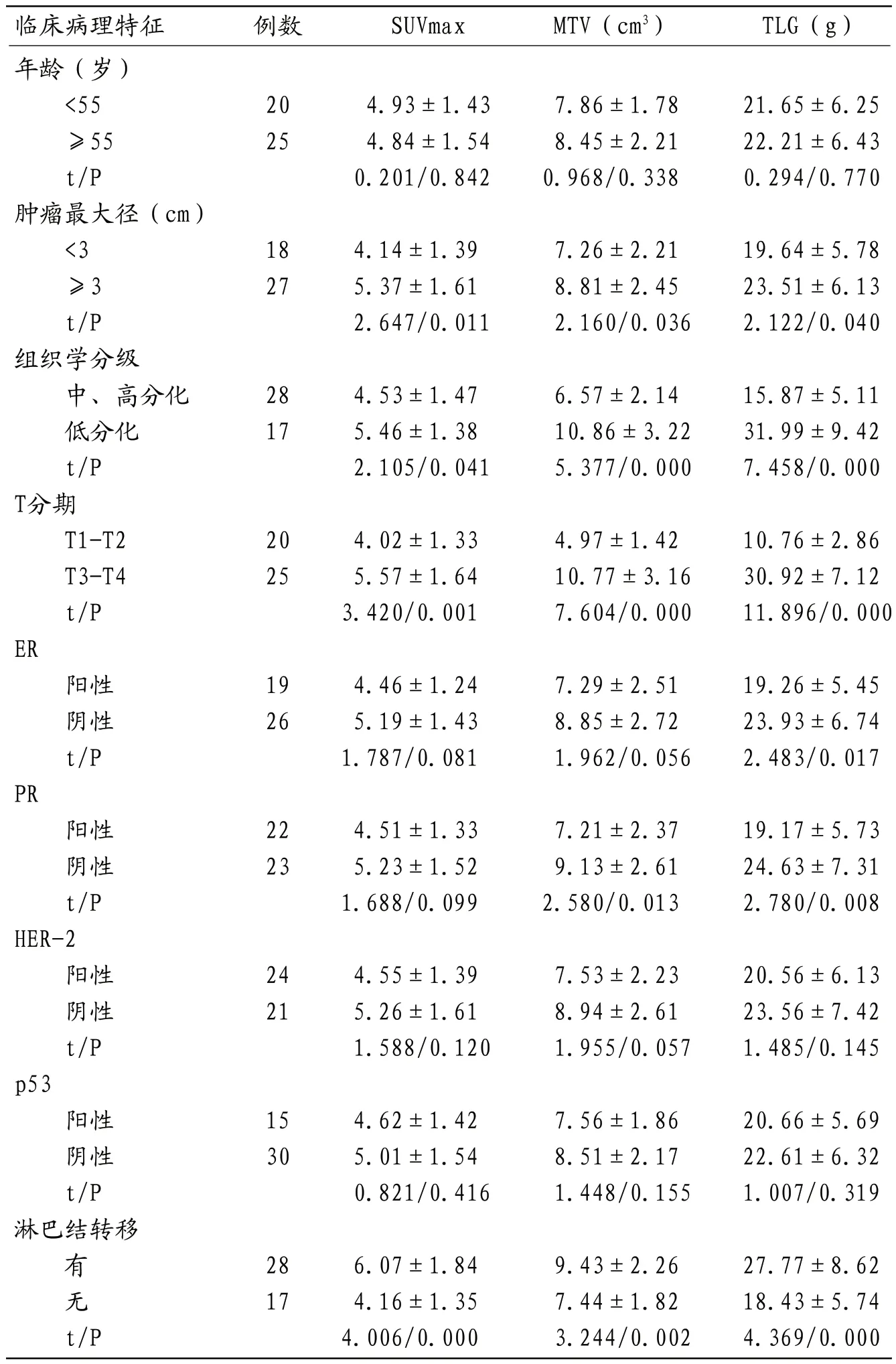
表1 乳腺癌原发灶18F-FDG PET-CT代谢参与与临床病理特征的关系
准确分期是决定治疗方案选择及预后的重要因素。目前,临床采用超声、CT等影像学检查进行临床分析,由于主要依据病灶体积进行判断,因而存在一定局限性。F-FDG PET-CT具备解剖功能与代谢功能双重功能,通过1次显像即可完成全身评估,在乳腺癌远处转移上表现出巨大优势。Ulaner等[12]回顾性分析了232例乳腺癌患者PET-CT资料,结果发现,PET-CT的应用,使得30例患者临床分期出现改变,15%IIB期患者被重新分期为IV期。近年来,关于乳腺癌PET-CT代谢参数与临床分期的关系日益为临床重视。Groheux等[13]研究表明,乳腺癌原发灶MTV、TLG与T分期明显相关,而SUVmax与T分期无相关性。而张倩等[9]亦认为,乳腺癌原发灶MTV、TLG与T分期有相关性。本研究显示,除MTV、TLG外,乳腺癌原发灶SUVmax亦与T分期有明显相关性,这与上述报道不符。这可能是因为SUVmax可受血糖、图像采集时间、衰减校正等多种因素影响。而TLG是综合性参数,考虑了肿瘤代谢活性及肿瘤体积,在恶性肿瘤诊断、分期中有着重要作用[14]。本研究显示,只有TLG在ER阳性与阴性者间有显著差异,表明TLG能够更好地反映肿瘤病理学特征。本研究还显示,乳腺癌转移淋巴结的SUVmax与原发灶SUVmax、MTV、TLG及T分期均呈正相关,表明转移淋巴结SUVmax能够指导乳腺癌术前分期。
综上所述,乳腺癌原发灶18F-FDG PET-CT代谢参数能够反映患者临床病理特征,在明确肿瘤ER、PR状态及T分期上有重要作用,尤其以TLG最具价值。
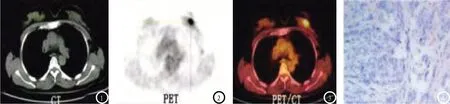
图1-4 患者,女,51岁,图1:CT平扫显示左侧乳腺外上象限腺体稍致密,无明显异常结节及肿块影;图2-3:PET图像可见明显FDG代谢灶,大小为17mm×15mm×15mm,SUVmax=5.11;图4:术后病理证实为乳腺浸润性导管癌,ER(+)、PR(+)、HER-2(-)、P53(-)。
