藜麦黄酒发酵工艺优化及抗氧化特性研究
2019-04-16张文刚杨希娟
张文刚 张 杰 党 斌 杨希娟
(1.青海大学农林科学院,青海 西宁 810016;2.青海省农林科学院青海省青藏高原农产品加工重点实验室,青海 西宁 810016;3.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016)
藜麦(ChenopodiumquinoaWilld)为藜科藜属一年生双子叶植物,原产于南美安第斯地区,由于其性质特征与小麦、水稻等常见谷物类似而被称为“假谷物”,它是目前联合国粮食及农业组织(FAO)认为唯一能满足人体基本营养需求的“全营养食品”[1]。藜麦蛋白质、氨基酸、维生素、矿物质等显著高于一般谷物,同时富含多酚、黄酮、皂苷、多糖等活性成分,表现出良好的抗氧化、抗肿瘤、降血脂、降血压、降血糖等功效,被国际营养学家称为“营养黄金”“未来食品”等[2-3]。目前,藜麦在中国山西、陕西、青海、四川、浙江等地区均有种植,作为一种“健康食品”原料具有广阔的开发前景[4]。
黄酒在中国酿造历史悠久,制作原料主要以稻米、黍米、小米、玉米等为主,其含有丰富的蛋白质、氨基酸、维生素,还含有多种有机酸、酯类物质及矿物质,兼具良好的食用和药用价值[5-7],对避免当下精加工食品功能营养缺乏、防治慢性代谢疾病、改善肠道菌群、降低胆固醇等有积极意义[8]。传统黄酒酿造工艺周期长、原料利用率低、劳动投入大,近年来广泛使用的液化法酿造新工艺以微生物和酶制剂的液化、糖化和发酵为基础,具有适用性广、效率高、醪液流动性可控、易机械化等优点,在多种杂粮黄酒的酿制中已有应用[9-10]。刘浩等[11]以炒制燕麦为原料,利用液化法制作燕麦黄酒,优化工艺后可得到口味醇爽、品质符合国标的黄酒产品;杨祖滔等[12]研究显示,在最佳条件下薏米糯米黄酒香味清幽、口感醇和、色泽鲜亮。黄酒发酵过程中原料多酚和黄酮溶出,单宁转化为小分子酚类,蛋白质部分分解为活性多肽和氨基酸,这些物质是其发挥清除自由基、抑制肿瘤、调节细胞代谢、抗菌消炎等多种生理功效的重要物质基础[13-14]。藜麦具有“全营养”特征,具有发展不同类型功能黄酒的良好前景。目前,藜麦黄酒研究尚处初始阶段,对其加工技术及功能性分析还需深入探讨。
试验拟以藜麦为原料,采用液化法发酵藜麦黄酒,对液化、糖化及主发酵条件进行优化,在此基础上探讨发酵过程中酒体抗氧化特性,以期为藜麦黄酒等发酵产品的研究提供理论参考。
1 材料与方法
1.1 材料与试剂
青藜2号:青海省农林科学院作物所;
耐高温α-淀粉酶(4.0×104U/g)、糖化酶(1.0×105U/g):食品级,江苏瑞阳生物科技有限公司;
活性干酵母:安琪酵母股份有限公司;
葡萄糖、福林酚、酪蛋白磷酸肽(Gly-Gly-Tyr-Arg):分析纯,北京索莱宝科技有限公司;
3,5-二硝基水杨酸(DNS)、苯酚、过硫酸钾、硫片:分析纯,南京化学试剂有限公司;
甲醇、无水乙醇、氢氧化钠、酒石酸钾钠、亚硝酸钠、硝酸铝、碳酸钠、三氯乙酸(TCA)、硫酸铜:分析纯,天津市津北精细化工有限公司;
试验中使用的水均为去离子水。
1.2 仪器与设备
紫外分光光度计:N4S型,上海仪电分析仪器公司;
电子天平:AL204型,梅特勒—托利多仪器(上海)公司;
生化培养箱:LRH-150型,上海齐欣科学仪器公司;
高速中药粉碎机:FW200型,天津华鑫仪器厂;
电热鼓风干燥箱:101A-2ET型,上海试验仪器厂有限公司;
电热恒温水浴锅:DKB-600B型,上海一恒科学仪器有限公司;
离心机:Centrigue 5430R型,德国艾本德公司。
1.3 试验方法
1.3.1 藜麦预处理 藜麦除杂清洗后45 ℃烘干,磨粉过60目筛,取藜麦粉适量按一定料液比95 ℃糊化10 min。
1.3.2 还原糖含量测定 采用DNS法[12]。葡萄糖标准溶液(1 mg/mL)梯度为0.0,0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,2.0 mL,实际样品3 000 r/min离心后取上清液测定,根据标准曲线定量。
1.3.3 酒精含量测定 采用比重法[15]。
1.3.4 藜麦液化、糖化条件优化 以还原糖含量为指标,通过单因素和L9(33)正交试验优化藜麦液化、糖化条件。液化探讨因素包括液化时间(10,20,30,40,50,60 min)、耐高温α-淀粉酶添加量(3,4,5,6,8,10 U/g)、液化温度(80,85,90,95,100 ℃);糖化探讨因素包括糖化时间(30,60,90,120,150,180,210,240 min)、加酶量(50,60,70,80,90,100,110 U/g)、糖化温度(40,45,50,55,60,65,70,75 ℃)。液化单因素试验固定条件:液化时间40 min、耐高温α-淀粉酶添加量5 U/g、液化温度95 ℃、料水比1.0∶3.5(g/mL);糖化单因素试验固定条件:糖化时间90 min、糖化酶添加量80 U/g、糖化温度60 ℃。
1.3.5 藜麦黄酒主发酵条件优化 以酒精含量为指标,通过单因素和L9(33)正交试验优化藜麦黄酒主发酵条件。探讨因素包括料水比[1.0∶2.5,1.0∶3.0,1.0∶3.5,1.0∶4.0,1.0∶4.5,1.0∶5.0(g/mL)]、酵母接种量(3.0%,3.5%,4.0%,4.5%,5.0%)、发酵温度(24,26,28,30,32,34,36 ℃)。在优化参数下发酵藜麦黄酒,持续发酵8 d,连续监测总酚、总黄酮、多肽含量及抗氧化性。主发酵单因素试验固定条件:料水比1.0∶3.5(g/mL)、酵母接种量4.0%、发酵温度28 ℃。
1.3.6 总酚、总黄酮含量测定 参照Adom等[16]的方法,结果分别以没食子酸当量(μmol/100 g·DW)和Trolox当量(μmol/100 g·DW)表示。
1.3.7 多肽含量测定 参照康树杰等[17]的方法。酪蛋白磷酸肽浓度梯度为0.0,0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6,1.8 mg/mL(5% TCA),样品以等体积10% TCA沉蛋白后,4 000 r/min离心15 min,取上清定容后,540 nm处测定OD值,按式(1)计算多肽的质量浓度。
C1=C0×50/2.5×100%,
(1)
式中:
C1——样品多肽的质量浓度,g/L;
C0——标准曲线中的多肽浓度,g/L。
1.3.8 抗氧化指标测定
(1)DPPH自由基清除能力:参照文献[18]。
(2)ABTS+自由基清除能力:参照文献[19]。
(3)FRAP铁还原力:参照文献[20]。
1.3.9 数据处理 采用Minitab 15软件及Excel进行数据处理。
2 结果与分析
2.1 藜麦液化工艺优化
根据单因素试验结果选择适宜参数水平(见表1),以还原糖含量为指标设计正交试验,试验结果见表2,方差分析见表3。
由表2、3可知,各因素对藜麦液化程度的影响主次顺序为高温α-淀粉酶添加量>液化温度>液化时间,最佳条件组合为A3B3C2,即液化时间50 min、酶添加量6 U/g、液化温度95 ℃;酶添加量和液化温度对液化物还原糖含量均有显著影响(P<0.05),液化时间影响不显著;与刘浩等[11]研究结果基本一致。

表1 藜麦液化正交试验因素水平表
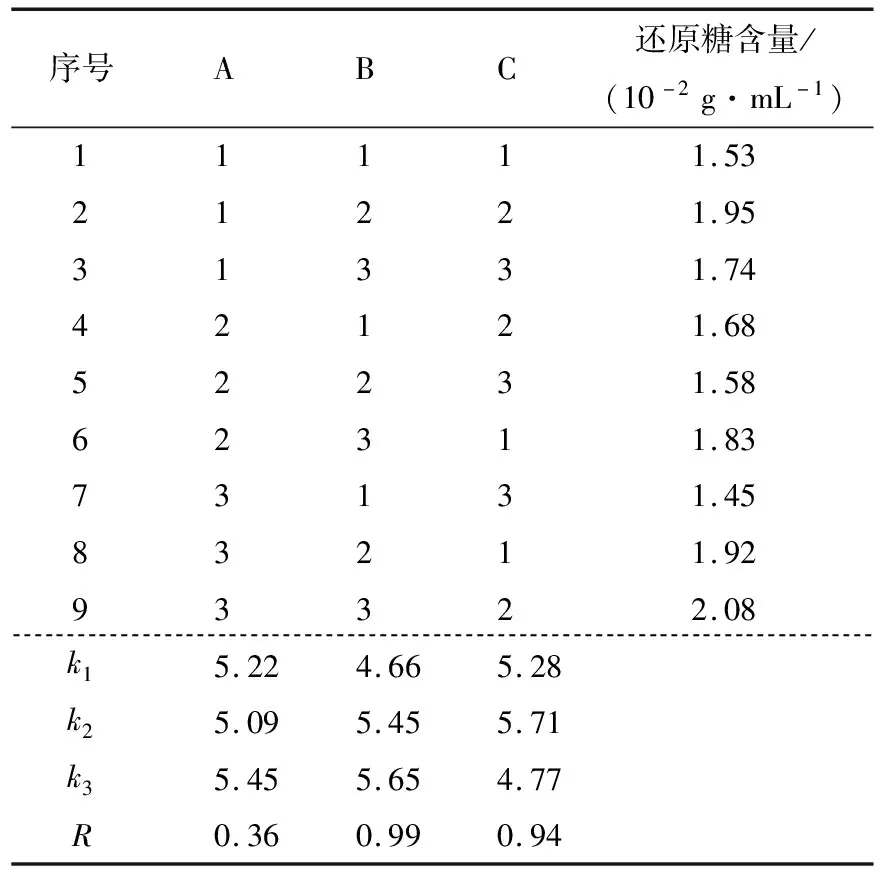
表2 藜麦液化正交试验结果

表3 藜麦液化正交试验方差分析表†
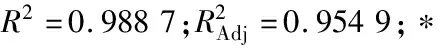
2.2 藜麦糖化工艺优化
根据单因素试验结果选择适宜参数水平(见表4),以还原糖含量为指标设计正交试验,试验结果见表5,方差分析见表6。

表4 藜麦糖化正交试验因素水平表

表5 藜麦糖化正交试验结果

表6 藜麦糖化正交试验方差分析表†
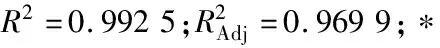
由表5、6可知,各因素对藜麦糖化程度的影响主次顺序为糖化温度>糖化酶添加量>糖化时间,最佳条件组合为A3B3C2,即糖化温度70 ℃、糖化酶添加量100 U/g、糖化时间150 min,与刘浩等[11]研究结果一致;3个糖化影响因素对还原糖含量的影响均达到显著水平(P<0.05)。
2.3 藜麦主发酵工艺优化
根据单因素试验结果选择适宜参数水平(见表7),以酒精度为指标进行正交试验,试验结果见表8,方差分析见表9。
由表8、9可知,各因素对醪液主发酵影响最大的为料水比,其次为酵母接种量,发酵温度影响相对较小;最优条件为A2B2C2,即料水比1∶4(g/mL)、酵母接种量4.0%、发酵温度30 ℃;料水比和酵母接种量对酒精度影响显著(P<0.05)。
2.4 发酵过程中黄酒活性成分及抗氧化活性的变化
2.4.1 总酚、总黄酮含量 由图1可知,总酚、总黄酮含量在整个发酵过程中均先增大后减小,在发酵6 d后又出现缓慢增加趋势。发酵前5 d,随着酵母繁殖和代谢作用的增强,发酵液酒精含量逐渐提高,使得总酚、总黄酮不断被浸提出[21],同时在酵母作用下物料部分结合酚类被溶出,使得酚类化合物总量逐渐升高;发酵5~6 d时,酚类化合物明显降低,可能与单体酚聚合及酚类物质氧化等作用有关[22];发酵6 d后,发酵体系中糖分减少使得发酵放缓,但随发酵时间的延长料液酒精度增加缓慢,部分结合酚释放及酚类继续溶出,使得酚类化合物含量再次增加。
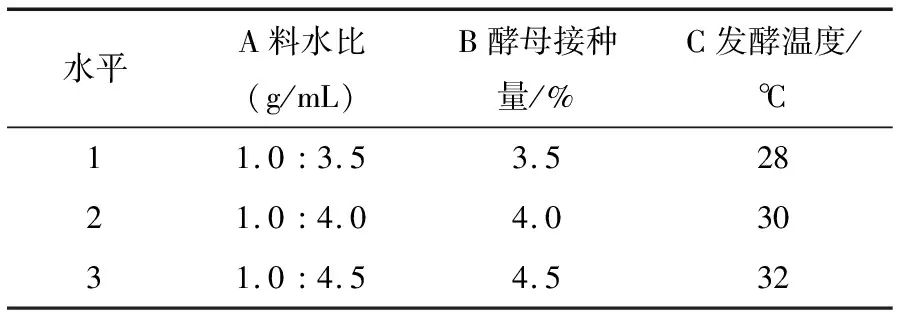
表7 藜麦主发酵正交试验因素水平表

表8 藜麦主发酵正交试验结果

表9 藜麦主发酵正交试验方差分析表†

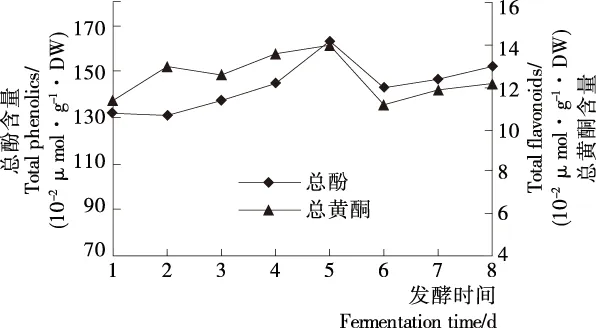
图1 藜麦糖化物发酵过程中总酚、总黄酮的变化
Figure 1 Changes in total polyphenol and total flavonoid contents during the fermentation of quinoa saccharide
2.4.2 多肽含量 由图2可知,随着发酵时间的延长,发酵液中多肽含量先升高后降低,发酵第4天,多肽含量达到最大值4.95 g/L;发酵7 d后多肽含量趋于稳定,保持在3.20 g/L左右。藜麦发酵过程中多肽主要来源于两个方面:① 微生物自溶;② 原料中的蛋白质分解。在发酵初期酵母大量繁殖并不断自溶,细胞中多肽释放进入发酵液中,同时蛋白质较多降解形成多肽;而在发酵后期微生物生长繁殖能力下降且蛋白质含量减少,多肽的形成与分解相对平衡,发酵液中多肽含量变化趋于稳定。

图2 藜麦糖化物发酵过程中多肽含量的变化
2.4.3 抗氧化性 由图3可知,DPPH自由基清除力、ABTS+自由基清除力及铁还原力在发酵过程中总体呈先增大后减小趋势。DPPH自由基清除能力在发酵第3天达最大值,之后快速降低,第4~8天变化缓慢;ABTS+自由基清除能力在发酵第4天达最高,第4~6天快速降低,而第6~8天出现波动;FRAP还原力在发酵初始(1~3 d)保持在较高水平,延长发酵时间,还原力逐渐下降,第8天保持在12.86 μmol/100 g·DW。藜麦发酵液中抗氧化性的变化可能与其活性物质含量和组成相关,总酚可能对FRAP铁还原力和DPPH自由基清除力影响较大,而总黄酮、多肽可能对ABTS+自由基清除能力影响较大。
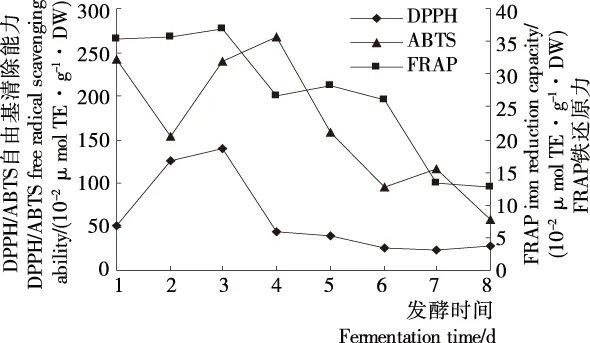
图3 藜麦糖化物发酵过程中抗氧化活性的变化
3 结论
(1)藜麦黄酒的最佳液化、糖化及主发酵工艺条件为:耐高温α-淀粉酶添加量6 U/g,液化温度95 ℃,液化时间50 min;糖化酶添加量100 U/g、糖化温度70 ℃、糖化时间150 min;料水比1∶4(g/mL)、酵母添加量4.0%、发酵温度30 ℃。
(2)藜麦黄酒含有较多活性物质且随发酵时间呈动态变化,其中黄酒总酚、总黄酮在主发酵第5天达到峰值,后发酵阶段仍能保持较高水平;多肽含量发酵第4天达到4.95 g/L,发酵后期保持在3.20 g/L,发酵过程是酒体特征及活性物质形成的关键时期。
(3)藜麦黄酒清除DPPH、ABTS+自由基能力及FRAP铁还原力呈先升高后降低趋势,发酵第3天总体抗氧化性最强,发酵后期仍保持一定抗氧化活性;发酵液的体外抗氧化特征可能与其活性物质的形成及变化有关。
(4)试验中酵母添加量大,但发酵较缓慢,发酵物酒精度偏低,主要由于藜麦经液化糖化后还原糖含量低;后续可从醪液糖度调控、酵母选择等方面优化,并结合抗氧化性特征,制作品质、功能性较优的藜麦黄酒产品。
