不同贮藏条件下鸡胸肉特征腐败菌分析
2019-04-16尹德凤张大文罗林广
张 莉 尹德凤 张大文 罗林广
(1.江西省农业科学院农产品质量安全与标准研究所,江西 南昌 330200;2.农业部畜禽产品质量安全风险评估实验室〔南昌〕,江西 南昌 330200;3.江西省农科院农产品质量与安全重点实验室,江西 南昌 330200)
鸡肉肉质细嫩、营养丰富,是中国的主要消费肉类之一[1]。近年来,鸡肉的消费量呈现逐年递增的趋势。为了抑制禽类疾病,尤其是禽流感的传播,国家推行禽类集中屠宰,冷链配送,冷鲜上市。但是,由于冷鲜鸡肉从屠宰、加工、运输、销售到消费链条较长,各环节中微生物的污染不可避免,一旦整个链条中温度控制不严,时间过长,微生物将会大量繁殖,加快肉品腐败变质。这些直接导致肉品腐败变质的微生物即为腐败菌(spoilage organisms,SO)[2]。
已有的研究[2-3]表明,腐败菌并不单独引发腐败,通常是与其他微生物不断地相互竞争或协同作用影响着产品的腐败进程。因此,研究肉品表面微生物多样性变化,是探索肉品腐败变质诱因的主要途径和手段。但是由于传统的培养分离技术分离效率低,时间长,过程繁杂,且绝大多数微生物是不可培养的,通过传统的培养分离技术只能获得不到1%的微生物种类,无法有效地对腐败过程中的细菌多样性进行完整分析[4]。而基于16S rRNA的高通量测序方法可以获得样品中更多的DNA信息,具有更快捷,通量高,重复性好,精确度高的优点,在食品微生物多样性的研究中得到了广泛的应用。譬如,Ercolini等[5]采用16S rRNA的高通量测序方法对不同包装形式下牛肉中腐败微生物变化规律进行了调查,结果显示不同包装条件下牛肉中的优势腐败微生物截然不同。De Filippis等[6]通过高通量技术手段,发现不同切割部位的牛肉腐败微生物的组成是不尽相同的。Meng等[7]通过Miseq高通量测序技术对不同温度保存下的禽产品中微生物多样性进行分析,发现温度显著影响鸡肉表面细菌多样性和优势腐败菌的组成。上述结果表明,产品中腐败菌(special spoilage organisms,SSO)因肉品的种类、来源、屠宰方式、分割部位、保鲜包装条件和储存运输条件等不同而存在差异。
试验拟以宁都黄鸡新鲜鸡胸肉为研究对象,分析测定不同贮藏条件(4 ℃真空包装、4 ℃有氧托盘包装和25 ℃ 有氧托盘包装)下生鲜鸡肉的菌落总数和挥发性盐基氮(TVB-N)值,以期阐明不同贮藏条件下鸡胸肉理化指标和表面菌的多样性变化规律,探寻其特征腐败菌,为生鲜鸡肉的贮藏保鲜技术研发提供理论依据。
1 材料和方法
1.1 试验材料
宁都黄鸡:江西惠大实业有限公司;
无菌采样袋:北京陆桥技术股份有限公司;
无菌真空包装袋:得力集团有限公司;
聚乙烯保鲜膜:华润超市。
1.2 试剂
平板计数琼脂培养基:青岛海博生物技术有限公司;
盐酸、氢氧化钠、乙醇、甲基红指示剂等:分析纯,国药集团化学试剂有限公司。
1.3 仪器设备
生化培养箱:SPX-250BSH-II型,上海新苗医疗器械制造有限公司;
洁净工作台:SW-CJ-1FD型,苏州安泰空气技术有限公司;
真空包装机:14885型,得力集团有限公司;
拍击式均质器:BagMixer®400cc型,法国Interscience公司;
高速台式冷冻离心机:Sorvall ST16R型,美国Thermo公司;
PCR仪:ABI GeneAmp®9700型,美国应用生物系统公司;
电子天平:PL602E型,梅特勒—托利多仪器(上海)有限公司。
1.4 方法
1.4.1 样品制备 生鲜鸡肉样品制备参照文献[8]的方法进行,活鸡宰杀后拔毛清洗,胴体经次氯酸钠溶液浸泡消毒(浓度50 mg/L),无菌冷却水冲洗,无菌操作取鸡胸肉并切成小块,最后将全部鸡肉块置于无菌采样袋内颠倒数次混合均匀,立即置于冰水中预冷1 h。
1.4.2 样品分装贮藏与样品采集
(1)4 ℃托盘贮藏:将聚苯乙烯托盘用75%酒精擦拭后,置于紫外灯下照射30 min进行消毒。将预冷后的鸡胸肉分装至已消毒的聚苯乙烯托盘中,每份60 g,共计21份,然后样品表面用聚乙烯保鲜膜覆盖,置于4 ℃温度下贮藏,每天取样1次,试验周期为7 d[9]。
(2)4 ℃真空贮藏与样品采集:将预冷后的鸡胸肉分装至无菌真空包装袋中,每份60 g,共计33份,样品经真空包装后置于4 ℃温度下贮藏,每天取样1次,试验周期为11 d[8]。
(3)25 ℃托盘贮藏与样品采集:将预冷后的鸡胸肉分装至已消毒的聚苯乙烯托盘中,每份60 g,共计9份,然后样品表面用聚乙烯保鲜膜覆盖,置于25 ℃温度下贮藏,每天取样1次,试验周期为3 d。
(4)鸡肉表面微生物样品处理:在各取样时间点,称取25 g样品于无菌均质袋中,并加入225 mL无菌生理盐水,置于均质器上适当拍击后,取100 mL均质液于离心管中,300 r/min离心10 min,弃沉淀,上清液转移至50 mL 高速无菌离心管中,12 000 r/min离心10 min,弃上清,沉淀用1 mL生理盐水转移至冷冻保藏管中,于-80 ℃ 条件下保存备用。
1.4.3 细菌总数测定 按GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数》执行。
1.4.4 挥发性盐基氮(TVB-N)测定 按GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定 半微量定氮法》执行。
1.4.5 微生物多样性分析
(1)DNA提取及MiSeq测序:样品中DNA提取参照Xu等[10]的方法进行,细菌16S rDNA V3-V4扩增引物为338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)。PCR反应体系为:4 μL 5×FastPfu Buffer、2 μL 2.5 mmol/L dNTPs、0.8 μL Forward Primer(5 μmol/L)、0.8 μL Reverse Primer(5 μmol/L)、0.4 μL FastPfu Polymerase、0.2 μL BSA、10 ng Template DNA,补ddH2O至20 μL。反应参数:① 95 ℃预变性3 min;② 27×(95 ℃变性30 s;55 ℃退火30 s;72 ℃延伸45 s);③ 72 ℃延伸10 min,10 ℃保持。2%琼脂糖凝胶电泳检测PCR产物,大小正确,条带清晰可见的目标条带用于进行后续测序试验,MiSeq测序委托上海美吉生物医药科技有限公司完成。
(2)数据分析:使用上海美吉生物医药科技有限公司提供的免费在线数据分析平台——I-Sanger对数据进行分析(www.i-sanger.com)。
2 结果与分析
2.1 菌落总数的变化
如图1所示,4 ℃托盘贮藏的鸡胸肉在整个试验期间呈现先降低再缓慢上升的趋势,第7天菌落总数为(6.25±0.27)lg(CFU/g);4 ℃真空贮藏的鸡胸肉菌落总数呈现先降低再升高再降低的趋势,第4天菌落总数达到峰值,为(4.78±0.07)lg(CFU/g);25 ℃托盘贮藏的鸡胸肉菌落总数呈现快速上升的趋势,第2天菌落总数为(8.44±0.04)lg(CFU/g)。分析4 ℃下菌落总数出现波动的原因,可能是因为鸡胸肉表面微生物结构复杂,许多嗜温微生物并不能适应低温环境,因此在4 ℃托盘贮藏和4 ℃真空贮藏初期均出现了菌落总数下降的现象,随着许多耐低温细菌的不断生长繁殖,菌落总数又会慢慢回升,当4 ℃真空贮藏鸡肉组织中残存的氧分子不断被消耗掉,好氧菌开始减少,导致真空冷藏后期菌落总数的再次回落。根据GB 16869─2005《鲜、冻禽产品》规定:鲜禽产品的菌落总数≤1×106CFU/g,可以看出,4 ℃ 托盘贮藏鸡胸肉的菌落总数在第7天超过标准规定值,25 ℃托盘贮藏的第2天就已超过规定值,而4 ℃真空贮藏的试验期间均在标准规定范围内。
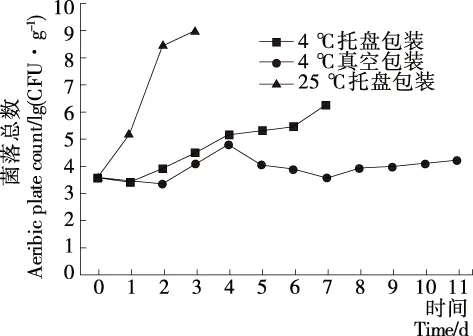
图1 不同贮藏条件下鸡胸肉菌落总数变化
Figure 1 Aerobic plate count of chicken breast during storage under different conditions
2.2 TVB-N值的变化
GB 2707─2016《食品安全国家标准鲜(冻)畜、禽产品》标准规定的TVB-N值限值为15 mg/100 g。由图2可以看出,4 ℃托盘贮藏和4 ℃真空贮藏鸡胸肉在整个试验期间的TVB-N值变化较少,且低于标准限值,而25 ℃托盘贮藏的迅速上升,在第1天就已接近标准限值。

图2 各贮藏条件下鸡胸肉TVB-N值变化
2.3 鸡胸肉表面细菌多样性的变化
2.3.1 测序数据统计 对混匀分装前的初始样本进行了表面细菌多样性分析,并根据鸡胸肉样本菌落总数值和TVB-N测定值,选择4 ℃托盘贮藏第2天和第7天、4 ℃真空贮藏第2天和第11天以及25 ℃托盘贮藏第1天和第3天的样本,进行鸡胸肉表面细菌多样性分析和比较。经拼接、过滤等数据前处理,7个样本一共得到255 075条有效16S rRNA序列,平均长度为448.53 bp。按照97%相似性对非重复序列(不含单序列)进行运算分类单元(OTU)聚类,得到OTU总数为504个。不同样本的序列信息见表1。在不同贮藏条件下的OTU数,均为试验前期的数值高于后期数值。样本在分装前于同一采样袋中充分混匀,保证了各样本初始状态处于同一水平,分装贮藏后,随着贮藏时间的推移,各贮藏条件下的优势菌不断生长,鸡肉样本中的OTU数随之降低。4 ℃托盘贮藏保存后期比前期减少了近70.33%。25 ℃托盘贮藏储存后期比前期减少了73.33%;与有氧贮藏环境相比,真空冷藏环境下贮藏后期鸡肉表面细菌的OTU数与前期相比变化并不十分显著,仅减少了10.76%。
2.3.2 稀释曲线分析 为了验证取样数量的合理性,对样品的稀释曲线进行分析,如图3所示,所有样本的稀释曲线均已趋向平坦,说明试验取样数量合理,测序深度已基本覆盖样本中所有微生物。
2.3.3 阿尔法多样性分析 样本表面细菌阿尔法多样性结果采用丰富度指数chao1值、物种覆盖度和香农多样性指数值进行表示。如表2所示,不同贮藏条件的样本物种覆盖度均为1.00,说明试验样本中所含序列均被成功测序,该次测序结果可反映样本中细菌群落结构的真实情况。4 ℃托盘贮藏的鸡胸肉第7天表面细菌丰富度指数chao1值较第2天降低了38.47%,香农多样性指数值降低了79.10%,说明该贮藏条件下,细菌丰富度和多样性均随着贮藏时间的增加而降低;4 ℃真空贮藏的鸡胸肉第11天较第2天的丰富度指数chao1值上升了11.84%,香农多样性指数值降低了43.86%,说明该贮藏条件下,细菌丰富度随着贮藏时间的增加稍有上升,而多样性呈现下降趋势。25 ℃托盘贮藏的鸡胸肉第1天较第3天丰富度指数chao1值降低了81.67%,香农多样性指数值降低了7.49%,说明该贮藏条件下,细菌丰富度随着贮藏时间的增加急剧下降,而多样性稍有降低。
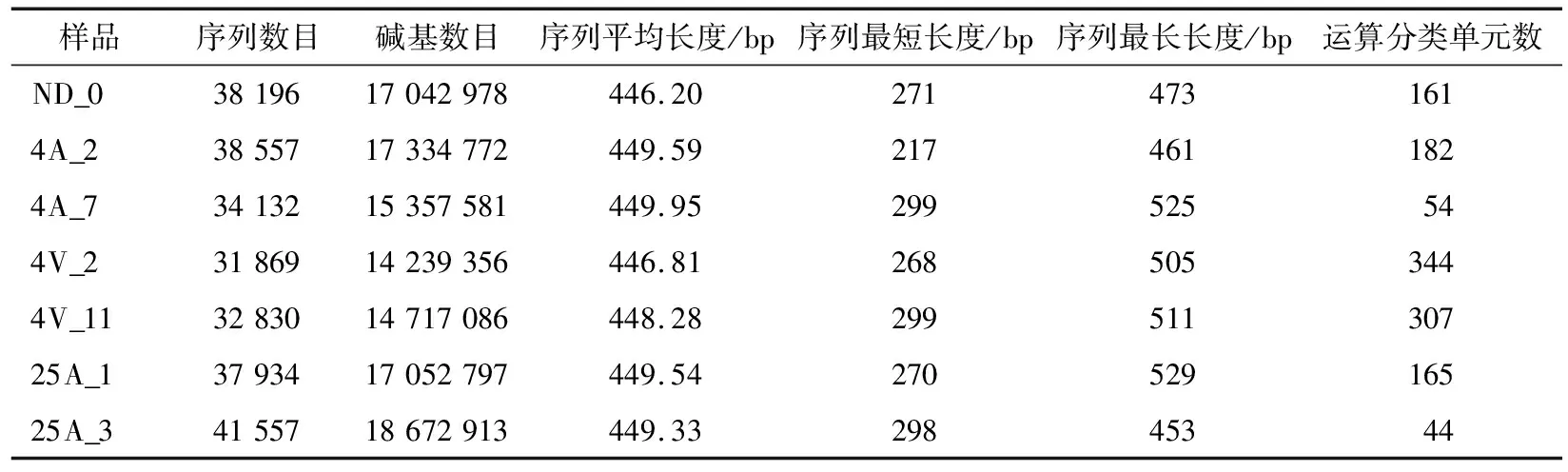
表1 样本序列信息统计表†
† ND_0为分装前的初始样本;4A_2、4A_7分别为4 ℃托盘贮藏第2天和第7天的样本;4V_2、4V_11分别为4 ℃ 真空贮藏第2天和第11天的样品;25A_1、25A_3分别为25 ℃托盘贮藏第1天和第3天的样本。

ND_0.分装前的初始样本 4A_2.4 ℃托盘贮藏第2天的样本 4A_7.4 ℃托盘贮藏第7天的样本 4V_2.4 ℃真空贮藏第2天的样品 4V_11.4 ℃真空贮藏第11天的样品 25A_1.25 ℃托盘贮藏第1天的样本 25A_3.25 ℃托盘贮藏第3天的样本
图3 稀释性曲线图
Figure 3 Rarefaction curves
2.3.4 物种群落结构特征 鸡胸肉样本表面细菌群落结构变化如图4所示。变形菌门(Proteobacteria)在所有样本中的相对丰度最大,初始样本中相对丰度为85.48%,4 ℃ 托盘贮藏的第2天变形菌门占94.16%,第7天(菌落总数已超标)为99.58%;25 ℃托盘贮藏的第1天变形菌门占86.70%,第3天(严重腐败)为93.08%;而4 ℃真空贮藏的第2天变形菌门相对丰度下降为66.14%,第11天又回升至83.66%,但仍低于初始样本的85.48%[图4(a)],而此时的鸡胸肉相关理化指标仍保持在新鲜鸡肉允许范围内,样品未发生腐败变质。

表2 样本表面细菌阿尔法多样性指数分析†
† ND_0为分装前的初始样本;4A_2、4A_7分别为4 ℃托盘贮藏第2天和第7天的样本;4V_2、4V_11分别为4 ℃真空贮藏第2天和第11天的样品;25A_1、25A_3分别为25 ℃托盘贮藏第1天和第3天的样本。
从属水平上分析,初始样本中以假单胞菌属细菌为主,丰度约65.82%,另外短波单胞菌属细菌的丰度约为9.85%,寡养单胞菌属细菌的丰度约4.63%,金黄杆菌属细菌的丰度约3.60%,漫游球菌属细菌的丰度约3.51%,鞘氨醇杆菌属细菌的丰度约2.68%,假苍白杆菌细菌的丰度约1.48%,产碱菌细菌的丰度约1.29%。从图4(b)可以看出,鸡胸肉在4 ℃和25 ℃温度下采用真空和托盘包装贮藏,从贮藏初期开始各条件下的鸡肉表面细菌结构就已开始发生明显变化。
不同贮藏条件下鸡胸肉表面细菌群落结构与初始样本比较,相对丰度变化较大的物种包括:假单胞菌属、肠杆菌科未分类属、志贺氏菌属、乳杆菌属、沙雷氏菌属、泛菌属、葡萄球菌属、欧文氏菌属、肠球菌属、芽胞杆菌属等。

25A_1.25 ℃托盘贮藏第1天的样本 25A_3.25 ℃托盘贮藏第3天的样本 4A_2.4 ℃托盘贮藏第2天的样本 4A_7.4 ℃托盘贮藏第7天的样本 4V_2.4 ℃真空贮藏第2天的样品 4V_11.4 ℃真空贮藏第11天的样品 ND_0.分装前的初始样本
图4 鸡胸肉表面细菌的物种群落柱形图
Figure 4 Profiling histogram of bacteria on the surface of chicken breast
假单胞菌属细菌在初始样本中的丰度为65.82%,在不同条件的贮藏前期假单胞菌属细菌丰度均有所下降,4 ℃ 托盘贮藏和4 ℃真空贮藏的第2天分别降至59.87% 和35.50%,25 ℃托盘贮藏的第1天降为54.64%。在试验结束时,4 ℃托盘贮藏和4 ℃真空贮藏样本的丰度又有不同程度的回升,4 ℃托盘贮藏第7天回升至99.45%,4 ℃ 真空贮藏第11天回升至81.08%,分别比初始样本提高了51.09%和23.18%;而在25 ℃托盘贮藏试验结束时,假单胞菌属细菌丰度为60.23%,比初始样本65.82%略有下降。
通过分析,4 ℃托盘贮藏时,鸡胸肉产品中的特征腐败微生物是假单胞菌,与Wang等[11]、高磊等[12]、Arnaut-Rollier等[13]的研究结果一致。虽然这些试验所用的鸡肉品种、来源、取样部位以及加工环境都不同,且样本的初始菌相也不尽相同,但4 ℃托盘贮藏的鸡肉样本在贮藏后期的优势腐败菌都指向假单胞菌。说明采用4 ℃托盘贮藏生鲜鸡肉的特征腐败菌并不受鸡肉品种、来源和鸡肉部位的影响,因此,要延缓该贮藏条件下冷鲜鸡肉的腐败进程,延长货架期,控制假单胞菌属细菌的生长是重要手段之一。在4 ℃真空贮藏条件下,假单胞菌属细菌也在很大程度上决定了该贮藏条件下鸡胸肉的腐败进程,是该条件包装产品的主要特征腐败细菌之一,与Rossaint等[14]、Herbert等[15]、Holl等[16]的研究结果一致。肠杆菌科细菌中,相对丰度的主要变化来源于志贺氏菌属、肠杆菌科未分类属、沙雷氏菌属、泛菌属、欧文氏菌属等。在初始样本中除了肠杆菌科未分类属细菌丰度为0.90%外,其余肠杆菌科各属细菌丰度<0.01%。4 ℃托盘贮藏的第2天,肠杆菌科未分类属细菌丰度为14.18%,志贺氏菌属细菌丰度为8.76%,沙雷氏菌属细菌丰度为6.40%,泛菌属细菌丰度为2.08%;4 ℃真空贮藏的第2天肠杆菌科未分类属细菌丰度为11.78%,志贺氏菌属细菌丰度为6.64%,沙雷氏菌属细菌丰度为5.51%,泛菌属细菌丰度为1.76%;25 ℃托盘贮藏的第1天,肠杆菌科未分类属细菌丰度为5.49%,志贺氏菌属细菌丰度为17.34%,沙雷氏菌属细菌丰度为0.43%,泛菌属细菌丰度为6.17%。4 ℃托盘贮藏的第7天,除肠杆菌科未分类属细菌丰度为0.08%外,肠杆菌科其余各属细菌丰度<0.01%;4 ℃真空贮藏的第11天除肠杆菌科未分类属细菌丰度为1.30%外,肠杆菌科其余各属细菌丰度<0.01%;25 ℃托盘贮藏的第3天,肠杆菌科未分类属细菌丰度为14.49%,志贺氏菌属细菌丰度为4.55%,沙雷氏菌属细菌丰度为9.50%,泛菌属细菌丰度为0.77%。
25 ℃托盘贮藏鸡肉的腐败菌多由肠杆菌科细菌组成,主要包括沙雷氏菌属细菌、志贺氏菌属细菌、肠杆菌科未分类属细菌、泛菌属细菌,另外芽孢杆菌属细菌、梭菌属细菌、葡萄球菌属细菌和肠球菌属细菌也在该条件下发挥着腐败协同作用,这些细菌都是嗜温细菌,一旦温度合适,会在短时间内快速繁殖,使鸡肉发生腐败。因此,冷鲜鸡肉从生产加工到运输和贮藏销售的整个冷链系统必须完整并全程控温,一旦温度失控,即使是短时间失控,也会对整批产品造成无法挽回的损失。
乳杆菌属细菌在初始样本中的丰度仅为0.42%,但4 ℃ 真空贮藏的第2天高达12.03%,较初始样本升高了约27.6倍,第11天丰度仍高达6.9%,较初始样本升高了约15.4倍。托盘贮藏时,乳杆菌属细菌也有少量生长,在4 ℃托盘贮藏的第2天丰度为0.85%,较初始样本升高了约1倍,第7天降至0.06%,远低于初始样本;在25 ℃托盘贮藏的第1天丰度为3.97%,较初始样本高了约8.4倍,第3天降至0.80%,但仍高于初始样本。乳杆菌属细菌在4 ℃真空贮藏的整个过程中丰度均比较高,在贮藏第2天和第11天乳杆菌属细菌相对丰度均仅次于假单胞菌属,因此在很多通过平板培养法或其他分析方法的研究[12,17-18]中很容易从样品中分离获得乳杆菌属细菌信息。但要确定这些分离的乳酸菌在真空贮藏条件下发挥的确切作用,不能仅因为从腐败样品中分离或获得了相关菌株信息,就将乳酸菌定义为该样品的腐败菌,必须通过回接测定其腐败能力或进行相关的抑菌试验等来进行判断。
葡萄球菌属细菌在初始样本中丰度仅为0.16%,但4 ℃ 真空贮藏2 d后为3.67%,较初始样本升高了约21.9倍,至第11天该属细菌的丰度有所下降,为0.81%,但仍较初始样本高;4 ℃托盘贮藏的第2天该属细菌的丰度为0.25%,到第7天低于0.01%;25 ℃托盘贮藏1 d后,该属细菌丰度为3.73%,较初始样本升高了约22.3倍,第3天时又降为0.25%。
3 结论
试验对4 ℃托盘贮藏、4 ℃真空贮藏和25 ℃托盘贮藏3种条件下生鲜鸡肉的菌落总数和TVB-N值变化进行了测定,并根据该理化数值选取各贮藏条件下的前期与后期样本,进行鸡胸肉表面细菌多样性分析。通过对前期与后期样本表面细菌群落结构分析,发现嗜冷细菌假单胞菌为4 ℃托盘贮藏和4 ℃真空贮藏鸡肉的共同特征腐败菌。25 ℃托盘贮藏的特征腐败菌由肠杆菌、芽孢杆菌、梭菌和肠球菌等组成。嗜温细菌会在冷藏温度失去控制的情况下,快速地在鸡肉中生长使产品发生腐败。因此,嗜冷细菌假单胞菌生长的控制和冷藏温度的全程无缝监控是冷鲜鸡肉产业中需重点关注的两个方面。而乳杆菌、肠杆菌、芽孢杆菌、肠球菌、明串珠菌、葡萄球菌以及梭菌等细菌在4 ℃低温贮藏前期出现到底是参与腐败加快进程作用,还是抑制腐败延缓腐败进程作用还有待进一步研究,特别是乳杆菌在真空包装生鲜鸡肉中的作用。但由于在设定的11 d贮藏期内,鸡胸肉样品各理化指标并没有发展到腐败变质的程度,没有获得4 ℃真空贮藏鸡胸肉腐败状态下的细菌多样性相关信息,因此有必要延长试验周期,确保能获得该贮藏条件下的腐败样品,进而分析判断该贮藏条件下鸡胸肉中的特征腐败菌。
