荧光光谱法测定淀粉中的直链淀粉
2019-04-15,,,
,,,
(忻州师范学院化学系,山西忻州 034000)
天然淀粉由直链淀粉和支链淀粉两大主要成份组成,直链淀粉与支链淀粉在不同来源的淀粉中的含量不同。大多数植物的淀粉中直链淀粉含量为10%~12%,但有一些植物的淀粉中直链淀粉含量较高。如玉米淀粉和马铃薯淀粉中直链淀粉的含量分别为27%和20%[1]。直链淀粉用途广泛,涉及食品、医疗保健、材料、纺织、造纸、包装、环保等多个领域,可用作食品添加剂、增厚剂、固定剂和包衣剂,还可用于制作对氧和油脂具有良好隔绝性的产品保护层等[2]。由于直链淀粉具有优越的性能和广泛的应用前景,且其含量在评价粮食和食品品质及农业选种、育种中具有重要意义,因此选择一种准确、有效、简便的测定直链淀粉含量的测定方法具有重要的实际意义[3]。
测定直链淀粉含量的标准方法是碘比色法[4],它包括国家标准、国际标准和农业部标准,这些标准方法的测定,前处理复杂,技术性强,步骤繁琐,应用受到很大限制;目前常用的直链淀粉含量的测试方法是碘亲和力滴定法[5]和双波长法[6]。碘亲和力滴定法有电位滴定法和电流滴定法,借助于电位和电流的变化,使得该法快速、简便,能进行大批量样品的检测。但由于支链淀粉也会与碘形成络合物,因此,测定有一定的误差,双波长法克服了上述缺点,提高了灵敏度和选择性。也曾有采用伴刀豆球蛋白法[7]和排阻色谱分析法[8]测定直链淀粉含量的报道,这两种方法虽然测定结果准确,但伴刀豆球蛋白法要求在指定的pH、温度和离子强度下测定,原理复杂,使用酶试剂;排阻色谱分析法淋洗时间长,色谱柱的要求高,而且需要将直链淀粉从被测样品中分离。最新发展的直链淀粉含量测定的方法有近红外光谱分析法[9]、自动分析检测法[10],近红外光谱分析法方便、样品用量小,不消耗化学试剂,不污染环境。但它的准确性与定标模型建立的质量和合理使用模型有很大关系,收集模型样品人力、物力耗费大,而且不能用于直链淀粉含量的精确测定和食品材料的评价。自动分析检测法原理与碘比色法一样,用仪器代替了人工,提高了工作效率,但需经常更换塑胶药管等零配件。
Charoenkuln等[11]报道了采用荧光标记和高效排阻色谱法同时测定木薯直链淀粉含量和支链淀粉链长的方法,这种方法虽然测定结果准确,但测定过程既需分离直链淀粉,又需进行荧光标记反应,不仅测定步骤繁琐,而且测定条件苛刻。因此,对直链淀粉含量的测试迫切需要一种简便、快速、准确的方法。本实验探究了利用直链淀粉自身产生的荧光信号,不加显色剂,不加荧光标记物,不需要分离,快速、准确的测定淀粉中直链淀粉含量的方法。
1 材料与方法
1.1 材料与仪器
直链淀粉标准品 天津市光复精细化工研究所;支链淀粉标准品 梯希爱化成工业发展有限公司;玉米淀粉、土豆淀粉 食品级,忻州华美超市。
F-4500荧光分光光度计 日本日立公司;pHS-3TC精密数显酸度计 上海天达仪器有限公司;AB204-N电子分析天平 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 样品前处理 称取10 g过100目筛的玉米淀粉和土豆淀粉,用石油醚脱脂3次,在恒温干燥箱中于120 ℃恒温干燥3 h,待用。
1.2.2 溶液的配制 标准品溶液的配制:准确称取一定量的支链淀粉和直链淀粉标准品,用二次蒸馏水分别配制1.0 mg/mL、1.0 μg/mL的支链淀粉、直链淀粉标准品水溶液。
标准曲线溶液的配制:用1.0 μg/mL的直链淀粉标准品水溶液1.00、2.00、3.00、4.00、5.00、6.00、7.00 mL分别于7个10 mL比色管中,用二次水稀释到刻度,得0.1、0.2、0.3、0.4、0.5、0.6、0.7 μg/mL的直链淀粉标准品水溶液。
玉米淀粉、土豆淀粉溶液配制:称取处理好的玉米淀粉样品、土豆淀粉样品,配制1.0 mg/mL和1.0 μg/mL的玉米淀粉和土豆淀粉溶液。
1.2.3 激发波长与发射波长的测定 在2支10 mL比色管中,加入4.0 mL浓度为1.0 μg/mL的直链淀粉标准品溶液,用二次蒸馏水定容至刻度,摇匀。在狭缝宽度为5 nm,在300~480 nm范围内荧光扫描,确定其最大激发波长和发射波长。
1.2.4 放置时间对荧光强度的影响 分别移取浓度为0.4 μg/mL直链淀粉水溶液于10 mL比色管中,在狭缝宽度为5 nm、激发波长为370 nm条件下,分别测定溶液放置时间为0.5、1.0、1.5、2.0和2.5 h的荧光强度。
1.2.5 温度对荧光强度的影响 取10份0.4 μg/mL直链淀粉水溶液于10 mL比色管中,在狭缝宽度为5 nm,激发波长为370 nm条件下,分别测定温度为20、24、28、32、36、40、44、48、52、56 ℃的荧光强度。
1.2.6 干扰试验 分别准确移取0.4 mL浓度为1.0 mg/mL的直链淀粉标准品水溶液于6个1000 mL容量瓶中,然后分别加入4.0、8.0、16.0、24.0、32.0、40.0 mL浓度为1.0 mg/mL的支链淀粉标准品水溶液,得到含有0.4 μg/mL直链淀粉标准品和4.0、8.0、16.0、24.0、32.0、40.0 μg/mL支链淀粉标准品混合溶液中(即混合溶液中直链淀粉与支链淀粉浓度比为1∶10、1∶20、1∶40、1∶60、1∶80、1∶100)。在狭缝宽度为5 nm、激发波长为370 nm条件下,分别测定六个混合溶液的荧光强度。
1.2.7 方法检出限的测定与计算 在狭缝宽度为5 nm、激发波长为370 nm条件下,分别测定10份浓度为0.10 μg/mL的直链淀粉标准品溶液的荧光强度,参考文献[12]方法,按如下公式计算方法检出限:
式中:CL-方法检出限(μg/mL);s-标准偏差;k-标准曲线斜率。
1.2.8 加标回收率试验 采用文献[13]方法测定平均回收率和相对标准偏差。
1.2.9 荧光光谱法与国标法的比较 于4支25 mL比色管中分别加入0.60 μg/mL玉米淀粉、土豆淀粉溶液,在狭缝5 nm条件下,分别测定2支玉米淀粉、土豆淀粉溶液的荧光强度,平行测定6次;另参照国标GB 7648-1987分析方法[15],分别测定另2支玉米淀粉与土豆淀粉中直链淀粉的含量,平行测定6次。
1.3 数据处理
所有数据和图表均采用Excel(2010版)和Orgin 8.5软件处理。
2 结果与分析
2.1 标准曲线的绘制
由实验得出直链淀粉标准品溶液的标准曲线如图1所示。
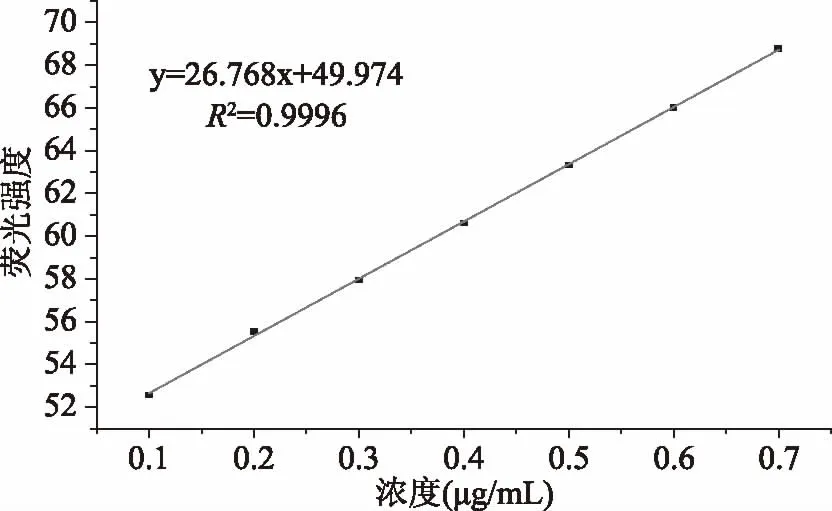
图1 直链淀粉标准曲线Fig.1 Standard curve of amylose
由图1可知,直链淀粉在0.10~0.70 μg/mL范围内与荧光强度呈良好线性关系,其线性回归方程为:y=26.768x+49.974,r=0.9996。
2.2 激发与发射光谱
按照1.2.3测定方法,测定直链淀粉的荧光光谱,结果如图2、图3所示。由图2~图3可知,直链淀粉激发波长和发射波长分别为370和422 nm。这与文献[14]报道的淀粉-水悬浮液的荧光位于300~450 nm相吻合。直链淀粉是由α-D-葡萄糖通过α-D-1,4糖苷键连接而成的链状分子,其分子结构中含有C-O-C的环醚键,吸光后环醚键C-O-C中的氧未共享电子发生n→π*跃迁,从而产生了荧光[14]。
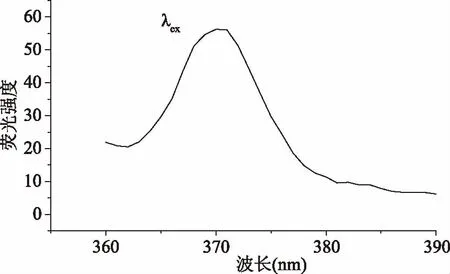
图2 直链淀粉激发光谱Fig.2 Excitation spectrum of amylose
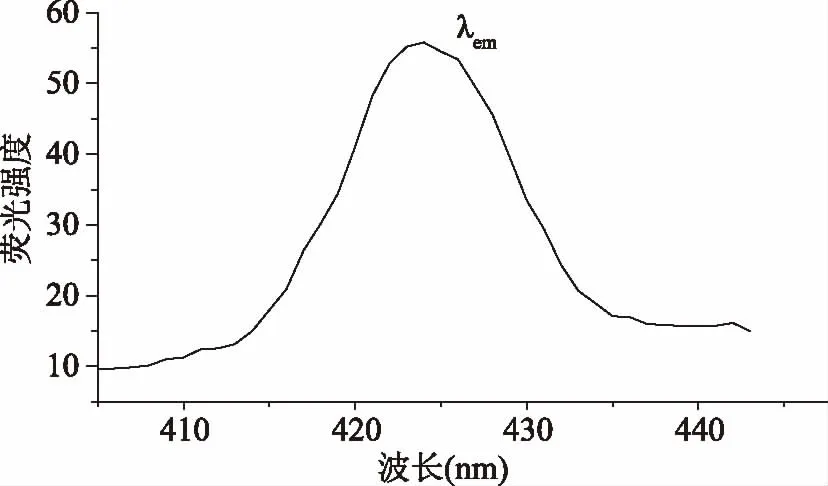
图3 直链淀粉发射光谱Fig.3 Emission spectrum of amylose
2.3 溶液放置时间的确定
按照1.2.4测定方法,测定放置时间对溶液荧光强度的影响,结果见图4。由图4可知,随着放置时间的延长,溶液的荧光强度无明显变化,因此,本试验采用即测即配溶液的方法。
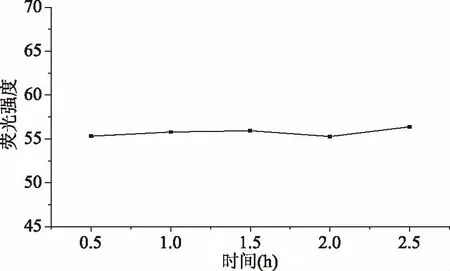
图4 放置时间对荧光强度的影响Fig.4 Effect of placement time on luorescence intensity
2.4 测定温度的确定
按照1.2.5测定方法,测定温度对荧光强度的影响,结果如图5所示。由图5可知,随着温度的增大,在32 ℃之前淀粉的荧光强度呈上升趋势,32 ℃到44 ℃呈下降趋势,从48 ℃到56 ℃又在缓慢增加,但仍然小于32 ℃时的荧光,即32 ℃温度时荧光最大。因此,实验测定温度为32 ℃。其原因可能是32 ℃之前,随着温度的增加,直链淀粉中的C-O-C环醚键中的氧未共享电子更易发生n→π*跃迁,使荧光强度最大,随着温度继续升高,光化分解的发生荧光量子产率减小,荧光淬灭。荧光强度减小。
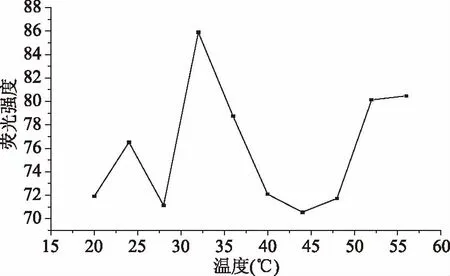
图5 温度对荧光强度的影响Fig.5 Effect of temperature on florescence intensity
2.5 干扰试验
因为淀粉脱脂后的主要成分是直链淀粉和支链淀粉,因此,本试验分别测定了支链淀粉对直链淀粉含量测定的干扰情况。
直链淀粉与支链淀粉不同的浓度比对荧光强度的影响如图6所示。由图6可知,在固定浓度的直链淀粉混合溶液中,随着支链淀粉浓度比例的增大,荧光强度数值基本不变,说明支链淀粉的存在基本不影响直链淀粉含量的测定,这与文献[14]的结果也是吻合的。
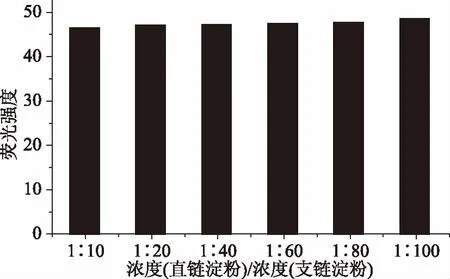
图6 支链淀粉和直链淀粉的浓度比对荧光强度的影响Fig.6 Effect of concentration ratio of amylopectin and amylose on fluorescence intensity
2.6 方法检出限的计算
按照1.2.7测定方法,测定10份浓度为0.10 μg/mL的直链淀粉溶液的荧光强度,计算得标准偏差为s=0.233,按照1.2.7检出限计算公式计算得方法检出限CL为0.026 μg/mL。
2.7 加标回收率和相对标准偏差的测定
按照1.2.8试验方法,分别对0.20,0.40,0.60 μg/mL 3个水平做回收率试验。平行测定6次。并根据2.1线性回归方程计算直链淀粉含量和加标回收率。结果见表1。
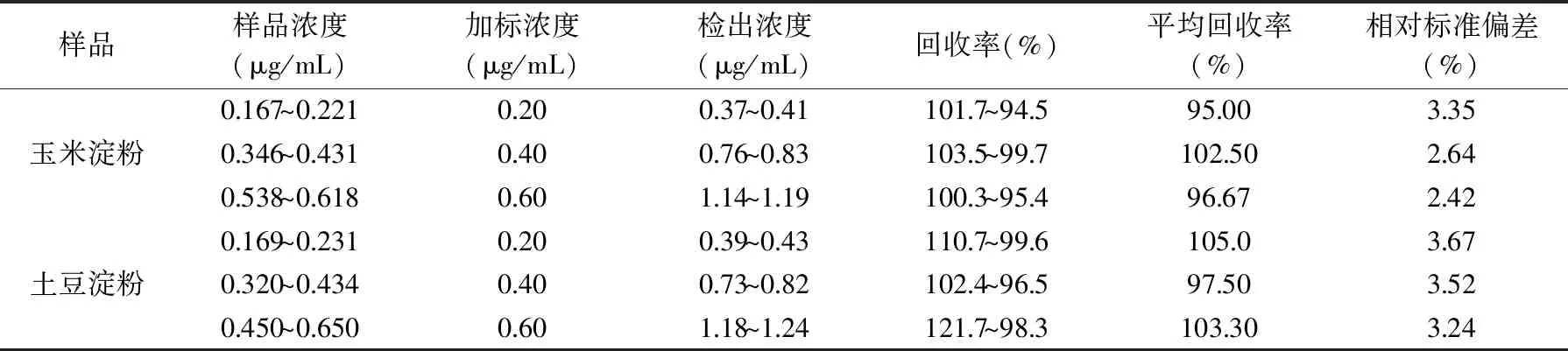
表1 加标回收试验结果Table 1 Results of recovery experiment
由表1可知,样品的回收率分别为94.5%~121.7%,相对标准偏差为2.42%~3.24%,说明该方法准确度和精密度均好。
2.8 荧光光谱法与国标法的比较分析
根据2.1线性回归方程计算直链淀粉在原淀粉中所占的百分含量和相对标准偏差;参照国标GB 7648-1987分析方法[15]测定的结果见表2。
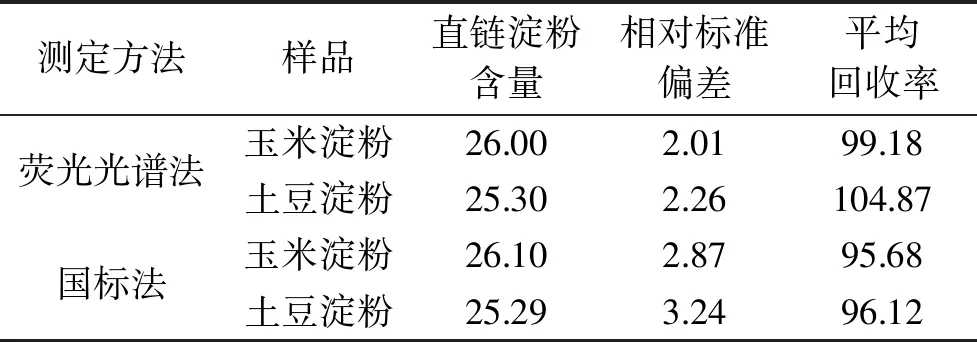
表2 样品中直链淀粉含量测定结果(n=6,%)Table 2 Determination results of amylose content in the sample(n=6,%)
由表1数据得出玉米淀粉与土豆淀粉的平均回收率均优于国标分析法,说明对于玉米淀粉与土豆淀粉,荧光光谱法的精密度比单波长分光光度法的精密度高。不管是玉米淀粉还是土豆淀粉,荧光光谱法的相对标准偏差均比国标GB 7648-1987分析方法的相对标准偏差小,说明荧光光谱法的准确度比国标GB 7648-1987分析方法准确度高,其原因可能与国标GB 7648-1987分析方法的原理有关,国标法的原理是淀粉与碘形成碘-淀粉复合物的过程有特殊的颜色反应,支链淀粉与碘生成棕红色复合物,直链淀粉与碘生成深蓝色复合物,在淀粉总量不变的条件下,将这两种淀粉分散液按不同比例混合,在一定的波长和酸度条件下与碘作用,生成由紫红到深蓝的一系列颜色,根据吸光度与直链淀粉浓度呈线性关系,可用分光光度计进行测定。在这个过程中,两种颜色的相互影响,可能会造成其中每种颜色吸光度测定的不准确,从而导致测算的精密度和准确度较差。
3 结论
本试验以超市购买的玉米淀粉、土豆淀粉为样品,应用荧光光谱分析技术建立了荧光光谱法测定淀粉中直链淀粉的方法。用该方法测定淀粉中的直链淀粉,不需要任何化学试剂,直接测定淀粉溶液的荧光强度即可,方法简单、快速,为淀粉及淀粉食品或淀粉材料中直链淀粉的测定提供了一种准确、灵敏的方法。
