原位水解/熔融扩散法制备钛酸锂/硫复合正极及其在全固态锂电池中的应用
2019-04-15杜英李劼刘晋
杜英,李劼,刘晋
原位水解/熔融扩散法制备钛酸锂/硫复合正极及其在全固态锂电池中的应用
杜英,李劼,刘晋
(中南大学 冶金与环境学院,湖南 长沙,410083)
利用原位水解和熔融扩散技术制备钛酸锂/硫(LTO/S)复合材料,并以该复合材料为正极、金属锂为负极,结合PEO基聚合物固体电解质组装全固态锂电池。研究结果表明,电池充放电过程中钛酸锂和硫作为正极活性物质均提供了高容量,电池循环稳定性也得到了显著提高;当复合正极中钛酸锂与硫质量比为1:3、活性物质质量分数为80%时,电池的容量发挥和循环稳定性同时达到最佳;在60 ℃和0.2测试条件下,循环100圈后电池比容量保持在801 mA∙h/g,库仑效率达到99%。
全固态锂电池;钛酸锂/硫复合正极;聚合物固体电解质;穿梭效应
单质硫不仅有较高的理论比容量(1 672 mA∙h/g),而且具有储量丰富、成本低廉等优点,是下一代高能量密度锂硫电池的正极材料[1−2]。然而,硫及其放电产物Li2S和Li2S2存在低电子导电性、多硫化物在液态电解液中穿梭效应等缺点,制约了锂硫电池容量的发挥[3−4]。通过加入各类载体材料,如导电碳材料[5−8]、导电聚合物[9−11]、金属化合物[12−14 ]等对硫正极进行改性,锂硫电池性能得到了一定程度的改善。然而,这些载体材料不仅不能提供电池容量,而且极大地降低了电极活性物质的装载量,导致锂硫电池的能量密度显著降低。传统的锂离子电池正极材料具有导电性良好、容量发挥稳定的优点,但是理论比容量偏低(<300 mA∙h/g),不能满足未来动力以及储能系统的需求[15−16]。尖晶型钛酸锂(LTO)作为一种常见的锂离子电极材料,理论比容量为175 mA∙h/g,锂离子脱嵌电位为1.55 V,充放电过程体积变化率几乎为零,具有良好的循环稳定性[17−19]。在锂硫电池中,钛酸锂具有束缚多硫化物穿梭的能力[20−21]。例如,ZHAO等[20]通过磁控溅射的方法在硫正极与隔膜之间加了一层致密钛酸锂−石墨烯夹层,起到了束缚多硫化物的作用,改善了电池的电化学性能。ZENG等[21]通过将掺杂TiO2的中空碳球放入含Li+的水溶液中进行水热反应合成中空碳球−钛酸锂载体材料,通过熔融扩散的方法与硫结合得到中空碳球−钛酸锂/硫复合正极材料,结合醚类电解液组装得到液态锂硫电池。这些研究将钛酸锂看作为“零应变”的快离子导体用于硫正极,通过增强正极的锂离子导电性来提高电池的倍率性能。然而,从电池的充放电平台和循环伏安检测结果可以看出,钛酸锂作为活性物质并未提高电池容量,仍然只是一种电极添加剂,硫才是电池容量的来源。将低理论容量的锂离子电极材料与高理论容量的硫相结合,能够获得2种电极材料共同的容量贡献。例如,MING等[22]在以醚类电解液的磷酸铁锂电池中,通过加入多硫化锂,电池首圈比容量为330 mA∙h/g,其中多硫化锂提供了160 mA∙h/g比容量(约为硫理论比容量的10%),电池的容量发挥仍然以磷酸铁锂为主,硫的高容量优势未被利用。循环500圈后电池比容量衰减到145 mA∙h/g。从充放电平台可以看出,此时多硫化物的比容量几乎为0 mA∙h/g。鉴于此,本文作者利用原位水解和熔融扩散技术制备钛酸锂/硫(LTO/S)复合材料,活性物质质量分数可达80%,其中,硫为容量的主要提供者,钛酸锂作为辅助活性材料提供了部分比容量。以该复合材料为正极,MIL-53(Al)改性的PEO基固体电解质[23]为电解质,锂为负极,组装成全固态锂电池,通过循环伏安和恒流充放电实验研究该电池体系的电化学性能,为新能源汽车动力电池及储能系统提供了一种全新的锂电池体系。
1 实验
1.1 硫复合正极材料的制备
1.1.1 碳纳米管−钛酸锂复合材料的制备
将20 mg 商业碳纳米管(CNT,外径10~20 nm,长度50 μm) 超声分散在100 mL无水乙醇(分析纯,+99.5%)中形成CNT悬浊分散液,加入LiOH水溶液搅拌均匀得到母液。升温至80 ℃后,按Li与Ti的物质的量比4:5配制30 mL TiO(C4H9)4酒精溶液并逐滴加入快速搅拌的母液中,充分反应后,于60 ℃下蒸干溶剂,在氩气气氛下以5 ℃/min 的升温速率升至800 ℃保温烧结2 h,得到碳纳米管−钛酸锂复合材料 (CNT-LTO)。
1.1.2 碳纳米管−钛酸锂/硫正极材料的制备
将S/CS2溶液(10 mg/mL)滴入一定量的CNT-LTO中,常温下蒸干溶剂,转移到管式炉中155 ℃氩气气氛下烧结20 h,得到碳纳米管−钛酸锂/硫复合正极材料。调节LiOH,TiO(C4H9)4和S的质量比,得到不同CNT,LTO与S质量比的正极材料。
1.2 结构和形貌的表征
利用Rigaku/TTR-III型X线衍射仪(XRD) (40 kV, 15 mA, Cu K)对样品物相进行检测,2扫描范围为10°~80°,扫描速率为5 (°)/min。采用荷兰FEI公司的S−4800场发射扫描电镜(SEM)对样品形貌进行检测,采用EDAX公司的OXFORD-ISIS300能谱仪(EDS)对碳纳米管−钛酸锂/硫正极材料进行表面元素含量分析。采用热重分析仪(SDTQ600)测定样品在氩气或空气中的热重(TGA)曲线,确定样品中硫和钛酸锂的含量,检测温度范围为室温至800 ℃,升温速率为10 ℃/min。
1.3 电化学性能测试
将复合材料、导电碳(Super P)和聚丙烯酸(PAA)按质量比8:1:1加入到研钵中,干磨0.5 h后加入适量N-甲基吡咯烷酮(NMP,分析纯,阿拉丁试剂(上海)有限公司生产)充分研磨均匀后用刮刀将浆料均匀涂覆在铝箔上,在50 ℃烘箱中干燥24 h,制得正极极片,涂布物质含量约为1.0 mg/cm2。将烘干后的极片冲成直径为10 mm的小圆片作为电池的正极,在高纯氩气氛的手套箱中,锂片作为负极,聚合物固体电解质作为电解质,组装成CR2025扣式电池,其中,MIL-(53)Al改性的PEO基聚合物固体电解质制备过程文献[23]。循环伏安和交流阻抗采用电化学工作站(PARSTAT 4000)检测,其中循环伏安扫描速度为 0.2 mA/s,电压范围为1.0~3.0 V,交流阻抗频率范围为10−1~105Hz,振幅为5 mV。电池的循环性能通过蓝电电池检测系统(CT2001A),充放电电压范围为1.0~3.0 V,电池的电化学检测均在60℃的烘箱中进行,烘箱温度误差在1 ℃以内。
2 结果与讨论
2.1 材料表征
图1所示为CNT与LTO质量比为1:1的正极材料以及CNT,LTO与S质量比1:1:3的正极材料、升华硫、CNT的XRD图谱及尖晶型钛酸锂的理论XRD图谱。由图1可见:CNT与LTO质量比为1:1的正极材料图谱的特征峰与尖晶型钛酸锂结构(PDF#72-0426) 的特征衍射峰位吻合,证明合成的钛酸锂为尖晶型钛酸锂结构;在26°左右处出现的小宽峰代表CNT与LTO质量比为1:1的正极材料中CNT的衍射峰,与CNT的衍射谱图相对应;CNT,LTO与S质量比为1:1:3的正极材料的XRD图谱在23.5°和28.0°处的衍射峰与标准谱图峰位吻合,表明通过蒸干溶剂/熔融扩散的方法制备的正极材料中的硫为斜方晶型[24]。
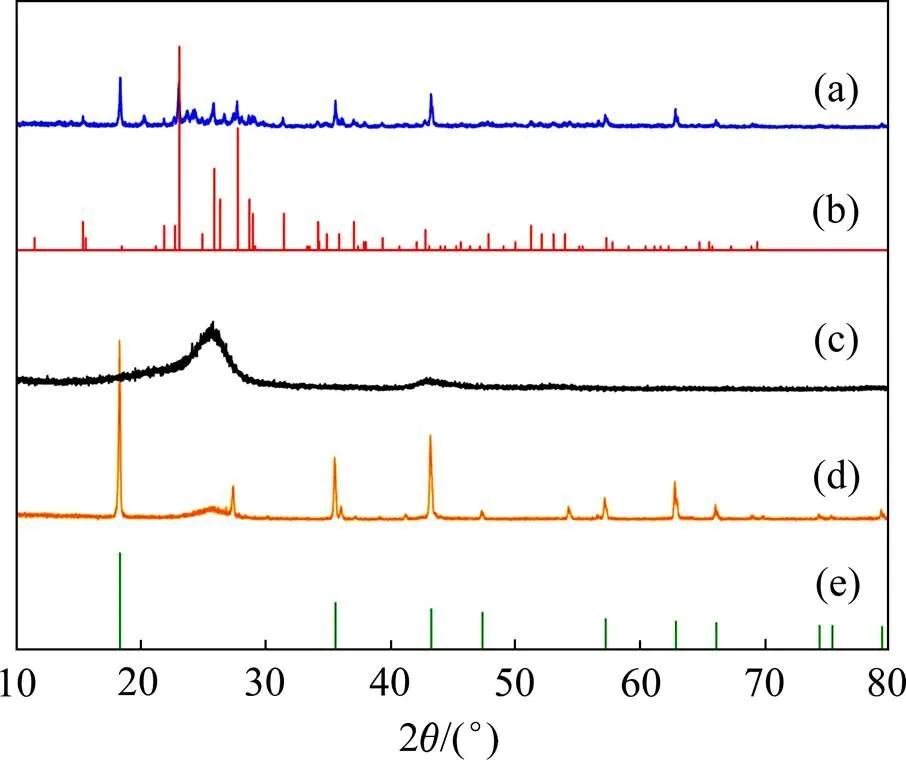
(a) CNT,LTO与S质量比为1:1:3正极材料;(b) 斜方晶型S8的标准PDF卡片;(c) CNT;(d) CNT与LTO质量比 1:1 正极材料;(e) 尖晶型钛酸锂的标准PDF卡片
复合正极材料的热重分析结果如图2所示。由图2可以看出:在氩气或空气气氛中,200~350 ℃内的质量损失为硫的损失;在空气气氛中,500~650 ℃的质量损失为CNT的损失。因此,可以计算出CNT,LTO与S质量比为1:1:3的正极材料中S的质量分数为58.8%,LTO质量分数为21.1%,活性物质总质量分数为79.9%。同时,作为对比材料,CNT与S质量比分别为1:4和2:3的正极材料中硫质量分数分别为76.5%和57.9%。其中,在100 ℃以下,CNT质量损失3.1%左右,可能是样品转移过程中吸附水分的 质量。
CNT与LTO质量比1:1正极材料以及CNT,LTO与S质量比为1:1:3的正极材料及碳纳米管的SEM微观形貌表征和mapping结果如图3所示。由图3(a)可见:商业的碳纳米管有严重的团聚现象,呈微米级的团聚球。通过原位水解合成,LTO与CNT交联在一起,CNT不存在团聚现象。CNT,LTO与S质量比为1:1:3正极材料中CNT,LTO和S三者均匀混合。由所选区域的表面元素扫描结果可知,碳元素来源于CNT,钛元素来源于LTO,硫元素来源于S。mapping结果再次证明复合正极材料中CNT,LTO和S实现了均匀分布。
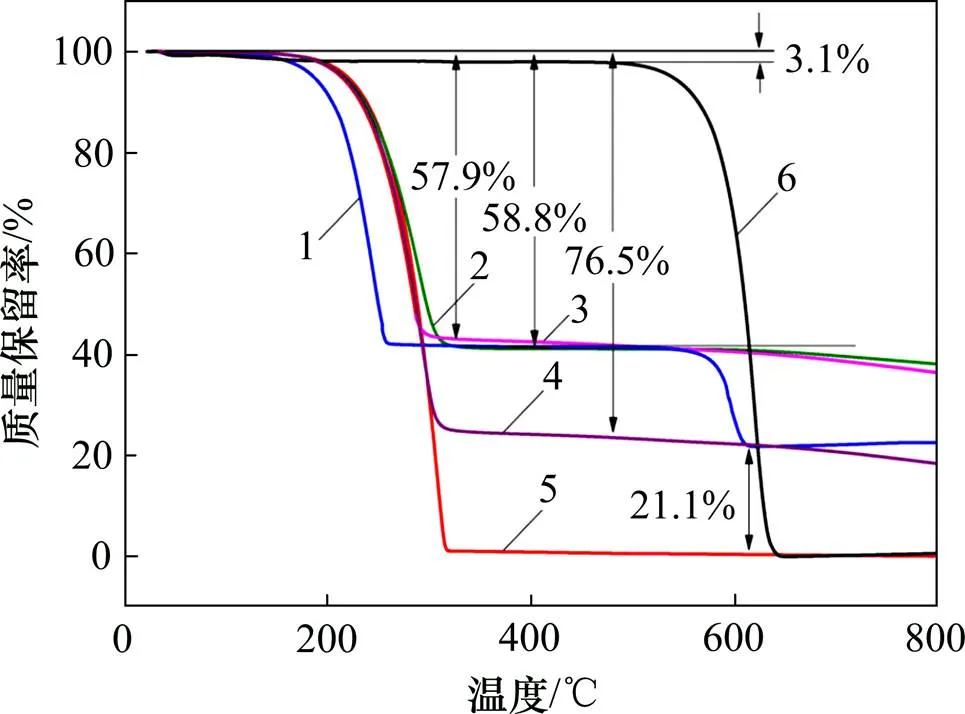
1—CNT,LTO与S质量比为1:1:3正极材料(空气);2—CNT,LTO与S质量比为1:1:3正极材料(氩气);3—CNT与S质量比为2:3正极材料(氩气);4—CNT与S质量比为1:4正极材料(氩气);5—升华硫(氩气);6—CNT(空气)。
2.2 电池的电化学检测
图4所示为由CNT,LTO与S质量比为1:1:3的正极材料、CNT与S质量比为1:4的正极材料和CNT与LTO质量比为1:4的正极材料分别组装的电池的循环伏安曲线以及充放电平台检测结果。从图4(a)可以看出,CNT,LTO与S质量比为1:1:3的电池的循环伏安曲线有3个还原峰和2个氧化峰,其中,还原峰分别在2.42,1.98和1.52 V附近。在2.42 V左右处的还原峰对应于S8或高价态的长链多硫化物Li2S(4<<8)还原成低价多硫化物Li2S4的过程;在1.98 V左右处,峰面积较大的还原峰对应于Li2S4还原成Li2S2或Li2S的过程[25];在1.52 V左右处的还原峰代表正极材料中锂离子嵌入钛酸锂的过程[18]。上述3个还原峰分别对应于电池循环过程(图4(d))中2.40~2.45 V,1.95~2.5 V和1.50~1.55 V的放电平台。另外,2个氧化峰分别在1.58 V和2.48 V处,分别对应锂离子从钛酸锂脱出及Li2S2或Li2S氧化回到多硫化物Li2S(4<<8)或S8的过程[25−26],对应于充电过程(图4(d))中1.55~1.60 V,2.10 V左右和2.50 V左右的3个平台,其中2.10 V和2.50 V左右的充电平台对应2.48 V左右的宽峰。实验结果证明:复合正极材料中硫和钛酸锂都作为活性物质贡献了电池容量。

(a) 未经处理的碳纳米管;(b) CNT与LTO质量比为1:1正极材料;(c),(d) CNT,LTO与S质量比为1:1:3正极材料;(e) 碳表面元素分析;(f) 钛表面元素分析;(g) 硫表面元素分析
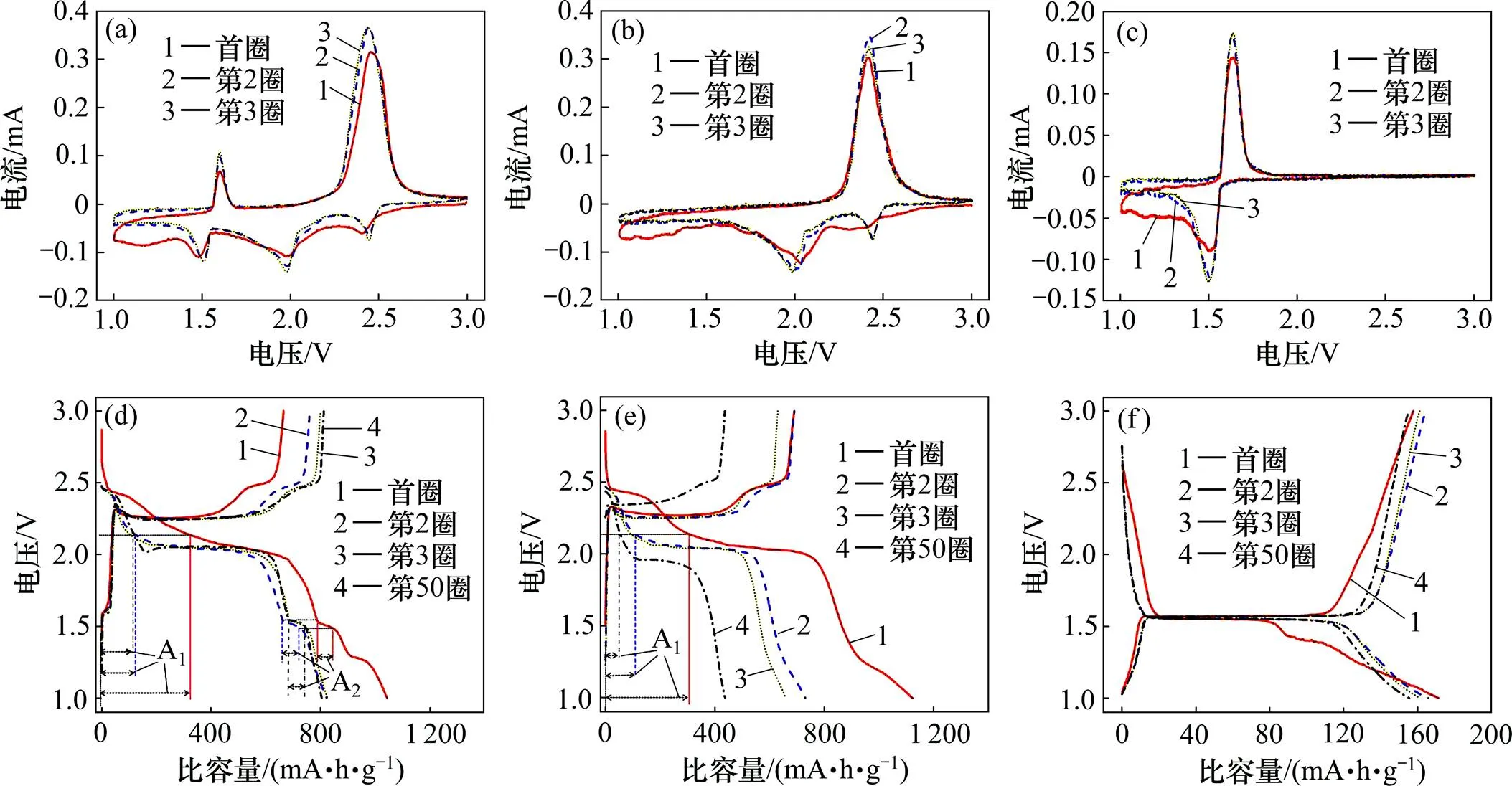
(a) CNT,LTO与S质量比为1:1:3,循环伏安曲线;(b) CNT与S质量比为1:4,循环伏安曲线;(c) CNT与LTO质量比为1:4,循环伏安曲线;(d) CNT,LTO与S质量比为1:1:3,充放电平台曲线;(e) CNT与S质量比为1:4,充放电平台曲线;(f) CNT与LTO质量比为1:4,充放电平台曲线
A1—S8/Li2S(4<<8)至Li2S4阶段的放电比容量;A2—钛酸锂的放电比容量。
图4 电池的正极循环伏安曲线和充放电平台曲线
Fig. 4 Cyclic voltammograms and discharge/charge curves of batteries
由CNT与S质量比和CNT与LTO质量比均为1:4的2个电池的循环伏安曲线都显示为典型的硫和钛酸锂正极的循环伏安及电压平台曲线。结果表明:S和LTO的容量发挥为独立进行,在循环过程中S,Li2S(1<<8)和LTO之间没有发生化学反应。
因此,电池体系电化学反应的方程式如下。
放电过程:
S8+4Li++4e−→2Li2S4(≥2.15 V),
Li2S4+2Li++2e−→2Li2S2,
Li2S2+2Li++2e−→2Li2S (1.98 V左右),
Li4Ti5O12+Li++e−→Li5Ti5O12(≤1.55 V);
充电过程:
Li5Ti5O12→e−+Li++Li4Ti5O12(≥1.55 V),
2Li2S→Li2S2+2Li++2e−,
2Li2S2→Li2S4+2Li++2e−(1.98 V左右),
2Li2S4→S8+4Li++4e−(≥2.15 V)。
由上述电化学反应方程可得复合正极材料的理论比容量为
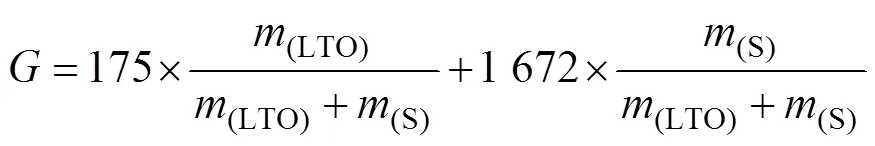
式中:为理论比容量,mA∙h/g;(LTO)和(S)分别为LTO和S的质量分数。
通过对比研究S8或高价态的长链多硫化物Li2S(4<<8)还原成低价多硫化物Li2S4的容量保持率,进一步分析钛酸锂对多硫化物的束缚作用,结果如图4(d),(e)所示。对图4(d)和(e),在电压2.15 V处作平行于轴的直线,直线交电压平台曲线所在点对应的比容量为S8或高价态的长链多硫化物Li2S(4<<8)还原成低价多硫化物Li2S4的容量贡献。对图4(d)在电压1.48 V和1.53 V处分别作平行于轴的直线,1.48 V和1.53 V处直线交电压平台曲线所在点对应的比容量差值为钛酸锂的放电容量,结果见表1。
由表1可得:CNT,LTO与S质量比为1:1:3和CNT与S质量比为1:4的电池首圈放电过程中存在多硫化物的不可逆流失;CNT,LTO与S质量比为1:1:3的电池第2圈对应于S8或高价态的长链多硫化物Li2S(4<<8)还原成低价多硫化物Li2S4的比容量贡献为121.2 mA∙h/g,循环50圈后仍保持了118.1 mA∙h/g的比容量,与第2圈相比,这一电化学过程的比容量保持率高达97.4%,而CNT与S质量比为1:4的电池在这一电化学过程的比容量保持率仅为60.7%(由111.4 mA∙h/g降至67.7 mA∙h/g)。这说明钛酸锂在正极中有效地束缚了多硫化物的流失,提高了电池的比容量发挥程度和循环稳定性。另外,在复合正极中钛酸锂比容量发挥稳定,前50圈循环比容量保持率高达90.4%(由51.1 mA∙h/g降至46.2 mA∙h/g)。上述数据表明,钛酸锂在复合正极中不仅稳定提高比容量,而且束缚多硫化物,减少穿梭效应,大大提高了硫比容量的稳定发挥。
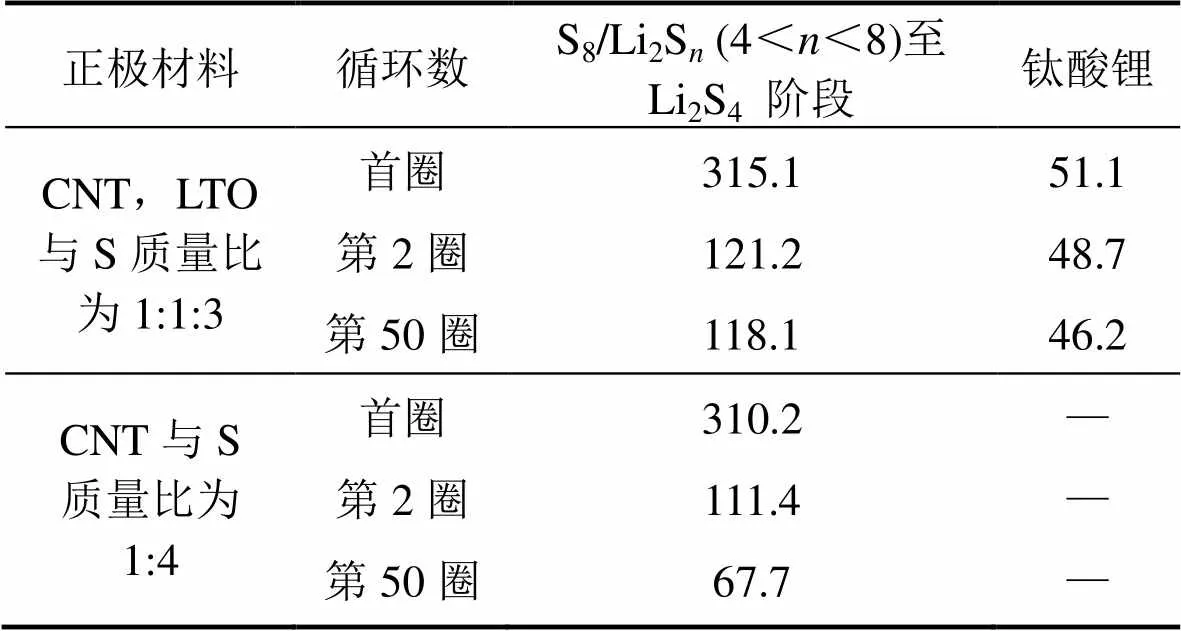
表1 电池首圈、第2圈和第50圈循环S8或高价态的长链多硫化物Li2Sn(4<n<8)还原成低价多硫化物Li2S4和钛酸锂的比容量
为了研究正极材料中CNT,LTO和S的最佳比例,通过调节LiOH,TiO(C4H9)4和S的质量比,配置6种CNT,LTO与S质量比分别为2:1:7,1:1:3,1:2:2,1:3:1,1:2:6和3:2:6的复合正极材料。由式(1)可得这6种不同比例正极材料的理论比容量分别为1 485, 1 297,924,549,1 297和1 297 mA∙h/g,活性物质质量分数为S和LTO的质量分数之和。
以此复合材料为正极,结合聚合物固体电解质和锂片组装成全固态锂电池,在60 ℃, 0.2充放电倍率下进行循环性能检测,结果如图5所示。保证CNT的质量分数为20%的条件下,当CNT,LTO与S的质量比2:1:7时,电池的容量发挥最大,其首圈放电比容量为 1 367 mA∙h/g,然而,电池存在一个较快的容量衰减过程,在50圈后只保持了490 mA∙h/g的比容量,与首圈比容量相比,比容量保持率仅为35.8%。当CNT,LTO与S的质量比为 1:1:3时,电池首圈放电比容量为1 067.2 mA∙h/g,50圈后还保持了815 mA∙h/g的比容量,比容量保持率为76.4%,电池循环容量发挥及循环稳定性达到最佳。保持LTO与S质量比为1:3不变,当CNT质量分数为10%时(即CNT,LTO与S的质量比为 1:2:6),由于正极的导电性下降,电池的容量发挥和循环稳定性降低,其首圈放电比容量为1 091 mA∙h/g,50圈后仅保留了688 mA∙h/g的比容量,其比容量保持率为63.1%;而当CNT质量分数为30%时(即CNT,LTO与S的质量比为 3:2:6),电池的循环性能与CNT,LTO与S的质量比为1:1:3的基本相当;CNT,LTO与S的质量比分别为 1:2:2和1:3:1的电池具有良好的循环稳定性,但是其理论比容量偏低,循环50圈后分别还保持了508.4 mA∙h/g和214.6 mA∙h/g的比容量。由此可知CNT,LTO和S的最佳质量比为 1:1:3。
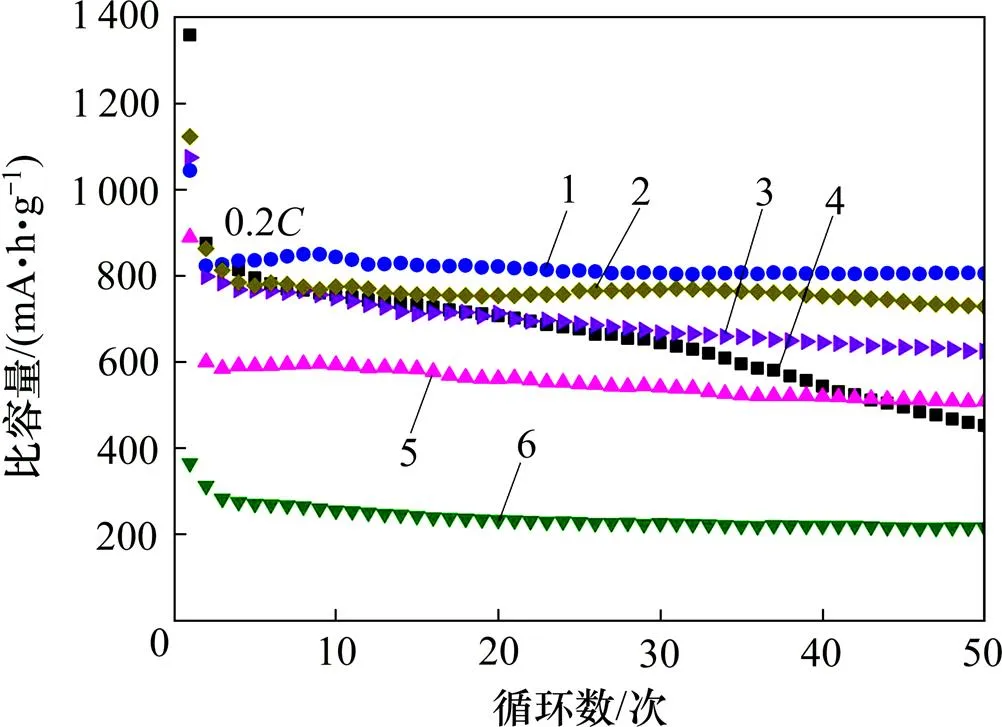
CNT/LTO/S质量比:1—1:1:3;2—3:2:6;3—1:2:6;4—2:1:7;5—1:2:2;6—1:3:1。
选择CNT,LTO与S质量比为1:1:3的复合正极材料为研究对象,分别与CNT与S质量比分别为1:4和2:3以及CNT与LTO质量比为1:4的复合正极材料进行对比,研究复合正极材料中LTO对电池循环性能的影响(见图6)。由图6可知:在充放电倍率为0.2时,CNT与LTO质量比为1:4的CNT-LTO正极材料的电池的首圈放电比容量为171 mA∙h/g,循环100圈后仍保留了153 mA∙h/g的比容量(图6(a));0.5放电倍率下,循环200圈后仍保留了112 mA∙h/g的比容量(图6(c));倍率回复性良好(图6(b)),证明合成的CNT-LTO正极材料为电化学循环稳定的锂离子电极材料,与循环伏安检测结果一致(图4(c))。由图6(a)可见:在0.2充放电倍率下,CNT,LTO与S质量比为1:1:3的电池首圈放电比容量为1 067.2 mA∙h/g;循环100圈后,放电比容量稳定在 801 mA∙h/g,平均每圈容量损失率仅为0.25%;此外,CNT与S质量比为2:3和1:4电池首圈放电比容量分别为1 265和1 123 mA∙h/g,循环100圈后的比容量分别为436.5和395 mA∙h/g,平均每圈容量损失率达到0.65%和0.64%。
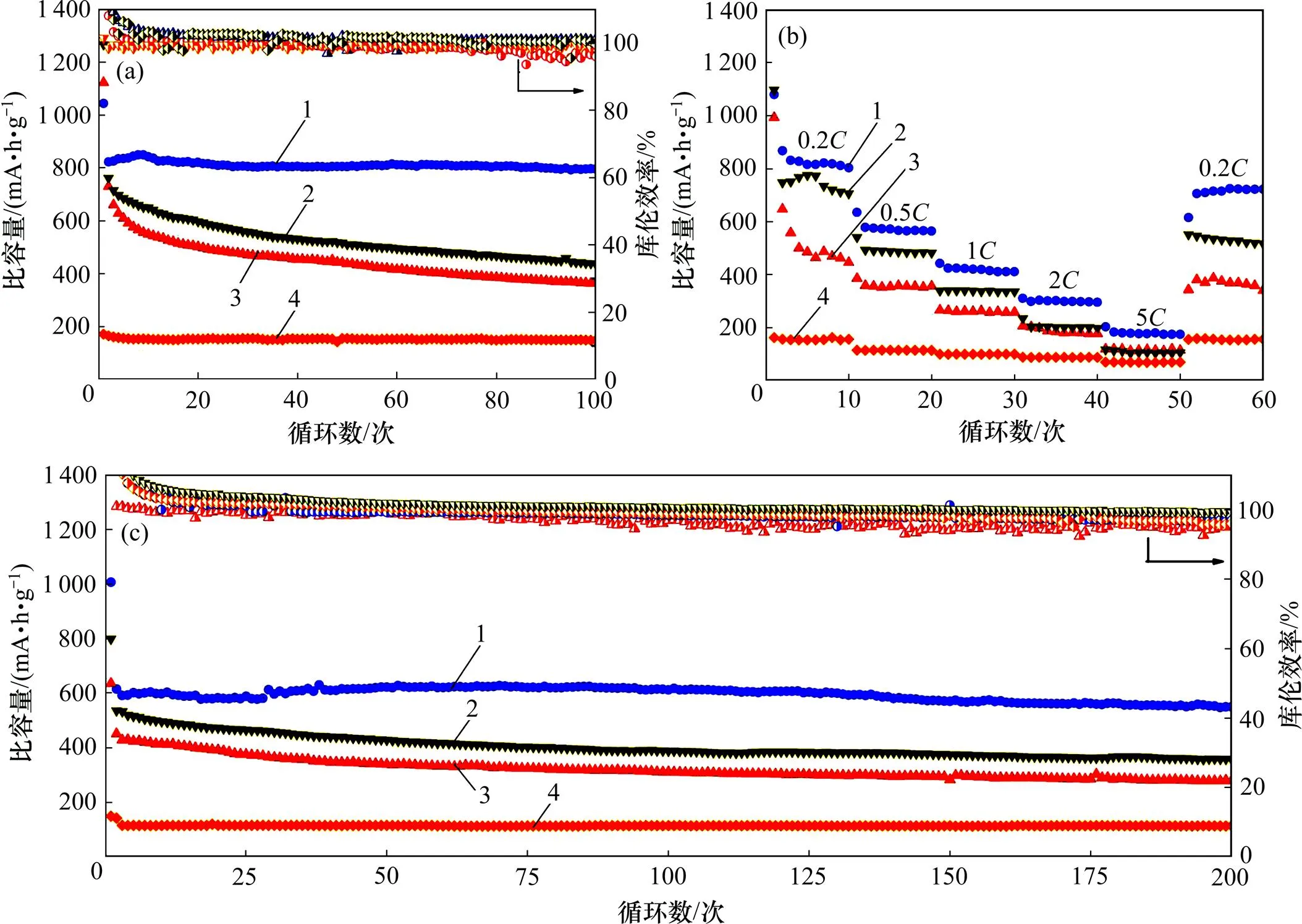
充放电倍率:(a) 0.2C;(b) 0.2C—5C—0.2C;(c) 0.5C
图6(b)所示为电池从0.2逐步提升至5再回到0.2的倍率回复性能检测结果。由图6(b)可知:在0.2倍率下,CNT,LTO与S质量比 1:1:3电池的放电比容量稳定在805 mA∙h/g,比CNT与S质量比分别为 2:3和1:4电池的放电比容量高85 mA∙h/g和 372 mA∙h/g;随着放电倍率的增加,电池的放电容量呈逐步下降的趋势,CNT与S质量比分别为2:3和1:4的2种电池的容量贡献差距逐渐减小;当倍率为5时,CNT与S质量比分别为 2:3和1:4的2种电池的比容量发挥基本相同(104±5.8 mA∙h/g),而CNT,LTO与S质量比为1:1:3电池仍然保留了180.1 mA∙h/g的比容量。这是因为钛酸锂不仅作为一种快离子导体,提高了正极的导锂离子能力,有利于电池高倍率充放电条件下容量的发挥[21],而且钛酸锂作为活性物质提供了容量。CNT,LTO与S质量比为1:1:3电池经过高倍率循环回到0.2仍然有722 mA∙h/g比容量。与CNT与S质量比分别为2:3 (563.5 mA∙h/g)和1:4 (380.4 mA∙h/g)电池相比,可得钛酸锂的掺杂大大提升了电池的倍率回复性能。
图6(c)所示为电池在0.5倍率下的长循环检测结果,CNT,LTO与S质量比为1:1:3首圈放电比容量为1 006.3 mA∙h/g,第2圈为614.3 mA∙h/g,循环 200圈后仍有548.9 mA∙h/g的比容量,平均每圈比容量损失率只有0.22%。CNT与S质量比为2:3和1:4的电池循环200圈后比容量仅分别为399 mA∙h/g和345 mA∙h/g。
对比CNT,LTO与S质量比为1:1:3和CNT与S质量比为2:3的2种电池可得:两者载硫量均为60%,前者理论比容量为1 297 mA∙h/g,活性物质质量分数为80%;后者理论比容量为1 672 mA∙h/g,活性物质质量分数为60%。但前者容量发挥和循环稳定性相比后者有极大提高,证明钛酸锂对于电池的能量密度和循环稳定性起到了明显的改善作用。
为了研究充放电过程中正极与电解质界面的变化,对比CNT,LTO与S质量比为1:1:3电池在放电前和0.2下循环20圈后正极材料的形貌变化,结果如图7所示。
由图7(a)可得:正极极片存在较大的孔隙以应对硫充放电过程中的体积变化,且正极材料和导电碳通过黏结剂连在一起。从图7(b)可以看出:经过20圈的循环后,固体电解质与正极交融在一起,证明随着循环的进行聚合物固体电解质逐渐与正极融合,提高了正极电解质界面的兼容性和稳定性。
将循环后的极片在乙腈溶剂中浸泡12 h后以除去其表面的固体电解质,处理后的电极形貌结果如图7(c)所示,与图7(a)对比可知,经过20圈循环后,正极的颗粒粒径减小,正极极片仍存在较大孔隙,且黏结在一起,极片结构稳定。证明极片循环后结构稳定,保证了电池的电化学稳定性。
为了进一步研究电池在循环过程中界面阻抗的动力学演化对电池电化学性能的影响,对CNT,LTO与S质量比为1:1:3和CNT与S质量比为1:4 的2种电池进行交流阻抗检测。图8所示为电池0.2下循环前后的交流阻抗谱图,其中点为实测阻抗,线为通过图中的电路拟合得到的结果。由图8可知:拟合电路所得阻抗与实测阻抗相符。

(a) 循环前;(b)循环20圈,表面处理前;(c) 循环20圈,表面处理后
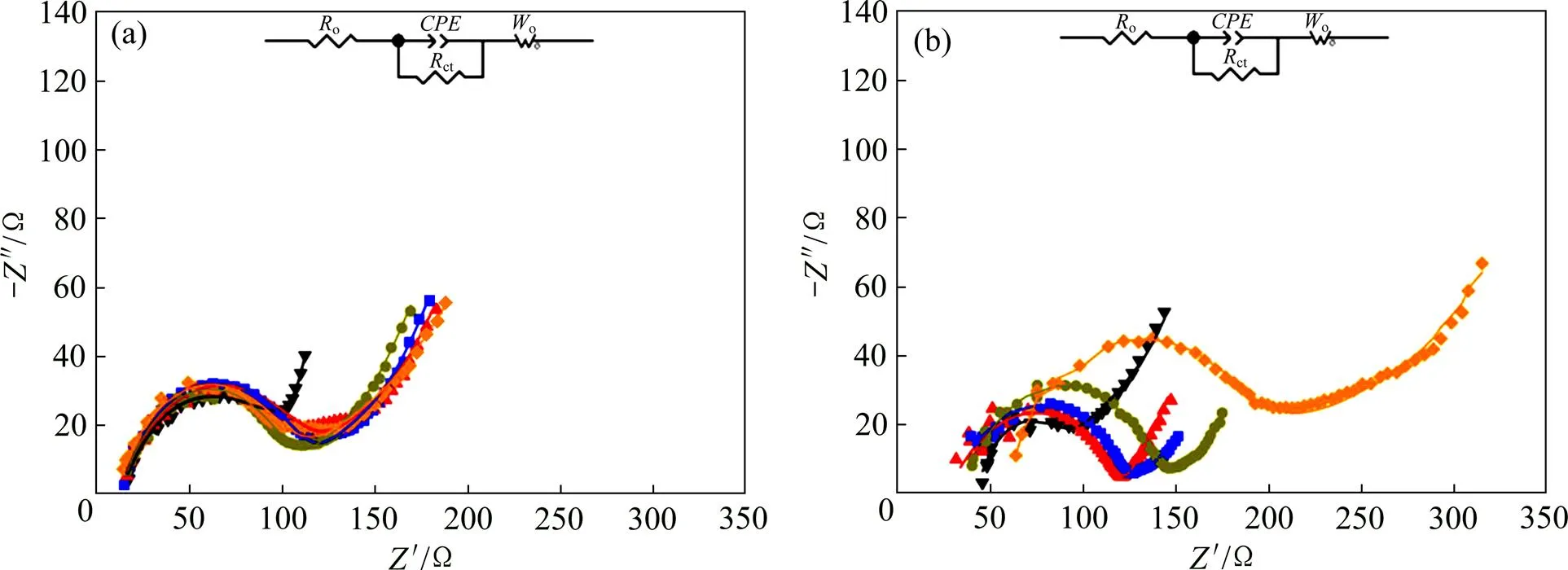
(a) CNT,LTO与S质量比为1:1:3;(b) CNT与S质量比为1:4
由图8还可见:高频区与实轴的截距为电池的本体阻抗o,2种电池的交流阻抗谱图均由高频区的近似半圆和低频区的1条倾斜直线组成,近似半圆的直径为电荷转移阻抗ct,斜线对应的是锂离子扩散进入材料内部的Warburg阻抗[26−27];CNT,LTO与S质量比为1:1:3的电池循环前、循环首圈、2圈、3圈和50圈后o分别为 12.56,11.75,12.85,12.09和7.187 Ω;ct分别为70.97,92.97,76.57,84.73和82.9 Ω;随着循环次数的增加,o逐渐减小并趋于稳定,这是由于循环前正极与电解质接触不好,随着循环次数增加,正极与固体电解质界面逐渐相容至最佳状态。在循环过程中,ct基本保持不变,同时低频区倾斜直线的斜率也基本不变,表明电池在充放电过程中正极与固体电解质间的界面稳定,电池的电化学性能稳定。
图8(b)所示为CNT与S质量比为1:4电池充放电过程中的交流阻抗谱图。由图8(b)可得:电池循环前、循环首圈、2圈、3圈和50圈后o分别为 41.83,27.87,29.27,34.48 和48.37 Ω;ct分别为35.91,95.23,95.12,107.6和121.2 Ω。可见:随着循环次数的增加,o和ct不断增大;同时,低频区的倾斜直线的斜率逐渐降低,表明锂离子扩散进入正极材料内部的Warburg阻抗增加[22]。随着循环次数的增加,正极中多硫化物的不均匀沉积于正极与固体电解质界面,导致了该电池的正极与固体电解质的界面不稳定。该交流阻抗结果与循环伏安结果和循环性能结果相符。
3 结论
1) 通过原位水解、溶剂挥发和熔融扩散方法制备了钛酸锂/硫复合正极材料,结合PEO基聚合物固体电解质,组装成全固态锂电池,为硫与传统锂离子电极材料结合提供了借鉴意义,为未来动力电池及储能系统的发展提供了一种高安全、高能量密度全固态锂电池体系。
2) 原位水解合成的钛酸锂为尖晶型结构且与碳纳米管交联,碳纳米管没有团聚现象,硫均匀分散在正极材料中。
3) 在充放电过程中,钛酸锂提供了容量,提高了正极活性物质含量,同时束缚多硫化物,减小穿梭效应,有利于硫容量的保持和稳定发挥。
[1] WHITTINGHAM M S. Lithium batteries and cathode materials[J]. Chemical Reviews, 2004, 104(10): 4271−4301.
[2] ARUMUGANUM S, FU Yongzhu, AMINE K, et al. Rechargeable lithium-sulfur batteries[J]. Chemcial Reviews, 2014, 114(23): 11751−11787.
[3] LIU Xue, HUANG Jiaqi, MAI Liqiang, et al. Nanostructured metal oxides and sulfides for lithium-sulfur batteries[J]. Advanced Materials, 2017, 29(20): 1601759−1601783.
[4] ZHANG Linlin, WAN Fang, WANG Yijing, et al. Dual-functional graphene carbon as polysulfide trapper for high-performance lithium sulfur batteries[J]. ACS applied materials & interfaces, 2018, 10(6): 5594−5602.
[5] JI Xiulei, LEE K T, LINDA F N, et al. A highly ordered nanostructured carbon-sulphur cathode for lithium-sulphur batteries[J]. Nature Materials, 2009, 8(6): 500−506.
[6] LI Zhen, GUAN Buyuan, ZHANG Jintao, et al. A compact nanoconfined sulfur cathode for high-performance lithium-sulfur batteries[J]. Joule, 2017, 1(3): 576−587.
[7] YU Mingpeng, MA Junsheng, WANG Rongming. Atomic layer deposited TiO2on a nitrogen-doped graphene/sulfur electrode for high performance lithium-sulfur batteries[J]. Energy Environment Science, 2016, 9(4): 1495−1503.
[8] SUN Zhenhua, ZHANG Jingqi, CHENG Huiming, et al. Conductive porous vanadium nitride/graphene composite as chemical anchor of polysulfides for lithium-sulfur batteries[J]. Nature Communication, 2017, 8: 14627−14634.
[9] ZHU Pei, ZHU Jiadeng, ZHANG Xiangwu. In situ polymerization of nanostructured conductive polymer on 3D sulfur/carbon nanofiber composite network as cathode for high-performance lithium-sulfur batteries[J]. Advanced Materials Interfaces, 2018, 5(10): 1701598−1705606.
[10] LI Ge, WANG Xiaolei, CHEN Zhongwei, et al. Chemisorption of polysulfides through redox reactions with organic molecules for lithium–sulfur batteries[J]. Nature Communications, 2018, 9(1): 705−714.
[11] HONG Xiaoheng, JIN Jun, WEN Zhaoyin. A rGO–CNT aerogel covalently bonded with a nitrogen-rich polymer as a polysulfide adsorptive cathode for high sulfur loading lithium sulfur batteries[J]. Journal of Materials Chemistry A, 2017, 5(28): 14775−14782.
[12] SEH Zhiwei, LI Weiyang, CUI Yi, et al. Sulphur-TiO2yolk-shell nanoarchitecture with internal void space for long-cycle lithium-sulphur batteries[J]. nature communications, 2013, 4: 1331−1335
[13] CUI Zhiming, ZU Chenxi, ZHOU Weidong, et al. Mesoporous titanium nitride-enabled highly stable lithium-sulfur batteries[J]. Advanced Materials, 2016, 28(32): 6926−6931.
[14] HWANG J Y, KIM H M, SUN Y K, et al. Designing a high-performance lithium-sulfur batteries based on layered double hydroxides-carbon nanotubes composite cathode and a dual-functional graphene-polypropylene-Al2O3separator[J]. Advanced Functional Materials, 2018, 28(3): 1704294−1704305.
[15] 熊利芝, 六文萍, 何志强, 等. 锂离子导体包覆镍锰酸锂正极材料的制备及其电化学性能[J]. 中国有色金属学报, 2015, 25(7): 1911−1919. XIONG Lizhi, LIU Wenping, HE Zeqiang, et al. Preparation and electrochemical properties of lithium nickel manganese oxide cathode materials coating with lithium ion conductor[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(7): 1911−1919.
[16] 曹璇, 郭华军, 彭文杰, 等. 锂离子电池正极材料Li2FeSiO4的改性[J]. 中南大学学报(自然科学版), 2012, 43(1): 23−27. CAO Xuan, GUO Huajun, PENG Wenjie, et al. Modification of Li2FeSiO4cathode for lithium-ion batteries[J].Journal of Central South University(Science and Technology), 2012, 43(1): 23−27.
[17] SUN Li, KONG Weibang, WU Hengcai. Mesoporous Li4Ti5O12nanoclusters anchored on super-aligned carbon nanotubes as high performance electrodes for lithium ion batteries[J]. Nanoscale, 2016, 8(1): 617−625.
[18] WANG Yongqing, GU Lin, GUO Yuguo, et al. Rutile-TiO2Nanocoating for a high-rate Li4Ti5O12anode of a lithium-ion battery[J]. Journal of the American Chemical Society, 2012, 134(18): 7874−7879.
[19] ALEXANDROS V, NIEK J J, MARNIX W. Toward optimal performance and in-depth understanding of spinel Li4Ti5O12electrodes through phase field modeling[J]. Advanced Functional. Materials, 2018, 28(16): 1705992−1706009.
[20] ZHAO Yan, LIU Ming, YANG Quanhong. Dense coating of Li4Ti5O12and graphene mixture on the separator to produce long cycle life of lithium-sulfur battery[J]. Nano Energy, 2016, 30: 1−8.
[21] ZENG Tianbiao, HU Xuebu. Promotional role of Li4Ti5O12as polysulfide adsorbent and fast Li+conductor on electrochemical performances of sulfur cathode[J]. Journal of Power Sources, 2017, 359: 250−261.
[22] MING Jun, LI Mengliu, LI Lianjong. Redox species-based electrolytes for advanced rechargeable lithium ion batteries[J]. ACS Energy Letter, 2016, 1(3): 529−534.
[23] ZHU Kai, LIN Yue, LIU Jin. A fast charging/discharging all-solid-state lithium ion battery based on PEO-MIL-53(Al)- LiTFSI thin film electrolyte[J]. RSC Advances, 2014, 4(80): 42278−42284.
[24] YANG Zhizheng, WANG Huiyuan, LU Lun. Hierarchical TiO2spheres as highly efficient polysulfide host for lithium-sulfur batteries[J]. Scientific Reports, 2016, 6: 22990−22997.
[25] ZHANG Cheng, LIN Yue, LIU Jin. Improved lithium-ion and electrically conductive sulfur cathode for all-solid-state lithium–sulfur batteries[J]. RSC Advances, 2017, 7(31): 19231−19236.
[26] GAO Xianfeng, LI Jianyang, GUAN Dongsheng. A scalable graphene sulfur composite synthesis for rechargeable lithium batteries with good capacity and excellent columbic efficiency[J]. ACS applied materials & interfaces, 2014, 6(6): 4154−4159.
[27] ZHANG Zhian, LI Qiang, LAI Yangqing. Confine sulfur in polyaniline-decorated hollow carbon nanofiber hybrid nanostructure for lithium–sulfur batteries[J]. The Journal of Physical Chemistry C, 2014, 118(25): 13369−13376.
In-situ synthesis of Li4Ti5O12/S composite cathode by hydrolysis- melting diffusion method for all solid state lithium battery
DU Ying, LI Jie, LIU Jin
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
A composite cathode material consisting of Li4Ti5O12and S was in-situ synthesized by a hydrolysis-melting diffusion method. The cathode material was assembled into an all solid state lithium battery with PEO-based solid polymer electrolyte and lithium metal anode. The results show that both Li4Ti5O12and S provide high specific capacities during the charge/discharge process. In addition, the cycling stability of the battery is greatly improved. When the mass ratio of LTO to S is 1:3, and the mass fraction of the active materials (LTO and S) is 80% in the cathode, the capacity and cycling stability of the battery reach the maxima. After 100 cycles, the discharge capacity of 801 mA∙h/g is delivered with a coulombic efficiency of 99% at 60 ℃ and 0.2.
all solid state lithium battery; lithium titanate/sulfur composite cathode; solid polymer electrolyte; shuttle effect
TQ152
A
1672−7207(2019)03−0521−09
10.11817/j.issn.1672-7207.2019.03.004
2018−03−27;
2018−05−28
国家自然科学基金资助项目(51274239);中南大学研究生科研创新项目(2017zzts437) (Project(51274239) supported by the National Natural Science Foundation of China; Project(2017zzts437) supported by the Innovation-driven Plan of Central South University)
刘晋,博士,教授,从事表界面分析及全固态电池研究;Email:jinliu@csu.edu.cn
(编辑 赵俊)
