青鳉foxl2基因敲除突变体的构建与表型分析
2019-04-13周运迪吴星星赵海萍罗大极
周运迪,吴星星,赵海萍,罗大极
(1.武汉大学基础医学院,湖北 武汉 430072;2.中国科学院水生生物研究所 淡水生态与生物技术国家重点实验室,湖北 武汉 430072)
性腺分化(Gonadal differentiation)指动物性腺原基经一系列精确、程序化的发育,最终形成有生物学功能的精巢或卵巢的过程,是生命科学研究的核心问题,一直备受科研人员关注。鱼类有极为丰富的物种多样性和庞杂的性别决定方式,普遍存在显著的两性生长差异,生长是重要的经济性状,生殖是优良养殖品种培育和扩群应用的基础,由此鱼类的性别相关研究既关乎生长这一优良性状又关乎品种繁殖。因此,鱼类性腺分化与发育相关研究有深远的基础理论意义及广泛的应用前景。青鳉(Oryzias latipes)作为一种重要的模式鱼类,有胚胎发育易于观察、易于显微操作、适于基因编辑等特点。另外,青鳉属于XX/XY型性别决定类型的鱼类[1],是第1种已克隆与鉴定雄性性别决定基因的鱼类,其性别决定基因是DMY(也称dmrt1bY)基因[2-3],是研究性腺分化与发育的良好材料[4]。
FOXL2(Forkhead box L2)为Fox转录因子家族的重要成员[5-6]。最初,FOXL2基因在睑裂病/眼睑下垂/内眼角赘皮综合征(Blepharophimosis/ptosis/ epicanthus inversus syndrome,BPES)患者中被克隆,随后报道了部分BPES患者存在卵巢发育障碍[7-8],提示FOXL2基因在性腺发育中的功能。研究显示,敲除山羊Foxl2基因后突变动物的性腺会发生卵巢向精巢转变[9-10]。小鼠Foxl2缺失导致卵巢早衰,卵泡的维持和粒层细胞发育异常,以及Dmrt1和Sox9等精巢发育与功能维持关键基因表达上升[11-13]。越来越多的研究显示,Foxl2主要在哺乳动物的卵巢粒层细胞中表达,是卵巢分化和维持过程中的关键基因[14-15]。然而,foxl2基因在低等脊椎动物中的功能研究与相关机制研究尚少。受限于鱼类基因操作技术,较长一段时间曾难以深入研究鱼类中基因调控的分子机制,因此,青鳉foxl2基因研究主要集中在表达模式等方面[16-17]。
近年来,基因编辑技术发展迅猛,其中包括锌指核酸酶技术[18]、类转录激活因子效应物核酸酶技术[19]和规律成簇的间隔短回文重复序列基因编辑技术(Clustered regulatory interspaced short palindromic repeats/CRISPR-associated protein 9,CRISPR/Cas9),为基因功能研究提供了新方法[20]。其中,CRISPR/Cas9技术因操作简单、成本较低、敲除效率较高和靶位点选择性广等优点而广泛运用于各种动物基因编辑研究[21-23]。本研究用 CRISPR/Cas9技术敲除青鳉foxl2基因,建立青鳉foxl2基因突变体材料,为深入阐释foxl2基因的功能提供基础。
1 材料与方法
1.1 实验动物
青鳉,Orange品系,由新加坡国立大学洪云汉教授赠予。在中国科学院水生生物研究所淡水生态与生物技术国家重点实验室培育,于 26 ℃下恒温养殖,光暗周期比为14∶10。实验按照中国科学院水生生物研究所实验室的动物护理和使用指导原则进行。
1.2 foxl2基因CRISPR/Cas9靶位点设计
根据 CRISPR/Cas9靶序列设计网站信息(http://zifit.partners.org/ZiFiT/),设计foxl2基因敲除的靶位点。提交foxl2基因序列(NM_001104888.1)信息,通过网站获得所有紧邻5′ -NGG-3′ (PAM)的候选gRNA靶序列集合,选取青鳉foxl2基因起始密码子ATG后评分最高的两条gRNA在基因上的位置信息,进行体外合成和胚胎显微注射试验。
1.3 foxl2基因CRISPR/Cas9靶位点gRNA及Cas9 mRNA的合成
pT7-gRNA质粒和 pT3-Cas9质粒[23]购自Addgene。以pT7-gRNA质粒作为模板,设计PCR引物(表1),所用引物均在北京擎科新业生物技术有限公司(武汉)合成,扩增获得携带 T7启动子、foxl2基因靶位点序列和gRNA序列,PCR产物通过割胶回收纯化,送铂尚生物技术有限公司(武汉)测序,比对正确后,通过试剂盒(mMESSAGE mMACHINE® T7 Transcription Kit,Ambion,USA)体外转录合成,获得foxl2基因靶位点和gRNA序列的 mRNA。pT3-Cas9质粒经限制性内切酶XbaⅠ酶切线性化后,通过试剂盒(mMESSAGE mMACHINE® T3 Transcription Kit,Ambion,USA)体外转录合成 Cas9 mRNA。将mRNA纯化,测定RNA浓度,保存在- 80 ℃备用。

表1 引物及其序列Table 1 Primers and their sequences
1.4 青鳉胚胎的显微注射
采用定量显微注射系统(Warner PLI-100A,USA)[24],将2个foxl2基因靶位点的gRNA分别与Cas9 mRNA以质量体积比(ng/μL)50∶500混合,分别注射青鳉一胞期的受精卵,每个位点注射不少于200枚受精卵,注射后胚胎在26 ℃下培养,用于后期检测与传代。
1.5 foxl2基因突变体的筛选与传代
注射72 h后,随机收集8枚青鳉胚胎,提取基因组 DNA,采用异源双链分析法(Heteroduplex Analysis,HA)[25]检测P0 代foxl2基因 CRISPR/Cas9靶位点的突变效率,PCR扩增后,测序验证。注射胚胎发育为成体后,剪取少量尾鳍,通过HA法筛选出P0代中的突变个体。因为P0代的阳性鱼是嵌合体,尾鳍检测到foxl2基因突变,生殖腺中foxl2基因不一定突变;尾鳍与生殖腺中的foxl2基因突变类型也不一定相同。因此,将每一对 P0代的亲本通过雌雄配对与野生型(Wild type,WT)交配获得F1代群体独立饲养。F1代发育成熟后,提取尾鳍DNA,PCR结合测序确定foxl2基因突变后的基因型,选择突变类型为碱基缺失数目为非3整数的个体,造成foxl2基因编码区发生移码突变或提前终止翻译的类型作为传代的亲本类型。选择突变后基因型相同的父母本杂交获得F2代群体,在F2代中筛选可获得的foxl2-/-纯合子个体和foxl2+/-杂合子个体,同理,产生 F3代群体,用于后续遗传建系和实验分析。
剪取少量尾鳍,提取基因组 DNA,通过 PCR扩增和测序分析foxl2基因突变体的基因型,并通过扩增DMY基因分析突变体的性染色体类型[26]。根据性别决定类型,青鳉为雄性异配型性别决定方式,即简单表述为XX型雌性与XY型雄性。在F1代群体中检测有野生型XX型雌性、野生型XY型雄性、杂合突变体XX型雌性(foxl2+/-)、杂合突变体XY型雄性(foxl2+/-)。在 F2代群体中检测有野生型XX型雌性、野生型XY型雄性、杂合突变体XX型雌性(foxl2+/-)、杂合突变体XY型雄性(foxl2+/-)、纯合突变体 XX型(foxl2-/-)和纯合突变体 XY型(foxl2-/-)。
1.6 形态学分析
Orange品系青鳉雌性与雄性的背鳍与臀鳍形状有显著差异[26],雄性臀鳍呈平行四边形,雌性臀鳍呈三角形,通过观察臀鳍形状初步判断成年青鳉的性别。将青鳉成鱼麻醉,于体式镜(Olympus SZ61,JPN)下拍照,统计并分析群体中雌雄比例。
1.7 组织学分析
按照中国科学院水生生物研究所和武汉大学实验室动物的护理和使用指导原则对青鳉解剖与处理,将剖取的腺组织分成2份,一份放入Trizol试剂(Invitrogen,USA)用于提取 RNA,一份放入波恩氏液[V(苦味酸)∶V(甲醛) ∶V(冰醋酸) =15∶5∶1)]中固定 12 h,脱水,石蜡包埋,切片(切片厚度精巢6 μm,卵巢8 μm),苏木精-伊红(HE)染色,中性树脂封片,于显微镜(Olympus BX53,JPN)下观察、记录与比较分析。
1.8 基因表达分析
提取 1.7中的性腺组织总 RNA,用 ReverTra Ace® qPCR RT Master Mix with gDNA Remover(Toyobo,JPN)试剂盒反转录合成 cDNA。实时定量PCR反应体系(20 μL): 2×SYBR Green Mix 10 μL,正、反向引物各 0.5 μL(终浓度 0.2 μmol/L),cDNA 模板 2 μL,ddH2O 7 μL。反应程序:95 ℃ 1 min;95 ℃ 15 s,60 ℃ 10 s,40 个循环;72℃ 15 s;绘制熔解曲线,65 ~ 95 ℃,5 s/0.5 ℃。β-actin为内参基因,用2-ΔΔCt法分析相关基因的相对表达[27],通过GraphPad Prism 7软件可视化作图,相关基因的定量引物见表1。
1.9 数据统计分析
数据以平均值±标准误形式表示,并采用SPSS18.0软件对数据进行t-检验,0.01<P<0.05表示显著差异,P<0.01表示极显著差异。
2 结果
2.1 青鳉foxl2基因敲除突变体材料的建立
青鳉foxl2基因敲除突变体材料建立流程见图1。根据 CRISPR/Cas9靶序列设计网站确定青鳉foxl2基因候选CRISPR/Cas9靶位点,如图2所示。通过提取DNA后PCR与测序的方法检测F1代的突变类型(图3),筛选出缺失4碱基基因型(Δ4 bp)的阳性鱼作为亲本,建立本研究的突变体材料。野生型FOXL2蛋白全长为306个氨基酸,Forkhead 结构域位于FOXL2蛋白的47至135位氨基酸,Δ4 bp突变型的foxl2基因预测仅可产生13个氨基酸的多肽链,在Forkhead结构域前终止(图4),不能编码全长FOXL2蛋白的氨基酸序列,提示foxl2基因Δ4bp突变型不具备正常功能。

图1 青鳉foxl2基因敲除突变体材料的实验流程Fig.1 Flow chart of generating foxl2 mutants in Medaka
2.2 青鳉foxl2基因纯合突变体的筛选与表型分析

图2 青鳉foxl2基因的结构示意图Fig.2 Structure of foxl2 gene in Medaka

图3 青鳉foxl2基因CRISPR/Cas9靶位点突变类型Fig.3 Target mutation type of foxl2 gene CRISPR/Cas9 in Medaka

图4 青鳉foxl2基因缺失4碱基基因型的氨基酸序列预测与比对Fig.4 Prediction and comparison of the amino acid sequence of foxl2 gene with 4 base deletion in Medaka
选取foxl2-F和foxl2-R、foxl2-F1和foxl2-R1引物分别扩增F2代和F3代群体中每尾鱼的foxl2基因,筛选foxl2基因突变的杂合子与纯合子。图5中,引物foxl2-F1和foxl2-R1 的PCR产物为497 bp,foxl2-F和foxl2-R的产物为322 bp,foxl2基因的PCR产物中,编号为2、4、5和8的样品既有497 bp又有 322 bp条带,说明该鱼是野生型或突变型杂合子;编号为1、3、6和7号的样品有322 bp但无497 bp条带,说明该鱼是突变型。为确认检测对象的遗传性别,通过扩增DMY基因判断检测对象的性染色体类型,DMY-F和DMY-R的 PCR产物为396 bp,即通过有无DMY基因PCR产物判断是否携带Y染色体,从而判断检测对象的遗传性别。如图5所示,编号1、4和5号的青鳉为XX型性染色体,而编号2、3、6、7和8号的青鳉为XY型性染色体。

图5 foxl2和DMY基因PCR扩增结果Fig.5 Amplification result of foxl2 and DMY gene
为进一步验证foxl2基因突变型个体的基因型是否为纯合子,对foxl2基因PCR产物测序,结果见图6,验证后的突变型纯合子用于后续功能研究。进一步研究foxl2-/-突变体的生理性别是否与检测的性染色体类型相符,foxl2-/-突变体的生理性别通过臀鳍形状初步判断,臀鳍呈三角形为雌性,臀鳍呈平行四边形为雄性。统计结果见图7。检测野生型青鳉共计121尾,其中雌鱼59尾,雄鱼62尾,它们的生理性别与遗传性别相符。然而,检测的34尾foxl2-/-突变体遗传性别无论是XX型还是XY型,其臀鳍形状均显示为雄性。各随机取3尾foxl2-/-突变体,解剖后发现其性腺不具备典型的卵巢特征(图7),提示foxl2-/-突变体的生理性别均为雄性。

图6 野生型与突变型纯合子的foxl2基因DNA测序Fig.6 foxl2 gene DNA sequencing of wild-type and mutant homozygous
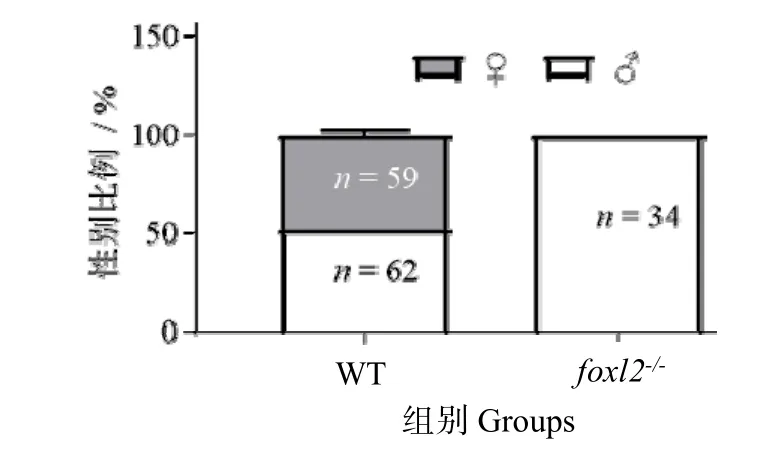
图7 野生型与突变型纯合子性别比例统计Fig.7 Sex ratio statistics of wild-type and mutant homozygous

图8 野生型与突变型纯合子青鳉的表型Fig.8 Phenotypes of wild-type and mutant homozygous in Medaka
2.3 foxl2基因缺失对青鳉性腺的影响
获得foxl2-/-纯合子后,用组织切片分析foxl2缺失对青鳉性腺结构的影响(图9)。与野生型青鳉卵巢和精巢比较发现,foxl2-/-纯合子无论性染色体类型是XX型还是XY型,其性腺整体结构与精巢组织更为相似。值得注意的是,与野生型精巢不同,foxl2-/-纯合突变体的精巢形态不规则,组织结构疏松,还发现极少数核仁外周卵母细胞和退化的核仁外周卵母细胞(图9:1-8),表明foxl2缺失影响青鳉卵巢组织结构的维持。
精巢和卵巢在生殖细胞与支持性细胞类型上均有显著差异,因此,进一步比较分析foxl2-/-纯合突变体性腺组织中生殖细胞周围的支持性细胞(图9:9-16)。野生型青鳉卵巢中核仁外周卵母细胞周围有一层紧密排列的长方形粒层细胞,野生型青鳉精巢中精小囊周围有一些不规则三角形的支持细胞。着重观察foxl2-/-纯合子的性腺中核仁外周卵母细胞和支持性细胞类型,与野生型卵巢不同,虽然可观察到极少数的核仁外周卵母细胞,但其周围无正常形态的粒层细胞;同时,与野生型精巢相比,精小囊中各种精原细胞数目明显减少,空腔显著增多,值得一提的是,空腔周围并无正常形态的粒层细胞。提示foxl2缺失可能主要影响青鳉卵巢组织结构的维持,特别是粒层细胞分化与功能的维持。

图9 青鳉性腺组织结构Fig.9 Tissue section of gonad in Medaka
2.4 foxl2基因缺失对性腺分化与发育相关基因的影响
组织切片结果显示,foxl2-/-纯合突变体的性腺整体形态趋近于精巢,但精细结构尤其是生殖细胞周围体细胞类型不同于精巢,表明foxl2-/-纯合突变体性腺的分化与发育出现了紊乱。为从分子水平验证这一推测,进一步用实时定量PCR检测性腺分化与发育相关基因。选择已报道的一系列与性腺分化与发育相关基因,其中精巢发育相关的基因sox9b、gsdf、amh以及卵巢发育相关基因cyp19a1a表达差异显著(图10)。为精细分析基因表达情况,充分考虑性染色体和基因组对基因表达的影响,将foxl2-/-纯合突变体分为XX组和XY组,XX组表示性染色体类型为XX型青鳉性腺;XY组表示性染色体类型为XY型青鳉性腺。结果显示,与野生型相比较,foxl2-/-纯合突变体性腺中,sox9b基因的表达无论是XX组还是XY组均显著升高(图10A);XX组的foxl2-/-纯合突变体gsdf基因的表达显著升高,XY组则无显著差异(图10B);XX组的foxl2-/-纯合突变体amh基因的表达增加极显著,XY组则无显著差异(图10C);XX组的foxl2-/-纯合突变体cyp19a1a基因的表达降低极显著,XY组则降低显著(图10D)。可见,foxl2-/-纯合突变体性腺的基因表达情况均表现出精巢的分子特征,验证了组织切片结果。

图10 性腺中sox9b、gsdf、amh和cyp19a1a基因的表达分析Fig.10 Expression of sox9b, gsdf, amh and cyp19a1a gene in the gonad of Medaka
3 讨论
FOXL2是Fox转录因子家族的重要成员[5-6]。随着鱼类基因编辑技术的发展与成熟,越来越多的研究聚焦到鱼类Fox转录因子家族基因的功能。近期,通过建立foxl2基因敲除的罗非鱼(Oreochromis niloticus)材料揭示,foxl2基因通过调控雌性信号通路的cyp19a1等关键基因影响性腺分化与发育[28-30];斑马鱼(Danio rerio)中,存在foxl2a和foxl2b两个同源基因,单独敲除foxl2a与foxl2b基因后性腺表型变化不显著,而杂交获得的foxl2a和foxl2b双敲除材料中卵巢发育受阻,提示斑马鱼foxl2a和foxl2b协同调控卵巢发育与维持[31]。随着硬骨鱼中对foxl2基因功能的研究逐渐深入,foxl2基因对鱼类卵巢分化和维持的重要作用得以证实。
CRISPR/Cas9技术有操作简易、敲除效率高和靶位点选择性广等优点。本研究利用CRISPR/Cas9技术敲除青鳉foxl2基因,建立了青鳉foxl2基因突变体材料,为后续深入阐释foxl2基因功能提供良好的动物模型和研究基础。主要围绕foxl2基因缺失4碱基基因型(Δ4bp)的阳性鱼产生的杂合突变型与纯合突变类型开展了表型、组织切片与基因表达分析。因为杂合突变类型的表型不显著,因而未在文中详细展示与描述。对于纯合子进行了 DNA和cDNA水平的检测,通过三联密码翻译预测验证CRISPR/Cas9技术破坏了foxl2基因的正常翻译,无法形成 FOXL2蛋白行使功能。因未获得较好的FOXL2抗体,故未通过直接的实验证明foxl2-/-纯合突变体中无FOXL2蛋白。
序列比对发现,foxl2基因在鱼类中比较保守。但罗非鱼在受精后5 d检测到foxl2基因的表达[32],吕宋青鳉(Oryzias luzonensis)在受精后7 d(即孵化前1 d)检测到foxl2基因表达[33],然而青鳉在孵化后0 d检测到foxl2基因表达[16],可见不同鱼类foxl2基因的时空表达不尽相同。因此,建立青鳉foxl2基因敲除的突变体材料有助于全面揭示foxl2基因在脊椎动物中的功能与分子机制。
本研究的性腺组织切片中,基因型为 XX的foxl2-/-突变体青鳉臀鳍等体征表现为雄性,即不具备典型卵巢特征而更像精巢,表明foxl2-/-突变体青鳉的性染色体与体征、性别存在不一致情况。为更精细揭示foxl2-/-突变体青鳉的表型,进行后续功能研究,本研究通过臀鳍等体征和性腺组织特征分别报道青鳉的性别,并通过扩增DMY基因判断检测对象的遗传性别。由此,将foxl2-/-突变体青鳉分为XX型与XY型。检测的34尾foxl2-/-突变体无论是XX型还是XY型的遗传性别,其臀鳍形状显示其均为雄性,且解剖发现其性腺不具备典型的卵巢特征,提示foxl2-/-突变体的生理性别均为雄性。这与斑马鱼中双敲除foxl2a和foxl2b[31]、罗非鱼敲除foxl2报道突变体的雄性特征相似[29-30]。
本研究中,XX型的青鳉foxl2-/-突变体性腺整体结构上表现为精巢特征,但仍残留少量的核仁外周卵母细胞和退化的核仁外周卵母细胞,提示 XX型的foxl2-/-突变体存在卵巢发育不全或者卵巢退化现象。在罗非鱼和斑马鱼foxl2敲除个体中观察到退化的卵母细胞和空腔,与本研究类似[29,31]。进一步观察青鳉foxl2-/-突变体精巢,发现核仁外周卵母细胞周围并无正常形态的粒层细胞,结合哺乳类与鱼类的foxl2基因在性腺中的表达主要定位在粒层细胞[6,16,34],提示青鳉foxl2基因的缺失导致核仁外周卵母细胞周围的粒层细胞异常。而发生天然性逆转鱼类中foxl2的表达水平也随着性别的转换而发生卵巢粒层细胞与精巢支持细胞的改变[35-36]。本研究中,青鳉foxl2主要在粒层细胞及前体细胞中表达,为foxl2基因参与卵巢粒层细胞分化与功能的维持[16]提供又一佐证。
Sox9和Amh等与雄激素生成密切相关,直接影响性腺向精巢的分化与精巢的发育维持[37-38],这从分子水平初步解释本研究中青鳉foxl2-/-突变体性腺倾向于精巢的组织特征。大部分硬骨鱼类中sox9基因有2种类型,即sox9a和sox9b/sox9a2[39-40],性腺和精巢支持细胞中特异表达的是sox9b[41]。青鳉foxl2-/-突变体性腺中sox9b基因表达显著增加,提示青鳉foxl2基因抑制sox9b表达,印证了哺乳动物中的相关发现[42],foxl2-/-突变体sox9b、amh和gsdf基因表达升高也表明性腺向精巢方向分化的趋势增强。Cyp基因家族是编码芳香化酶P450的重要组分,与雌激素的合成密切相关。哺乳动物中的研究显示,Foxl2可直接调控Cyp19a1转录,参与雌激素合成,影响性别的分化与性腺的发育[43]。青鳉包括cyp19a1a/cyp19a1和cyp19a1b/cyp19a2[44-46]。在青鳉中,cyp19a1a主要在性腺中表达,与性腺分化相关[47]。罗非鱼的研究表明,foxl2可通过结合cyp19a1启动子上的特异序列,激活cyp19a1的转录[28]。本研究中,foxl2-/-突变体中cyp19a1a的表达水平显著降低,为突变体性腺雌性信号通路功能下降与卵巢维持功能下降提供了分子依据。青鳉cyp19a1a基因敲除研究也报道了突变体发育中出现卵巢向精巢方向的转变[48],但是,青鳉中foxl2是通过直接方式还是间接方式调控cyp19a1a,需进一步深入研究。
综上所述,本研究通过CRISPR/Cas9技术建立了青鳉foxl2-/-突变体,发现青鳉foxl2-/-突变体出现遗传雌性生理雄性的特征。foxl2基因的缺失造成cyp19a1a等雌激素信号通路相关基因的表达显著下降,核仁外周卵母细胞退化和粒层细胞异常,卵巢功能退化;而sox9b、gsdf和amh等基因的表达显著增加,foxl2-/-突变体性腺组织结构上更像精巢。初步阐释foxl2在维持青鳉卵巢功能中的作用,为后续深入阐释foxl2基因的功能提供良好的动物模型和研究基础。
