施肥处理对不同抗性品种香蕉枯萎病的防控效果
2019-04-13杨宝明黄玉玲白亭亭徐胜涛尹可锁番华彩李迅东郭志祥李永平杨德荣李进平郑泗军
龙 媛, 杨宝明, 黄玉玲, 白亭亭, 徐胜涛, 尹可锁, 番华彩, 曾 莉, 李迅东, 郭志祥, 李永平, 杨德荣, 李进平, 郑泗军,4*
1云南省农业科学院农业环境资源研究所,云南 昆明 650205; 2屏边县新华乡农业技术推广站,云南 屏边 661205; 3云南云天化股份有限公司,云南 昆明 650228; 4国际生物多样性中心,云南 昆明 650205
香蕉枯萎病Fusariumoxysporum又称香蕉黄叶病或巴拿马病Panama disease,是由尖孢镰刀菌古巴专化型Fusariumoxysporumf. sp.cubense侵染而引起维管束坏死的真菌土传病害,一旦发病则整株死亡,病菌蔓延速度快(黎永坚和于莉,2006)。世界上主要香蕉产区均不同程度地受到香蕉枯萎病的危害(肖爱萍和游春平,2005)。香蕉枯萎病菌4号生理小种热带型最初从印度尼西亚传入到我国台湾省,然后从台湾扩散到广东(1996年)、福建(2001年)、海南(2002年)、广西(2006年)和云南(2009年)等地(Zhengetal.,2018a,2018b)。2009年7月,云南西双版纳勐腊县香蕉产区首次发现香蕉枯萎病,感病香蕉15万株,发病面积超过2000 hm2,该病发展迅速,给当地香蕉产业造成严重损失(曾莉等,2016)。
香蕉枯萎病菌是兼性寄生菌,腐生能力很强,可在土壤中存活长达30年,很难根治(王振中,2006)。目前,防控香蕉枯萎病主要通过化学药剂、生物防治、抗病品种选育等方法,其中选育抗病品种是解决香蕉枯萎病的有效途径(刘文清等,2010; Siamak & Zheng,2018)。20世纪80年代,台湾选育出一些对香蕉枯萎病具有较好抗耐性的香蕉品种。2006年,广东省选育并审定的抗枯5号是我国大陆第一个香蕉枯萎病抗病品种,之后陆续审定了其他几个抗病品种。但总体而言,我国目前选育的抗枯品种还很少,并且抗性不强(黄素梅等,2014)。香蕉枯萎病的发生与香蕉品种的抗性、环境条件、土壤中病原菌数量等因素有关(何欣等,2010)。施用有机肥对香蕉枯萎病起到一定的防控作用(王瑾等,2017),室内研究表明,木霉菌株(唐孜等,2006)和枯草芽孢杆菌(周登博等,2016)对香蕉枯萎病菌有抑制作用。土壤中拮抗菌的种类和数量会直接影响香蕉枯萎病菌的数量,当拮抗菌的种类增加时不利于香蕉枯萎病菌的繁殖和侵染(周博登等,2016)。
由于各个地区的香蕉枯萎病菌遗传背景不同,可能会导致香蕉种质抗病性的地区性差异(宋晓兵等,2016)。近年来,西双版纳地区的香蕉园正遭受枯萎病的严重威胁,导致许多发病蕉园地被撂荒。若改种旱地作物,需8年以上才可以再种香蕉,若改种水生作物,2~3年可再种香蕉。但在云南种植香蕉一般多为山地和坡地,不适合种植水生作物,这种趋势必将导致香蕉种植面积减少,直接威胁香蕉产业的健康可持续发展(李燕和张林,2016)。因此,选育适宜本地区的抗病新品种和探索有效的施肥方法成为当务之急。
1 材料与方法
1.1 材料与试验地
供试香蕉品种:生产上的主栽感病品种巴西蕉Brazilian和桂蕉1号Guijiao No1. 、抗病品种南天黄Nantianhuang 、自主选育品种云蕉1号Yunjiao No1.,其中云蕉1号是由云南省农业科学院农业环境资源研究所选育出的香蕉枯萎病抗病新品种。所有供试香蕉苗均由云南省农业科学院环境资源研究所农业生物多样性与香蕉研究室提供组培苗。一级组培苗经过苗床炼苗而成二级苗。
供试肥料:常规有机肥、虾肽有机肥、虾肽特护、虾肽果叶康、微生物制剂(主要包含白僵菌、绿僵菌、放线菌、硅酸盐芽孢杆菌、枯草芽孢杆菌、多粘芽孢杆菌、木霉菌、光合菌、酵母菌等)、复合肥(15-15-15S)、磷酸二铵(17-42-0)、尿素、磷酸钾、复合肥(15-15-25S)均由云南云天化股份有限公司提供。
试验地位于云南省景洪市勐罕镇橄榄坝(东经100°56′13″,北纬21°51′43″;海拔540 m),为已连续种植10年的香蕉地,种植感病品种巴西蕉的发病率在90%以上,土壤已经遭受香蕉枯萎病4号生理小种热带型TR4的侵染。
1.2 试验方法
1.2.1 不同抗性香蕉品种定植及施肥设计 试验采用裂区设计,分别设置3个处理为3个大区,每个大区种4个品种,每个品种5次重复,一次重复种植30株香蕉。每个试验大区20个小区,3个试验大区共计60个小区,每个小区面积135 m2,共计8100 m2。
处理1(对照)施用常规有机肥(基肥)0.750 kg·m-2;处理2(虾肽有机肥处理)施用虾肽有机肥(基肥)+虾肽特护+虾肽果叶康,施用量分别为0.750 kg·m-2、0.100 kg·株-1、0.020 kg·株-1;处理3(微生物处理)施用常规有机肥(基肥)+微生物制剂,施用量分别为0.750 kg·m-2、0.005 kg· m-2(灌根)、0.300 g·m-2(喷叶)。3个处理都施用复合肥(15-15-15S)、磷酸二铵(17-42-0)、尿素、硫酸钾和复合肥(15-15-25S),施用量分别为0.750 kg·m-2、0.030 kg·m-2、0.200 kg·株-1、0.070 kg·株-1、0.050 kg·株-1,施用期均以2个叶龄为间隔期。处理2、处理3分别施入二氧化氯(0.003 kg·m-2)作土壤消毒处理。2016年6月23日定植,定植苗为生长至6~7片叶的二级苗。
1.2.2 土壤样品实时定量PCR分析 种植香蕉后,即2016年7、8、9、10、11、12月,2017年1月,共计7个月,每个月各取样一次。
土壤取样方法:用土壤采样器取香蕉植株根际周围土壤,每个小区各随机取4株香蕉根际周围的土壤作为4次重复,每次重复取表土10~20 cm的5个点,并将5个点的土样混合,再分别将同一小区的4次重复土样混合为一份土样。
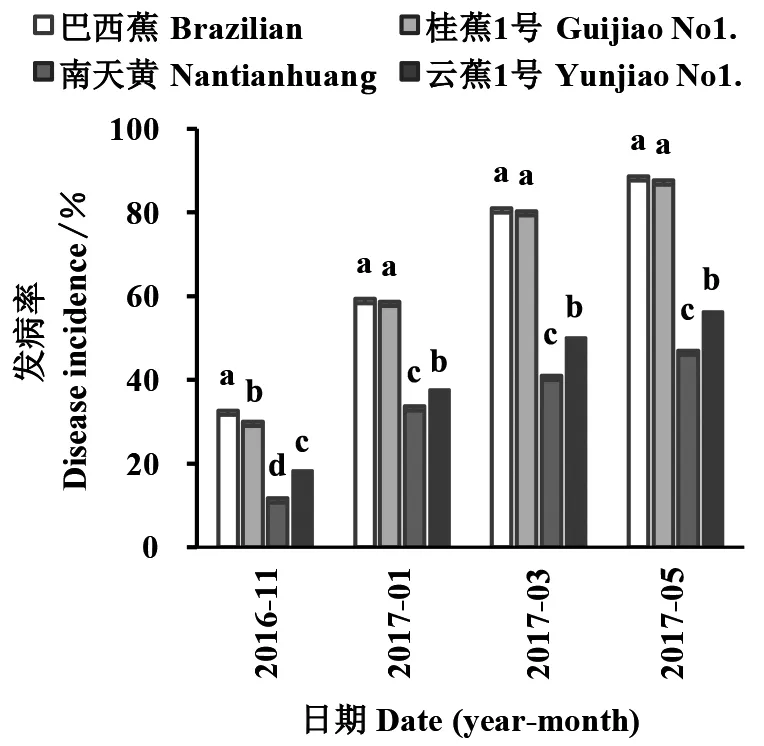
土壤病原菌含量测定:土壤样品采用Mo Bio Power Soil DNA Isolation Kit (Catalong No.12888-50),然后进行实时定量PCR分析土壤中枯萎病4号生理小种的孢子量,实时定量PCR采用Takara SYBR Premix Ex Taq TM (Tli RHase H Plus)试剂盒(Code NO.RR820)。引物和具体程序均参照Linetal. (2013),扩增的目的片段大小为242 bp,标准曲线的建立采用含有242 bp目的片段的重组质粒PMD18-T-242,测定抽提的质粒DNA的浓度,根据以下公式将质粒DNA的浓度换算成拷贝数,设置1×107、1×106、1×105、1×104、1×103、1×102、1×101copy number·μL-17个梯度标准样品制作标准曲线,标准曲线要求R2>0.99,90 1.2.3 数据统计方法 植株发病的判断标准:以植株下部叶片黄化4片以上或假茎基部有2块以上叶鞘开裂、裂缝大于10 cm为依据(刘文清等,2010),统计定植后第5、7、9、11个月的发病植株数,计算累计发病率。 发病率%=(发病植株数/调查株数)×100。 土壤枯萎病原菌月平均含量为60个试验小区所取土样分别测得的病原菌含量的平均值。 目前尚无人对香蕉枯萎病重病地的病原菌含量动态变化进行连续监测。本研究在香蕉种植一个月之后的2016年7、8、9、10、11、12月和2017年1月对蕉园土壤进行取样分析。种植香蕉后连续监测的7个月份内土壤中TR4的月平均含量差异比较大,动态变化明显(图1)。最低含量均超过2000 copy number·g-1,最高达15148.9 copy number·g-1,说明种植香蕉的土壤中枯萎病原菌入侵严重。 图1 土壤中TR4的含量Fig.1 The content of TR4 in the soil of the studied banana plantation 2.1.1 不同香蕉品种在常规有机肥处理(对照)中的发病率 由图2可知,定植后第5个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达38.00%、33.00%、24.67%、16.67%,4个品种发病率差异显著;定植后第7个月巴西蕉、桂蕉1号、云蕉1号、南天黄分别达69.33%、68.00%、46.00%、43.67%,巴西蕉和桂蕉1号发病率无显著差异,与南天黄和云蕉1号有显著差异;定植后第9个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达84.33%、82.66%、57.33%、49.00%,巴西蕉和桂蕉1号无显著差异,南天黄和云蕉1号有显著差异。南天黄与云蕉1号的发病率有显著差异。定植后第11个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达93.00%、91.33%、62.67%、50.00%,巴西蕉和桂蕉1号无显著差异,与南天黄和云蕉1号有显著差异。南天黄与云蕉1号有显著差异。这4个时期4个品种间的抗性均表现为南天黄>云蕉1号>桂蕉1号>巴西蕉。 图2 4个香蕉品种的发病率(对照)Fig.2 Disease incidence of four banana varieties (CK)不同小写字母表示同一时期不同品种在5%水平上差异显著。 2.1.2 不同香蕉品种在虾肽有机肥处理中的发病率 由图3可知,定植后第5个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达36.00%、32.00%、22.00%、13.00%,4个品种的发病率差异显著;定植后第7个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达67.66%、66.67%、43.33%、38.00%,巴西蕉和桂蕉1号无显著差异,与南天黄和云蕉1号有显著差异。南天黄与云蕉1号有显著差异;定植后第9个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达82.00%、81.33%、53.00%、45.00%,巴西蕉和桂蕉1号无显著差异,与南天黄和云蕉1号有显著差异。南天黄与云蕉1号有显著差异;定植后第11个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达91.67%、88.67%、60.67%、48.33%,巴西蕉和桂蕉1号无显著差异,与南天黄和云蕉1号有显著差异。南天黄与云蕉1号有显著差异。这4个时期4个品种间的抗性均表现为南天黄>云蕉1号>桂蕉1号>巴西蕉。 图3 4个香蕉品种的发病率(肽虾有机肥处理)Fig.3 Disease incidence recorded in the four banana varieties under theshrimp peptide organic fertilizer treatment不同小写字母表示同一时期不同品种在5%水平上差异显著。 2.1.3 不同香蕉品种在微生物处理中的发病率 由图4可知,定植后第5个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达32.67%、30.00%、18.83%、11.67%,4个品种的发病率差异显著;定植后第7个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达59.33%、58.67%、37.67%、33.67%,巴西蕉和桂蕉1号无显著差异,与南天黄和云蕉1号差异显著。南天黄与云蕉1号有显著差异;定植后第9个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达81.00%、80.33%、50.00%、41.00%,巴西蕉和桂蕉1号无显著差异,与南天黄和云蕉1号有显著差异。南天黄与云蕉1号有显著差异;定植后第11个月巴西蕉、桂蕉1号、云蕉1号、南天黄的发病率分别达88.67%、87.66%、56.33%、47.00%,巴西蕉和桂蕉1号无显著差异,与南天黄和云蕉1号有显著差异。南天黄与云蕉1号有显著差异。这4个时期4个品种间的抗性均表现为南天黄>云蕉1号>桂蕉1号>巴西蕉。 图4 4个香蕉品种的发病率(微生物处理)Fig.4 Disease incidence of recorded in the four banana varieties under the microbial treatment不同小写字母表示同一时期不同品种在5%水平上差异显著。 3个施肥处理间的发病率差异显著,微生物处理、虾肽有机肥处理的枯萎病发病率均降低,与对照相比,虾肽有机肥处理在香蕉定植后第5、7、9、11个月的防治率分别达8.29%、5.00%、4.40%、2.60%;微生物处理在香蕉定植后第5、7、9、11个月的防治率分别达17.49%、16.60%、7.70%、5.80%,虾肽有机肥处理和微生物处理的防治率均随时间推移下降,说明这2个处理的防治效果由前期到后期逐渐减弱(表1)。 试验蕉园内种植的4个品种均表现出较高的发病率,一定程度上说明本试验所选择的蕉园枯萎病严重。试验地土壤中病原菌的月平均含量均超过室内试验的发病临界浓度,即香蕉枯萎病病原孢子悬液浓度1×103CFU·g-1(何欣等,2010),土壤中枯萎病原菌含量高,具备土壤病原菌含量促使发病的条件,验证了品种在该条件下的抗性表现。 表1 不同施肥处理香蕉枯萎病发病率Table 1 The disease incidence of banana wilt in different fertilization treatments 同列数据(平均值±标准误)后不同小写字母者表示在5%水平上差异显著。 The data (means±SD) in the same column with the different letters mean significant differences at 5% level. 种植在试验区的4个香蕉品种的发病率存在显著差异,特别是感病品种和抗病品种间发病率差异大。南天黄的抗性较强,云蕉1号较巴西蕉和桂蕉1号表现出较强的抗性,与徐胜涛等(2017)对这3个品种室内抗性鉴定结果相吻合。 3种施肥处理间的发病率虽有显著差异,但施肥处理对枯萎病的防治效果远低于品种自身抗性对枯萎病的防控效果。这说明通过抗病育种选育出抗性较高的品种是目前解决枯萎病危害最有效最直接的途径,施用微生物制剂改良土壤条件也能降低发病率。这与现阶段提倡对香蕉枯萎病采用“以选育抗病品种为主导,以综合防控相应配套措施为辅”的防控策略相应证。在探索香蕉枯萎病综合防治方法的同时不能忽视传播途径造成的影响,通过实施严格的种苗调运检疫,农用工具和人员消毒等防范和隔离措施,防止该病害的进一步传播与蔓延(Zhengetal.,2018)。2 结果与分析
2.1 土壤中枯萎病原菌含量分析



2.2 施用不同肥料对香蕉枯萎病的防治效果
3 讨论与结论

