慢性低氧性肺动脉高压大鼠凝血纤溶因子的变化
2019-04-12李宜珊康睿男张舒婷李杰娜施熠炜
李宜珊 康睿男 张舒婷 李杰娜 施熠炜
山西医科大学第一医院呼吸与危重症医学科,太原030001
肺动脉高压(pulmonary hypertension,PH)是以持续和显著的肺动脉压力升高,导致右心负荷增大和右心功能不全,从而引起一系列临床症状的病理生理综合征。低氧性肺动脉高压(hypoxia pulmonary hypertension,HPH)属于第3大类PH,是肺部基础疾病如COPD、间质性肺疾病等主要并发症[1-2]。PH的发病机制尚不清楚,在发生肺血管收缩、肺血管重塑的同时,也常伴随血液高凝状态[3],但其机制尚未阐明。研究认为,凝血纤溶因子的异常表达与血液高凝状态具有相关性[4]。
近年来大量基础及临床实验研究表明,血管性血友病因子(von Will brand factor,vWF)、蛋白C(protein C,PC)、组织型纤溶酶原激活物(tissue plasminogen activator,t-PA)、纤溶酶原激活物抑制物1(plasminogen activator inhibitor-1,PAI-1)作为凝血纤溶因子在静脉血栓栓塞性疾病中发挥重要作用[5-6],但其在HPH发病机制中的作用鲜有报道。因此,本研究通过建立慢性低氧性PH整体动物模型,观察慢性低氧所致PH大鼠体内凝血纤溶因子的变化情况,并探讨凝血纤溶因子在慢性低氧诱导的大鼠PH发生和发展过程中所起的作用。
1 材料与方法
1.1 动物模型的建立及分组 清洁级成年雄性SD大鼠30只,体质量200~250 g,由山西医科大学动物部提供[SCXK(晋)2009-0001]。将SD大鼠随机分为正常对照组、低氧3 d、7 d、14 d和21 d组,每组6只。正常对照组放置在空气中,低氧各组大鼠置于常压低氧舱内低氧相应的天数。每天打开舱门30 min,用于清理低氧舱、补充饲料和饮水。用高压罐向舱内输送氧气和氮气的混合气体,舱内氧气浓度用氧浓度分析仪来监测,控制舱内氧浓度在(10.0±0.1)%。舱内用钠石灰吸收二氧化碳,无水氯化钙吸收水蒸气。
1.2 右心室收缩压(right ventricular systolic pressure,RVSP)和右心室肥厚指数(right ventricular hypertrophy Iindex,RVHI)测定 各组大鼠干预结束后以10%水合氯醛(4 ml/kg)腹腔注射麻醉,仰卧固定,经右侧颈总静脉插入微导管,导管另一端连接压力传感器,根据生理多导记录仪显示的压力波形曲线和压力值来判断导管口所处的位置,待典型波形出现并稳定后测量RVSP,进而间接反映肺动脉压的变化。测压后取出大鼠心脏沿房室沟剪去心房和大血管根部,沿室间隔边缘分离出右心室(right ventricle,RV)和左心室(left ventricle,LV)+室间隔(septum,S),用滤纸吸干水分后,分别称量其质量。
1.3 大鼠肺动脉HE染色及观察 取大鼠右下肺以10%甲醛固定液(pH=7.4)固定,以梯度酒精顺序脱水,二甲苯透明后石蜡包埋,沿肺门水平横切,厚度约5 mm,进行HE染色,光学显微镜下观察各组大鼠肺动脉病理学变化。
1.4 血浆vWF、PC、t-PA、PAI-1浓度测定 剖腹经大鼠腹主动脉取血2 ml,3 000 r/min常温离心10 min(离心半径为10 cm),取得新鲜血浆,放置于-80℃冰箱储存待测。应用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)测定各组大鼠血浆vWF、PC、t-PA、PAI-1水平,操作严格按照试剂盒说明书进行。
1.5 统计学分析 应用SPSS 20.0统计软件,数据以±s表示,正常对照组、低氧组间多组数据间的比较采用单因素方差分析(one-way ANOVA),数据间的相关性分析采用直线相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 RVSP和RVHI的变化 与对照组相比,低氧各组大鼠RVSP、RVHI均显著升高,差异有统计学意义(P<0.01)(表1)。
表1 慢性低氧诱导的肺动脉高压大鼠RVSP、RVHI比较(±s)

表1 慢性低氧诱导的肺动脉高压大鼠RVSP、RVHI比较(±s)
注:RVSP为右心室收缩压;RVHI为右心室肥厚指数;1 mm Hg=0.133 k Pa;与正常对照组比较,a P<0.01
组别只数RVSP(mm Hg)RVHI(%)正常对照组6 23.76±2.01 100.00±0.00低氧3 d组6 40.37±4.21a 122.21±21.58a低氧7 d组6 48.29±2.66a 134.57±29.11a低氧14 d组6 46.18±5.95a 150.80±18.86a低氧21 d组6 50.13±3.17a 153.96±24.14a F值46.27 6.54 P值0.000 0.001
2.2 肺动脉显微结构观察 正常对照组肺动脉形态正常,在低氧暴露3 d、7 d和21 d后大鼠的肺动脉血管壁明显增厚,管腔变窄,肺动脉中膜明显增厚(图1)。
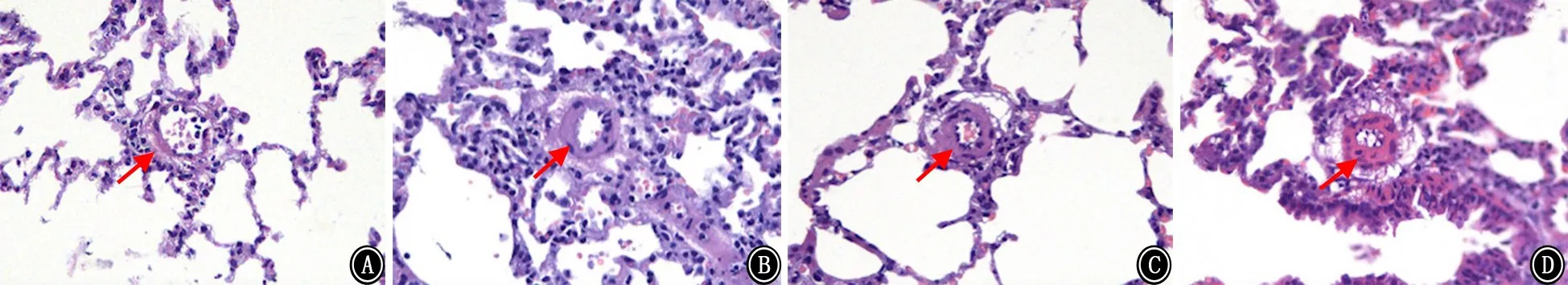
图1 肺组织HE染色 HE ×200 A:正常对照组;B:低氧3 d组;C:低氧7 d组;D:低氧21 d组;红色箭头表示肺动脉中膜
2.3 血浆vWF、PC、t-PA、PAI-1水平 与正常对照组相比,低氧各组大鼠血浆vWF、t-PA(除低氧7 d组)、PAI-1水平均显著升高(P<0.01),其中血浆vWF、PAI-1水平在低氧7 d组达到高峰;与正常对照组比较,低氧3 d、14 d、21 d组大鼠血浆PC水平均显著降低(P<0.01),低氧7 d组血浆PC水平显著升高(P<0.01)(表2)。
表2 各组大鼠血浆vWF、PC、t-PA及PAI-1水平比较(±s)
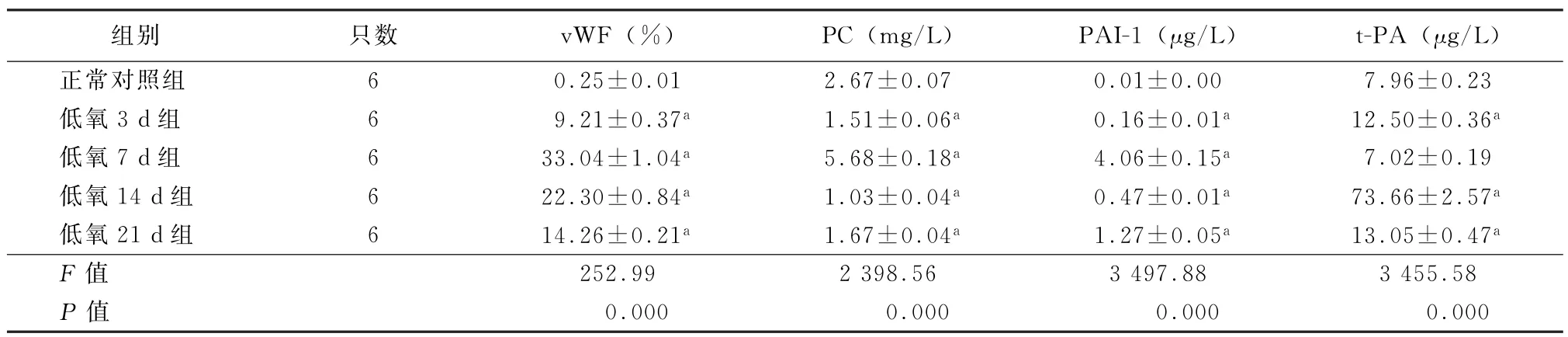
表2 各组大鼠血浆vWF、PC、t-PA及PAI-1水平比较(±s)
注:vWF为血管性假性血友病因子;PC为蛋白C;PAI-1为纤溶酶原激活物抑制物1;t-PA为组织纤溶酶原激活剂;与正常对照组比较,a P<0.01
组别只数vWF(%)PC(mg/L)PAI-1(μg/L)t-PA(μg/L)正常对照组6 0.25±0.01 2.67±0.07 0.01±0.00 7.96±0.23低氧3 d组6 9.21±0.37a 1.51±0.06a 0.16±0.01a 12.50±0.36a低氧7 d组6 33.04±1.04a 5.68±0.18a 4.06±0.15a 7.02±0.19低氧14 d组6 22.30±0.84a 1.03±0.04a 0.47±0.01a 73.66±2.57a低氧21 d组6 14.26±0.21a 1.67±0.04a 1.27±0.05a 13.05±0.47a F值252.99 2 398.56 3 497.88 3 455.58 P值0.000 0.000 0.000 0.000
2.4 HPH大鼠血浆vWF、PC、t-PA、PAI-1水平与RVSP的相关性 HPH大鼠血浆vWF、PAI-1水平与RVSP均呈正相关(r=0.745,P=0.000;r=0.506,P=0.004),血浆PC、t-PA水平与RVSP无相关性(r=0.063,P=0.743;r=0.242,P=0.197)。
2.5 血浆t-PA/PAI-1水平 与对照组比较,低氧各组大鼠血浆t-PA/PAI-1比值水平均显著降低(P<0.01)(表3)。
表3 各组大鼠血浆t-PA/PAI-1水平比较(±s)
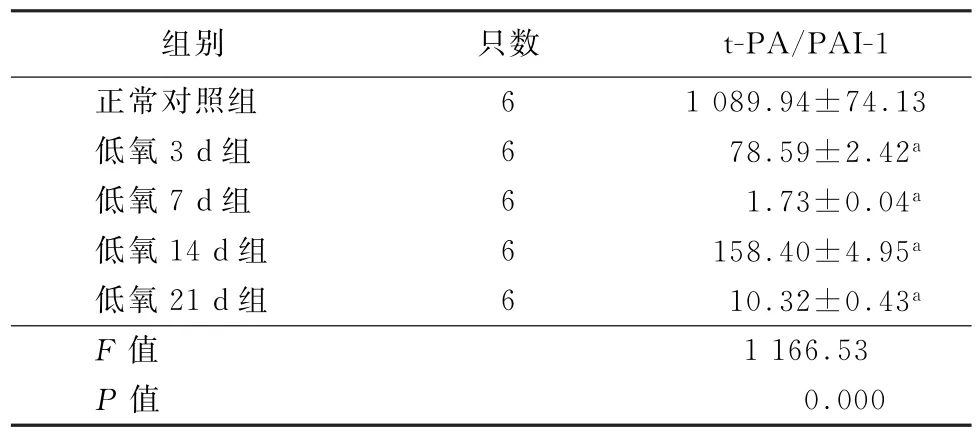
表3 各组大鼠血浆t-PA/PAI-1水平比较(±s)
注:与正常对照组比较,a P<0.01
组别只数t-PA/PAI-1正常对照组6 1 089.94±74.13低氧3 d组6 78.59±2.42a低氧7 d组6 1.73±0.04a低氧14 d组6 158.40±4.95a低氧21 d组6 10.32±0.43a F值1 166.53 P值0.000
3 讨论
PH是一组以肺血管阻力持续增加为特征且具有潜在致命性的慢性肺血管疾病,其致残率和死亡率高,并给社会和家庭带来沉重的负担。HPH在发生肺血管收缩、肺血管重塑的同时,也常伴随血液高凝状态[3],但其机制尚未阐明。
vWF是一种由血管内皮细胞合成的糖蛋白,血中vWF升高被认为是血管内皮细胞受损的标志以及血小板活化的重要指标。在低氧刺激下内皮细胞受损,引起vWF分泌到血浆中,vWF增高可促使血小板活化,并黏附于受损血管内皮,促使血栓形成。同时vWF作为凝血因子Ⅷ的载体蛋白,使凝血活性增高,血液形成高凝状态[7]。本研究显示,低氧各组与正常对照组相比vWF水平明显升高,说明低氧引起血管内皮细胞损伤,使得血管内皮细胞表达和释放vWF增加,易使血液形成高凝状态,增加肺血管阻力,加重PH。国外学者Kawut[8]对66例PH患者进行了回顾性队列研究,得出vWF可以独立预测PH患者的长期生存率。国内学者庄梅和韩国栋[9]在左向右分流型先天性心脏病患者研究中得出,血浆vWF表达与肺动脉收缩压呈正相关。同样,从我们建立的慢性低氧性PH大鼠肺动脉显微结构中看出,与正常对照组相比,低氧状态下肺动脉中膜明显增厚,管腔变窄,同时与正常对照组相比,低氧状态下大鼠血浆vWF水平明显升高,且vWF水平与其RVSP呈显著正相关,因测量RVSP可间接反映肺动脉压的变化[10-11],由此推测血浆vWF可能参与了慢性低氧性PH发生和发展的病理生理过程。
t-PA主要由血管内皮细胞合成并释放,能激活纤溶酶原,使之转变为纤溶酶,从而酶解纤维蛋白,防止纤维蛋白过度沉积。PAI-1为t-PA抑制剂,由血管内皮细胞、血小板和血管平滑肌细胞合成并释放,与t-PA形成1∶1复合物形式灭活t-PA,从而促进血液形成高凝状态[12]。t-PA、PAI-1均是纤溶系统中调节纤溶活性的重要因子,正常情况下,血浆t-PA和PAI-1处于动态平衡状态。本研究显示,低氧各组大鼠血浆t-PA(除低氧7 d组)、PAI-1水平与正常对照组相比均显著升高,这说明低氧造成血管内皮细胞受损,促使t-PA、PAI-1释放入血,而血浆t-PA水平在低氧7 d降低可能与作为其抑制物的PAI-1在低氧7 d明显增加有关[13]。之前有研究认为血管内皮细胞t-PA与PAI-1的比值可以反映血液的纤溶状态[14],单纯靠某一指标判断机体的纤溶状态较为片面,故采用t-PA/PAI-1的比值来判断纤溶状态更为可靠。我们的实验数据从t-PA/PAI-1的比值得出低氧各组大鼠血浆t-PA/PAI-1的比值水平较对照组均显著降低,说明PAI-1增高较t-PA增高更为明显,同时从慢性低氧性PH大鼠肺动脉显微结构中看出,与正常对照组相比,低氧状态下肺动脉血管腔变窄,中膜明显增厚,且低氧状态下大鼠血浆PAI-1水平与正常对照组相比也明显升高,说明PAI-1作为促凝因子可能刺激血管中膜平滑肌细胞增殖、导致中膜增厚等参与了PH发生和发展过程[15]。Sage等[16]曾在结扎猪左肺动脉所致肺缺血再灌注动物模型中发现肺动脉内皮细胞出现凋亡,继而引起肺水肿与持续性PH,PAI-1的表达量与之病情严重程度相关。肖谋等[17]在先天性心脏病合并PH患者的研究中也得出PH患者血中PAI-1浓度与正常者相比明显升高,且与肺动脉压呈正相关。同样,本研究也观察到大鼠血浆PAI-1水平与RVSP呈正相关,由此推测PAI-1也可作为反映低氧性PH血流动力学变化的生化学指标。
PC是一种由肝脏合成的维生素K依赖性糖蛋白,在人体内被凝血酶-血栓调理蛋白复合物激活后形成活化的PC,继而灭活因子Ⅴa和Ⅷa,也可促使血管内皮释放纤溶酶原激活物,发挥抗凝血和促纤溶作用[18]。本研究显示,与正常对照组相比,低氧暴露3 d、14 d、21 d组大鼠血浆PC水平显著降低,说明低氧致体内抗凝及纤溶系统发生紊乱,引起血液高凝状态,而低氧7 d组血浆蛋白PC水平显著升高,推测可能是由于机体对血浆vWF、PAI-1水平在低氧7 d达高峰的一种代偿性反应。
综上,本研究成功复制慢性低氧性PH大鼠模型,实验数据显示慢性低氧诱导的PH大鼠血浆vWF、PC、t-PA、PAI-1的水平明显变化,说明慢性低氧性PH会影响凝血纤溶系统,同时本研究结果还提示血浆vWF和PAI-1可能参与了慢性低氧性PH发生和发展的病理生理过程。
利益冲突所有作者均声明不存在利益冲突
