缺氧环境通过HIF⁃1α/YAP信号促进大鼠生长板软骨细胞表型维持
2019-04-10李晓娟李浩马永壮闫吉元张俊马天刘朝旭杨勇任晔吴华
李晓娟 李浩 马永壮 闫吉元 张俊 马天 刘朝旭 杨勇 任晔 吴华
软骨组织是一种特殊形式的结缔组织,不含神经纤维、血管及淋巴管,并受各种内分泌、旁分泌激素及复杂的局部信号环路的调控[1]。氧是细胞新陈代谢的重要能量来源,组织中所需要的氧主要依靠血管运输。由于软骨组织无血管,因此在软骨组织中氧分压较其他组织低,在生理条件下软骨细胞对低氧表现出良好的适应能力。然而在体外细胞实验中,软骨细胞在培养过程中难以保持其表型的稳定性而出现包括成纤维样改变、细胞外基质成分的大量丢失等[2],从而给软骨细胞的研究带来了很大的困难,这也是软骨组织工程中自体软骨移植应用的主要缺点之一。其中生长板软骨细胞在缺氧微环境中如何维持正常的生理功能,及其涉及信号通路尚未完全明了。
缺氧诱导因子-1(hypoxia inducible factor⁃1,HIF⁃1)是由氧调节性的α亚基和恒定表达的β亚基组成的转录因子。HIF⁃1α是软骨细胞对缺氧反应中重要的介导因子,并可上调一系列细胞因子从而介导软骨细胞分化、增殖、迁徙等,其中包括血管内皮细胞生长因子,对维持软骨细胞的稳态和功能具有重要意义[3]。
Yes相关蛋白(Yes⁃associated protein,YAP)是组织稳态、器官发育和肿瘤形成的核心调控因子。当经典的Hippo信号被激活,哺乳动物Ste20类似蛋白激酶 1/2(mammalian Ste20 like protein kinase1/2,MST1/2)被磷酸化并与salvador相互作用磷酸化大肿瘤抑制同源体(large tumor suppressor homologue,LATS1/2)激酶,磷酸化的LATS1/2激酶被激活,激活后的LATS1/2激酶磷酸化下游的YAP致使YAP失活。磷酸化Yes相关蛋白(p⁃Yes⁃associated protein,P⁃YAP)与14⁃3⁃3结合并被蛋白酶体泛素化降解。去磷酸化的YAP入核并主要与TEA结构域转录因子(TEAD)家族转录因子相互作用而诱导目标基因的表达[4,5]。YAP1是软骨祖细胞增殖和维持所必须的,并能够促进早期软骨细胞的增殖[6]。YAP1可通过抑制Ⅹ型胶原α链(Collagen10α1,Col10α1)表达和与 Runt相关转录因子 2(runt⁃related transcription factor 2,Runx2)相互作用从而抑制软骨细胞肥大。但是,YAP在生长板软骨细胞缺氧条件中的作用尚有争议。
考虑到YAP参与软骨细胞的发育、分化,我们猜测YAP可能通过与HIF⁃1α相互作用从而参与缺氧条件下软骨细胞的分化。在此研究中,我们利用氯化钴干预以模拟体外缺氧微环境,探索在体外实验中氯化钴模拟的缺氧微环境是否能够促进YAP的激活,并且是否能够促进软骨表型的维持。进一步探索体外实验中氯化钴模拟的缺氧微环境对软骨细胞的影响作用中YAP与HIF⁃1α之间的关系。
材料与方法
一、主要实验试剂、材料和设备
磷酸盐缓冲液(phosphate buffer saline,PBS,武汉博士德公司,中国),胰酶(Gibco,美国),二型胶原酶(Invitrogen,美国),胎牛血清(fetal bovine serum,FBS,Gibco,美国),青链霉素(100 U/ml penicillin G sodium,100 μg/ml streptomycinsulfate,Gibco,美国),Dulbecco's Modified Eagle Medium/Ham's F⁃12(DMEM/F⁃12,HyClone,美国),细胞计数试剂盒-8(CCK⁃8,武汉博士德公司,中国),氯化钴(Thermo Fisher,美国),成软骨培养基(赛业公司,美国),HIF⁃1αsiRNA(广州锐博公司,中国),lipo2000(Thermo Fisher,美国),Opti⁃MEM培养基(Gibco,美国),蛋白酶抑制剂(武汉博士德公司,中国),磷酸酶抑制剂(武汉博士德公司,中国),RIPA裂解液(武汉博士德公司,中国),硝酸纤维素薄膜(polyvinylidene fluo⁃ride,PVDF,Millipore,Billerica,美国),ECL发光液(Thermo Pierce,美国),培养箱(21%O2,74%N2,5%CO2,饱和湿度,Thormo公司,美国),Bio⁃Rad曝光机(Hercules,美国),酶标仪(Eppendorf公司,德国),抗体:YAP(#14074,Cell Signaling Technology,美国),Ⅱ型胶原(Collagen 2,Col2)(ab34712,Abcam,英国),HIF⁃1α(ab2185,Abcam,英国),β⁃actin(BM5180,武汉博士德公司,中国)。
二、分离和培养软骨细胞
生长板软骨细胞取自7日龄的SD大鼠。所有动物规程遵从我院伦理委员会相关规定。SD大鼠麻醉后颈椎脱臼法处死,软骨取自股骨远端及胫骨近端生长板软骨组织,用PBS漂洗后切碎至1~3 mm3大小,用0.25%胰酶消化30 min,随后用0.1%二型胶原酶37℃消化8 h。PBS漂洗后离心收集细胞,并用含10%FBS和1%青链霉素的DMEM/F⁃12培养基重悬细胞后种入细胞培养瓶中。将细胞置于培养箱中培养,每2天更换培养基。当细胞达到80%融合时,胰酶消化传代,第3代细胞用于本实验。
三、氯化钴干预形成缺氧环境
首先将软骨细胞(5 000细胞/孔)接种到96孔板中。细胞黏附24 h后,用不同浓度的氯化钴培养基(0、50、100、150、200 μmol/L)处理细胞24 h。
(一)细胞活性实验
通过使用CCK⁃8细胞计数试剂盒分析细胞活力。细胞干预完成后,在每孔中加入100 μl培养基和10 μl的CCK⁃8溶液。在37 ℃下再温育1 h后,酶标仪测定其在450 nm处的吸光度。
(二)阿利新蓝染色
将2×106个大鼠生长板软骨细胞重悬于10 μl的培养基中,随后将其种入6孔板中,放置培养箱中稍稍干燥后按分组加入2 ml培养基:①对照组:普通培养基;②成软骨培养基组:成软骨培养基;③氯化钴干预组:氯化钴浓度为10-5mol/L的普通培养基;④成软骨培养基+氯化钴组:含10-5mol/L氯化钴的成软骨培养基。细胞培养干预7 d后进行阿利新蓝染色。
(三)Western blotting
1.浓度梯度实验 细胞干预完成后进行West⁃ern blotting实验,检测Col2、YAP和HIF⁃1α蛋白的表达。干预后的细胞用预冷的PBS漂洗后,用含1%的蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液裂解软骨细胞30 min,12 000 r/min,4℃离心,收集上清后用BCA法进行蛋白定量。取20 μg蛋白进行聚丙烯酰胺凝胶电泳,随后将分离的蛋白转至硝酸纤维素薄膜上。将膜用5%脱脂奶粉封闭1 h后用相应抗体4℃孵育过夜。三乙醇胺缓冲盐+Tweenzo溶液(tris⁃buffered saline and tween 20,TBST)洗漂洗后室温下孵育辣根过氧化物酶结合的二抗1 h,再次TBST漂洗后应用ECL发光液,Bio⁃Rad曝光机下曝光。β⁃actin作为内参。
2.时间梯度实验 根据浓度梯度的实验结果,选取最佳浓度的氯化钴培养基干预软骨细胞不同的时间梯度(0、12、24、36和48 h),然后进行Western blotting实验,测量Col2、YAP和HIF⁃1α蛋白的表达,方法同上。
3.siRNA干预 当生长板软骨细胞融合达50%左右时弃原培养基,加入2 ml含50 nmol/L HIF⁃1αsiRNA(或 50 nmol/L YAP siRNA)和 lipo2000的Opti⁃MEM培养基进行转染6 h。转染完成后,用100 μmol/L氯化钴干预24 h,测量Col2、YAP和HIF⁃1α蛋白的表达。
四、统计学分析
所有实验重复3次,结果以均数±标准差()表示。统计学分析采用SPSS 19.0统计软件(IBM公司,美国),两组间比较采用独立样本t检验,多组间比较采用检验One⁃wayANOVA,P<0.05表示差异有统计学意义。
结 果
一、氯化钴对软骨细胞的毒性检测
如图1所示,CCK⁃8结果显示不同浓度的氯化钴(50、100、150、200 μmol/L)对软骨细胞活性并没有明显的影响。

图1 氯化钴对软骨细胞细胞活性作用
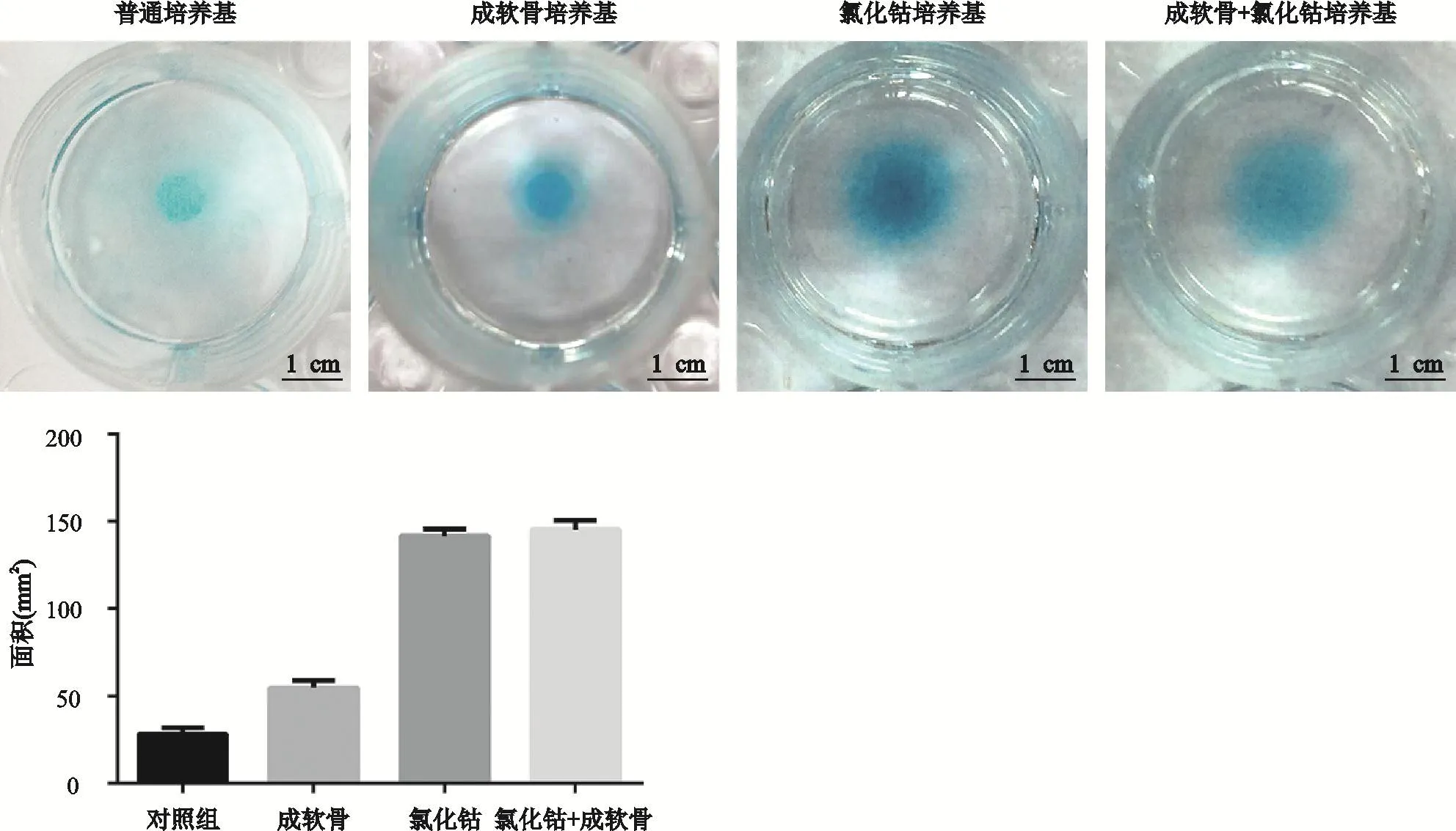
图2 氯化钴促进大鼠生长板软骨细胞细胞外基质表达
二、软骨细胞细胞外基质的合成
如图2所示,根据软骨细胞微团大小可以发现,各组中软骨细胞微团均被染成蓝色;氯化钴培养基组微团大小较对照组明显增加。结果提示,氯化钴模拟的体外缺氧环境能够促进大鼠生长板软骨细胞细胞外基质的合成。
三、成软骨特异性标志物的表达
图3的Western blotting结果显示,氯化钴能够明显上调软骨细胞中Col2蛋白水平的表达,且浓度为100 μmol/L时效果最为明显。因此我们随后应用浓度为100 μmol/L的氯化钴刺激软骨细胞不同的时间长度(0、12、24、36、48 h),并用Western blotting方法再次检测Col2的表达变化。结果显示,100 μmol/L的氯化钴能够有效促进软骨细胞中Col2蛋白水平表达,并且呈时间依耐性。
四、大鼠生长板软骨细胞HIF⁃1α和YAP的表达
图3的Western blotting结果显示,在应用不同浓度的氯化钴刺激后,YAP蛋白表达水平明显上调,且在100 μmol/L浓度时最为明显,但是当氯化钴浓度达200 μmol/L时YAP的表达出现了下调。HIF⁃1α的表达水平变化同YAP一致。
应用100 μmol/L氯化钴刺激后,YAP蛋白上调明显,于24 h时到达顶峰,随后表达出现了下调。HIF⁃1α蛋白表达变化与YAP保持高度一致。
五、HIF⁃1/YAP信号参与促进软骨细胞表型维持
应用siRNA下调氯化钴刺激下大鼠生长板软骨细胞中HIF⁃1α表达后,图4 Western blotting结果显示,下调HIF⁃1α后,YAP表达也出现下调,并且Col2表达水平同样出现了下调。随后我们应用siRNA下调YAP表达后检测HIF⁃1α蛋白水平变化发现,下调YAP的表达对HIF⁃1α蛋白水平的表达并无明显影响。结果说明,缺氧促进的大鼠生长板软骨细胞表型维持中,HIF⁃1α可能位于YAP的上游。
讨 论

图3 氯化钴上调软骨细胞Col2、HIF⁃1α和YAP蛋白的表达

图4 氯化钴通过HIF⁃1α/YAP信号促进软骨细胞表型维持
软骨组织中只含有软骨细胞这一种组织细胞类型,其所需的氧主要来源于滑液。软骨细胞可以产生维持软骨细胞外基质平衡所需的物质,包括胶原(主要为Col2)和蛋白多糖(主要为聚集蛋白多糖)。研究表明,在体内软骨细胞长期处于低氧微环境中,于体外培养时多处于相对于其生理状态下的高氧环境中,多次传代后软骨细胞形态会出现改变,同时丢失软骨特性型标记物。因此,研究软骨细胞在缺氧微环境中的细胞反应对研究软骨细胞的生理功能至关重要。本实验中我们利用氯化钴干预软骨细胞以模拟体外的缺氧微环境。
HIF是存在于哺乳动物细胞中一类介导低氧适应反应的转录因子,是一种异源二聚体转录因子,由氧调节性的α亚基和恒定表达的β亚基组成的转录因子。HIF⁃α为功能性亚基,决定HIF的活性,受细胞内氧浓度的调节[3]。HIF⁃β为结构性亚基,在细胞内稳定表达,不受氧浓度的影响和调节。在常氧条件下,HIF⁃α与VHL(Von Hippel⁃Lindau)蛋白结合,并被泛素连接酶E3受体识别,形成E3泛素连接酶复合物从而被泛素化降解。当氧浓度降低时,HIF⁃α通过抑制HIF抑制因子或与脯氨酸羟化酶作用增加稳定性和转录活性,并与HIF⁃β形成二聚体结构,转移至细胞核中调节下游基因的表达[3]。HIF⁃1在软骨正常生长发育、能量代谢、存活过程中都发挥了重要作用[7⁃9]。常氧条件下Co2+能够稳定HIF⁃1α活性并诱导下游基因的表达[10]。在此研究中我们应用不同浓度的氯化钴干预生长板软骨细胞24 h后发现,HIF⁃1α蛋白表达水平上调。且100 μmol/L氯化钴刺激软骨细胞不同的时间长度后发现,HIF⁃1α蛋白表达水平明显上调。说明了常氧条件下Co2+除了能够有效地稳定HIF⁃1α活性,并且呈剂量和时间依赖性。细胞缺氧状态下,HIF⁃1α在能量供应、红细胞生成、血管再生及细胞存活等方面发挥重要作用。体外的病理性缺氧能够促进神经干细胞(neu⁃ral stem cell,NSC)的增殖,并上调HIF⁃1α表达,激活Wnt信号通路。沉默HIF⁃1α可降低β⁃catenin的核转位和cyclinD1的表达,并抑制NSC的增殖[11]。于体外培养中敲除生长板软骨细胞HIF⁃1α基因时,软骨细胞增殖能力明显减弱并出现大量死亡[12,13]。于体内实验中特异性敲除软骨细胞内HIF⁃1α基因时,软骨细胞不能维持正常的代谢功能,胎鼠因为支气管塌陷和肋骨发育畸形出现呼吸功能障碍而于出生前死亡[14]。当肢芽间充质干细胞缺乏HIF⁃1α可导致软骨组织形成延迟[13,15]。HIF⁃1α能够抑制缺氧环境下终板软骨细胞的凋亡,从而对终板软骨细胞起到保护作用。缺氧环境能通过HIF⁃1α促进Col2、蛋白多糖的表达从而促进软骨细胞的合成代谢[16]。在此实验中,当我们利用氯化钴上调常氧条件下HIF⁃1α的表达时,Col2的表达也相应的出现了上调。这似乎表明缺氧所致Col2的上调与缺氧条件下HIF⁃1α的激活有关。且有研究表明,体外培养的人间充质干细胞予以缺氧或者HIF⁃1α刺激时,Col2、蛋白多糖表达增加,Col10合成减少。当去除HIF⁃1α刺激时Col2、蛋白多糖表达下降,Col10合成增加[17]。并且在软骨炎中,HIF⁃1α能够保护软骨细胞免受炎性因子的攻击[18]。
Hippo信号通路在许多的器官中起到控制器官的大小和组织再生的作用,并具有调控细胞的增殖分化等作用[4,19]。YAP被证实参与调节各种细胞过程,包括机械力传导[20],干细胞分化[21]等。但Hippo信号通路在软骨细胞分化和骨修复中的作用仍然不甚明了。YAP1作为Hippo信号通路中的核心转录调控因子能够直接调节性别决定区Y型高迁移率族蛋白 6(sex⁃determining region Y⁃type high mobility group box protein6,SOX6)的表达而促进软骨细胞增殖,Teads是YAP1结合DNA所必须的转录因子,YAP1/Teads复合体直接诱导SOX6的表达,并且Teads与YAP1的结合是YAP1调控SOX6表达所必须的,从而YAP1介导的软骨细胞增殖其中一部分是通过SOX6传导的[6],并通过与Runx2的相互作用抑制Col10α1的表达而抑制软骨细胞成熟[22]。在胎鼠的生长板软骨中YAP1在静息层和增殖层表达明显,而P⁃YAP1在肥大层表达明显,并且肥大层中Col10α1和Runx2表达明显。YAP1可抑制骨骼发育和生长过程中的软骨细胞成熟及软骨内成骨。YAP1是软骨祖细胞增殖和维持所必须的。YAP1的过表达能够增强软骨细胞增殖能力但是会抑制其分化,并且YAP1过表达能够激活Wnt/β⁃catenin信号通路,Dickkopf⁃1和β⁃catenin siRNA可部分减弱YAP1过表达对软骨细胞系ATDC5细胞分化的影响,因此YAP1在间充质干细胞(mesenchyma stem cell,MSCs)成软骨分化过程中起负性调节作用,下调YAP的表达有助于MSCs成软骨分化[23]。但关于缺氧与YAP之间相互作用的研究较少,尤其是关于在软骨细胞中缺氧与YAP之间相互作用的报道尚未见到。有研究表明缺氧能够诱导肿瘤细胞系HEK293T,HeLa和MDA⁃MB⁃231中YAP磷酸化并下调总YAP的表达[24]。而在另外一份研究中表明缺氧能够使Hippo信号失活,YAP表达上调并与HIF⁃1α形成复合物,从而稳定HIF⁃1α在体内肿瘤中的表达[25]。在肝窦内皮细胞中干扰YAP显著下调HIF⁃1蛋白质表达[26]。在前列腺癌中缺氧可通过增减细胞核中YAP表达和抑制P⁃YAP水平来提高YAP的活性[27]。
在此研究中,我们利用HIF⁃1α的激动剂氯化钴于常氧条件下刺激软骨细胞后发现,氯化钴能够有效促进软骨细胞细胞外基质表达。并且利用不同浓度氯化钴刺激软骨细胞时发现软骨细胞内Col2表达明显上调,并且这种上调呈时间和浓度依耐性。氯化钴同时能够上调软骨细胞中YAP的表达,且具有浓度和时间依赖性。当氯化钴浓度超过一定值或者干预超过一定时间长度时,这种促进作用出现了明显的下调。与此同时,当下调HIF⁃1α的表达后氯化钴促进YAP表达的上调出现减弱。因此我们推测氯化钴模拟的缺氧环境能够通过HIF⁃1α/YAP信号促进软骨细胞软骨表型的维持。但具体为哪种亚型软骨细胞在此过程中起到主导作用有待进一步细胞及动物实验研究。
氯化钴能够促进YAP的激活,并且是HIF⁃1α依赖性的,下调HIF⁃1α的表达能够抑制氯化钴所致的YAP的激活和软骨细胞表型的维持。最重要的是,我们的研究表明缺氧环境通过HIF⁃1α和YAP之间相互作用从而最终影响软骨细胞表型的维持。这也许可为软骨组织工程中软骨细胞制备提供一个新的思路或靶点。但本实验存在缺乏对HIF⁃1α和YAP结合位点研究,及缺乏体内实验部分等众多不足。
