模拟氮沉降对常绿阔叶林6种植物氮同化的影响
2019-04-09吴淑华王佳新张世柯王俊曾阳金李远球刘楠
吴淑华 ,王佳新 ,张世柯 ,王俊,曾阳金,李远球,刘楠*
1. 广东省应用植物学重点实验室/中国科学院华南植物园,广东 广州 510650;2. 广东石门台国家级自然保护区管理局,广东 英德 513000;3. 中国科学院大学,北京 100049
大气氮沉降是一个复杂耦合的过程,指含氮化合物由地表的排放源排放到大气中,在大气中经过混合、扩散、转化和漂移,直到从大气中移除后重新返回地表(或植物冠层)的过程(Goulding,1990)。大气氮沉降有干沉降和湿沉降两种形式,干沉降主要包括NO、N2O和NH3等气态含氮化合物,湿沉降则主要包括NO3-和NH4+(Wedin et al.,1996)。自 20世纪中期以来,大量燃烧化石燃料,生产和使用含氮肥料,以及集约化畜牧业发展迅速,导致全球范围内大气氮沉降速率急剧增加(Galloway et al.,2008;Liu et al.,2013;宁应之等,2018)。中国已发展成为世界第三大氮沉降地区(仅次于欧洲和北美),随着工业化和城镇化的发展,氮沉降还在继续增加(Liu et al.,2011;Jia et al.,2014;Zhan et al.,2014)。氮沉降加剧严重影响森林生态系统的健康(Isbell et al.,2011;Chen et al.,2013),对陆地生态系统产生一系列生态风险,如土壤酸化(Lu et al.,2014)、生物多样性丧失(Sala et al.,2000;Bobbink et al.,2010;Porter et al.,2013;Simkin et al.,2016a;Simkin et al.,2016b)、植物生产力降低(Isbell et al.,2013;Yu et al.,2016)、森林植物氮素分配失调等。
大气圈中含量最丰富的元素为氮素,它是植物生长所需的大量元素,被称之为生命元素(Cook,2015)。硝态氮和铵态氮是植物可直接吸收和利用的2种有效态氮源。氮素同化途径主要包括NR/NiR途径和GS/GOGAT途径。首先,硝酸还原酶(NR)将 NO3-还原为 NO2-,亚硝酸还原酶(NiR)又将NO2-还原为 NH4+(Miller et al.,2005)。随后 NH4+在谷氨酰胺合成酶(GS)和谷氨酸合酶(GOGAT)的催化下进一步被合成谷氨酰胺(Gln)和谷氨酸(Glu)(Lea et al.,1998)。合成后的氨基酸进一步转化为蛋白质、叶绿素、维生素、核酸、各种细胞器膜组分及细胞壁物质(Kusano et al.,2011)。显然,外源单输入(如氮沉降)会对森林植物上述氮同化过程产生直接影响。
氮沉降已被视为全球性问题,氮沉降对森林生态系统的影响及其机理的研究也成为全球研究热点,目前国际上有关温带地区氮沉降对森林生态系统影响的研究较多,且大多集中在含氮化合物、光合产物和生物量的观测(Vitousek,1994;Chapin et al.,2000;Sala et al.,2000;Edison et al.,2015),而还未就氮沉降对亚热带常绿阔叶林优势植物氮代谢的干扰过程和机理进行分析。亚热带是中国社会、经济和文化的重要区域,在这一区域开展氮沉降对常绿阔叶林优势森林植物氮同化的影响的研究十分迫切且有重要意义。
1 研究样地概况、材料及方法
1.1 研究样地概况
本研究依托中国科学院华南植物园在广东石门台国家级自然保护区(东经 113°05′-113°31′,北纬 24°22′-24°31′)建成的林冠模拟氮沉降野外控制试验平台(Canopy Addition of Nitrogen,CAN),通过林冠及林下模拟施氮处理(定量喷施NH4NO3溶液),阐明大气氮沉降增加对森林生态系统结构和功能的影响。
石门台国家级自然保护区是广东省面积最大(33555 hm2)、植被保存较好的森林生态系统自然保护区。该区属南亚热带季风型气候,具有南亚热带常绿阔叶林的典型性和过渡性、珍稀性和自然性,对区域生态环境有重大影响。年均温为20.8 ℃,平均降雨量超过2000 mm。保护区内常绿阔叶林林龄约50年,冠层高度约26 m,林冠郁闭度约92%,乔木层、林下灌木和草本植物种类丰富。保护区的主要植被是天然的次生常绿阔叶林,森林植被以热带亚热带的代表性科属为主,优势科包括壳斗科(Fagaceae)、山茶科(Theaceae)、樟科(Lauraceae)、杜英科(Elaeocarpaceae)、木兰科(Magnoliaceae)、鼠刺科(Escalloniaceae)、交让木科(Daphniphyllaceae)、金缕梅科(Hamamelidaceae)、冬青科(Aquifoliaceae)、安息香科(Styracaceae)、杜鹃花科(Ericaceae)及梧桐科(Sterculiaceae)等。该群落的优势种与优势科相适应,基本上为壳斗科、山茶科、樟科、杜英科等热带亚热带成分的种类,这些优势种类主导着石门台自然保护区的森林群落类型与结构。
1.2 实验设计
林冠模拟氮沉降野外控制试验采用完全随机区组设计,样地的设置综合考虑了植被、坡向和坡度等多种因素,包含4个区组(4个Block代表4个重复),每个区组随机设置5个样方,对应5种不同处理,共20个样方。样方为半径17 m的圆形,为防止处理间的干扰,各样方之间留有约20 m的缓冲带,中间加装深度为1 m的PVC隔离板(图1)。每个圆形样方中心有一座35 m高三角形铁塔,一共8座,用于支撑变频调速恒压喷灌设备喷洒处理溶液(NH4NO3溶液)。实验样地于2012年10月建成,经全面调试以后,于2013年4月启动实验处理,处理时间为每年的4-10月(植物生长季),每年共喷洒7次。实验处理包括:林冠施氮CN25(N 25 kg·hm-2·a-1)、林冠施氮 CN50(N 50 kg·hm-2·a-1)、林下施氮 UN25(N 25 kg·hm-2·a-1)和林下施氮 UN50(N 50 kg·hm-2·a-1)。对照样方(CT),不喷施N溶液,但喷施相应的水量。
1.3 实验对象
根据该实验样地生物多样性调查数据,分析每个群落中所有植物的重要值,以重要值占前80%的物种为优势物种。
植物具有多种获取氮的途径:土壤N的吸收、大气N2的固定、干湿沉降N的吸收等(赵平等,1998)。因此,植物可以通过根吸收土壤中的铵盐(NH4+)和硝酸盐(NO3-)及部分有机氮(Killham,1994)。同时,也可以通过冠层叶片吸收气态氮污染物及湿沉降中的氮,可达到全部氮来源的10%-30%(Krupa,2003)。由于本研究平台分别通过林冠喷施(首先接触大乔木的冠层叶片)及林下喷施(主要作用于土壤表层)外源NH4NO3模拟氮沉降,决定了不同层级森林优势树种对外源氮素的主要吸收途径(冠层叶片和根部)。因此,本研究选取了在各个样方中皆有分布的6种优势树种(表1)作为研究对象,包括3个大乔木树种(锥栗Castanea henryi、荷木 Schima superba、鸭脚木 Schefflera octophflla)和 3个小乔木/灌木树种(罗伞 Ardisia quinquegona、柏拉木Blastus cochinchinensis、粗叶木Lasianthus chinensis)。
1.4 样品采集
生长季末,全年氮喷施结束后,于2016年10月进行样品采集。每个样方采集每种植物 3-6株成熟植物的当年生叶片,将采集的叶片放置于装有吸水纸巾的密封袋中,将密封袋放置于装有冰袋的密封箱中带回实验室。称质量分装后放在-80 ℃超低温冰箱中保存以待测定硝态氮和铵态氮含量以及氮同化相关酶活性。
1.5 硝态氮和铵态氮含量的测定

图1 石门台样地分布Fig. 1 plot distribution map of Shimentai

表1 研究对象Tabe 1 Research object
称取待测植物叶片0.1 g,放入2 mL离心管中,加入1 mL纯水,室温匀浆后,置于90 ℃恒温摇床中振荡30 min。待其冷却后,于12000 g下离心15 min(25 ℃),用移液枪吸取上清液进行硝态氮测定。在浓酸条件下,NO3-可与水杨酸发生反应,生成硝基水杨酸。硝基水杨酸在碱性条件下(pH>12)呈黄色,在一定的范围内,其颜色深浅与浓度成正比,故采用比色法测定硝态氮含量(张智良,2003)48。
称取待测植物叶片0.1 g,放入2 mL离心管中,加入1 mL提取液,室温匀浆后,于12000 g下离心15 min(25 ℃),用移液枪吸取上清进行测定。α-氨基酸与水合茚三酮溶液一起加热,经氧化脱氨后变成α-酮酸,酮酸进一步脱羧变成醛,水合茚三酮则被还原。在弱酸环境中,还原型茚三酮,氨与另一分子水合茚三酮反应,缩合生成蓝紫色物质,在580 nm处有吸收峰,从而测定铵态氮含量(张智良,2003)49。
1.6 氮同化相关酶活性的测定
NR活性的测定:称取0.1 g植物叶片,加入1 mL提取液,冰浴匀浆后于4 ℃、8000 g下离心10 min,取上清液,置冰上待测。NR可将NO3-还原成NO2-,在一定条件下,NO2-的生成量与 NR的活性呈正相关,因此以NO2-的生成量代表NR活性。在酸性溶液中,NO2-与磺胺形成重氮盐,重氮盐再与 α-萘胺偶联,形成紫红色的偶氮化合物,该偶氮化合物在540 nm有最大吸收峰,用分光光度计进行测定。酶活性定义:每小时每克鲜质量样品中催化产生1 μmol NO2-的量为1个NR活力单位(高俊凤,2006)61-62。
NiR活性的测定:称取0.1 g植物叶片,加入1 mL提取液,冰浴匀浆后于4 ℃、10000 g下离心10 min,取上清液,置冰上待测。NiR可将 NO2-还原为 NO,使样品中参与重氮化反应生成紫红色化合物的NO2-减少,即540 nm处吸光值的变化可反映叶片中NiR的活性。酶活性定义:每小时每克鲜质量样品还原1 µmol NO2-的量为1个酶活力单位(高俊凤,2006)63。
GS活性的测定:称取0.1 g植物叶片,加入1 mL提取液,冰浴匀浆后于4 ℃、8000 g下离心10 min,取上清液,置冰上待测。谷氨酰胺在ATP和Mg2+存在下,催化铵离子和谷氨酸合成谷氨酰胺;谷氨酰胺进一步转化为γ-谷氨酰基异羟肟酸,在酸性条件下与铁形成红色的络合物;该络合物在 540 nm处有最大吸收峰,可用分光光度计测定。酶活性定义:每克鲜质量样品在1 mL反应体系中每分钟使540 nm下吸光值变化0.01定义为一个酶活力单位(高俊凤,2006)64。
GOGAT活性的测定:称取0.1 g植物叶片,加入1 mL提取液,冰浴匀浆后于4 ℃、8000 g下离心10 min,取上清液,置冰上待测。催化谷氨酰胺的氨基转移到α-酮戊二酸,形成两分子的谷氨酸;同时NADH氧化生成NAD+,340 nm吸光度的下降速率可以反映GOGAT活性大小。酶活性定义:每克鲜质量样品每分钟消耗1 nmol的NADH定义为1个酶活力单位(高俊凤,2006)65。
1.7 数据处理
运用GraphPad Prism 7.00进行统计分析。采用单因素方差分析(One-way ANOVA)检验林冠喷氮或林下喷氮浓度梯度为0、25和50 kg·hm2·a-1对植物叶片硝态氮含量、铵态氮含量及NR、NiR、GS、GOGA酶活性的影响。P<0.05为显著,P<0.01为极显著。
2 结果
2.1 硝态氮和铵态氮
不同氮添加处理下,粗叶木、鸭脚木和荷木的硝态氮含量皆低于 500 μg·g-1,而柏拉木、罗伞和锥栗的硝态氮含量高达1000 μg·g-1,并且都呈现出显著性差异。在CN50和UN50处理下,柏拉木和罗伞的硝态氮含量较 CT显著降低,而 CN25和UN25无显著性差异。在林冠喷氮(CN25和CN50)和林下施氮(UN25和UN50)处理下,锥栗的硝态氮含量显著升高(图2A和图2B)。不同氮添加处理下,柏拉木叶片铵态氮含量最高,达250 μg·g-1,罗伞次之,其叶片铵态氮含量为 100 μg·g-1。粗叶木、锥栗、鸭脚木和荷木4种植物叶片铵态氮含量均低于 100 μg·g-1。在林冠(CN25 和 CN50)和林下(UN25和UN50)氮添加处理下,柏拉木的铵态氮含量均较CT显著升高(图2C和图2D)。
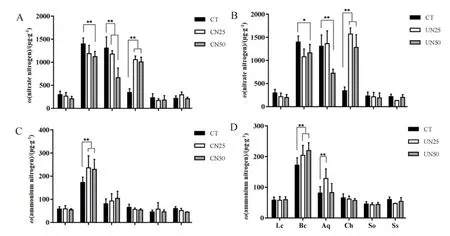
图2 氮添加处理对6种植物叶片硝态氮(A和B)和铵态氮(C和D)的影响Fig. 2 Nitrate nitrogen content (A and B) and Ammonium nitrogen content (C and D) of six plant leaves as affected by nitrogen addition
2.2 氮同化相关酶活性
粗叶木和罗伞的NR活性约为1 μg·g-1,其余4种植物较低。柏拉木、锥栗、鸭脚木和荷木的 NR活性约为2 μg·g-1(图3A、图3B)。柏拉木的NiR活性最低,约2 μg·g-1。其余5种植物的NiR活性约为6 μg·g-1(图3A、图3B)。在CN50处理下,粗叶木和罗伞的NR活性显著降低,锥栗的NR活性显著升高。在CN25处理下,柏拉木的NR活性显著升高(图3A)。在UN50处理下,柏拉木和锥栗的的NR活性显著升高(图3B)。柏拉木较叶片的NiR活性低于其他5种植物。在CN50处理下,粗叶木和柏拉木的 NiR活性显著升高,而荷木的NiR活性显著降低(图3C)。在UN25处理下,粗叶木的NiR活性显著升高,而罗伞的NiR活性显著降低。在UN50处理下,锥栗的NiR活性显著降低(图3D)。
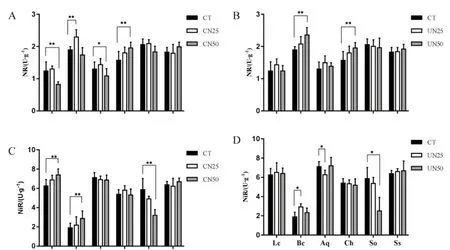
图3 氮添加处理对6种植物叶片硝酸还原酶(A和B)和亚硝酸还原酶(C和D)活性的影响Fig. 3 NR activity (A and B) and NiR activity (C and D) of six plant leaves as affected by nitrogen addition
6种植物的GS活性大致相同,其中粗叶木叶片GS活性最高,约为25 μg·g-1(图4A、图4B)。粗叶木、罗伞、锥栗、鸭脚木和荷木的GOGAT活性都低于 500 μg·g-1,而柏拉木 GOGAT活性高达1500 μg·g-1(图 3C、图 3D)。在 CN50 处理下,柏拉木叶片的 GS活性较CT显著降低。在 CN25处理下,荷木的GS活性较CT显著降低(图4A)。林下氮添加处理(UN25和 UN50)对 6种植物的GS活性无显著性影响(图4A)。在林冠氮添加处理(CN25和CN50)下,罗伞和锥栗的GOGAT活性显著升高(图4C)。在CN50处理下,罗伞和鸭脚木的GOGAT活性显著升高。在林下氮添加处理(UN25和UN50)下,锥栗的GOGAT活性显著升高(图4D)。
3 讨论
3.1 叶片中的硝态氮含量、NR活性和NiR活性对模拟氮沉降的响应
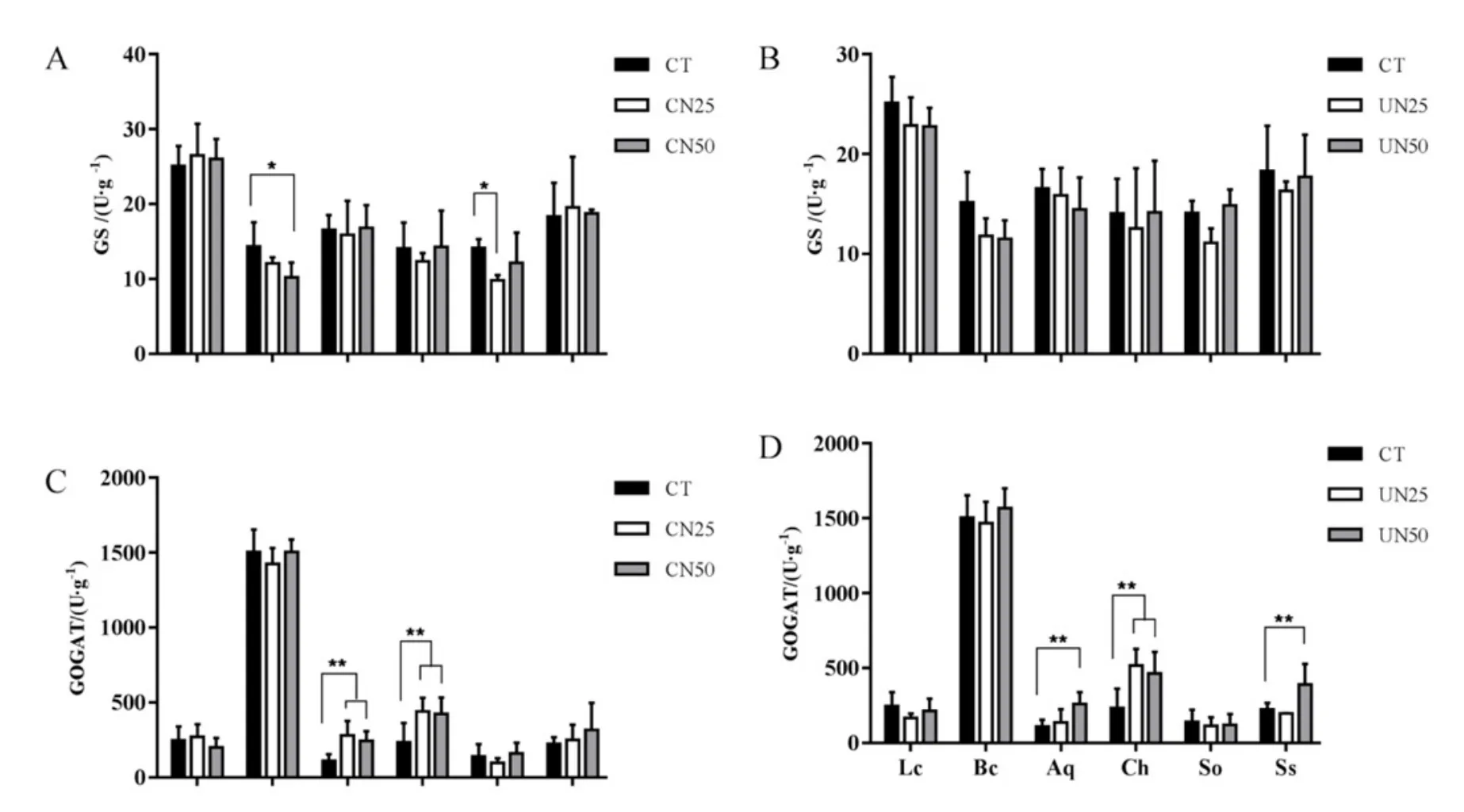
图4 氮添加处理对6种植物叶片谷氨酰胺合成酶(A和B)和谷氨酸合酶(C和D)活性的影响Fig 4. GS activity (A and B) and GOGAT activity (C and D) of six plant leaves as affected by nitrogen addition
植物中的氮主要以有机氮、硝态氮和亚硝态氮组成。其中,硝态氮和铵态氮是植物可直接吸收和利用的两种有效态的氮源(乔枫等,2018)。硝态氮在植物体内必须经NR作用还原为铵态氮后才能被吸收和利用(Marschner,2001)。当植物对硝态氮的吸收超过了其还原能力,致使进入植物体内的硝态氮不能及时被还原转化而出现大量累积。积累在植物体内的硝态氮,其中一大部分储存于液泡中,小部分存在于细胞质中。一般认为,液泡是硝态氮的储存库,细胞质则是硝态氮的代谢库(许长蔼等,1990)。NR和NiR对初级氮同化的控制起着十分重要的作用,并显著影响植物的生长发育(Hänsch et al.,2001)。NR和NiR皆为诱导酶,NR活性主要受底物NO3-诱导,NiR活性主要受底物NO2-诱导,但同时也受光照温度等多种因素的影响。本研究发现,在CN50和UN50处理下,柏拉木大量吸收硝态氮,从而诱导了NR活性升高,进而还原更多的硝态氮,导致其叶片硝态氮含量显著降低。但在CN25和UN25处理下,柏拉木的硝态氮则较少出现显著性变化。一般认为,25 kg·hm2·a-1施氮量为氮沉降的临界负荷值(Ye et al.,2018),过量的氮添加导致氮素流失,进一步导致群落植被组成发生变化(Vitousek,1994)。锥栗叶片中的硝态氮含量随着氮添加浓度的增加而呈梯度显著升高,这可能说明锥栗可最大限度地吸收硝态氮,NR活性虽在氮添加处理中显著增加,但NiR并无显著变化,硝态氮还原为铵的过程可能受阻。植物体内积累过多的 NO2-会影响植物的生长发育(Yamasaki,2000),因而氮沉降有可能会导致该物种的生长受到一定程度的抑制(Clark et al.,2013)。
3.2 叶片中的铵态氮含量、GS活性和GOGAT活性对模拟氮沉降的响应
虽然铵态氮和硝态氮都是植物的氮源,但在两种氮源可选择的情况下,不同植物对它们的相对吸收量存在着明显差异(周碧青等,2017)。这种差异受植物的种类、生育期、土壤溶液pH、2种氮源的浓度等多种因素的影响(Vitousek et al.,1986)。NH4+基本上不能以 NH4+形式被运输到叶片中,绝大部分在根部被同化,因而对叶片同化氨的酶的促进作用相对小一些。铵态氮的同化由 GS/GOGAT途径完成,该过程不仅消耗大量ATP,而且消耗大量的碳(Bao et al.,2014)。当铵态氮进入体内后,不能大量贮存,一旦超过其忍受量,便可导致叶片出现斑点、黄化等氨中毒现象(王宇通等,2010)。本研究发现,柏拉木CN50、UN50氮添加处理下,其叶内铵态氮含量显著升高而大量积累。本研究也发现,在氮添加处理下,柏拉木的叶片确实存在斑点、黄化现象。GS同NR一样,也是一种诱导酶,然而经铵态氮诱导(Miflin et al.,1980),GS活性未增反降,有研究表明,氮素水平过高时GS活性反而会下降(张智猛等,2008);GOGAT活性无显著变化,可能原因是即使NH4+被GS同化为谷氨酰胺,但由于细胞内分隔等原因使其不能有效地成
为GOGAT的底物(郑朝峰,1986)。本研究结果显示,氮添加处理下,罗伞、锥栗和鸭脚木GS活性无显著性变化,而GOGAT活性却显著增加,这可能是由于氮添加处理导致了氮同化水平的紊乱(Bao et al.,2014)。
4 结论
氮沉降影响常绿阔叶林优势植物叶片的氮代谢过程及氮同化关键酶活性,进而导致植物的生长发生变化。从氮代谢相关指标来看,氮沉降促进大乔木生长,抑制小乔木/灌木生长。亚热带常绿阔叶林优势种类皆具有一定的抵抗氮沉降能力,但不同类型植物对氮沉降有着不同的响应和忍耐范围,当超出一定的范围则会影响植物的生长,对其群落结构产生潜在的影响。
