茶树生长素合成酶基因YUCCA10克隆与表达分析
2019-04-09杨方慧夏丽飞蒋会兵孙云南田易萍梁名志陈林波
杨方慧,夏丽飞,蒋会兵,孙云南,田易萍,梁名志,陈林波*
(1.云南省农业科学院茶叶研究所/云南省茶树种质资源创新与配套栽培技术工程研究中心,云南 勐海 666201;2.云南省茶学重点实验室,云南 勐海 666201)
【研究意义】茶树(Camelliasinensis)是一种重要叶用经济作物,是多年生的异花授粉植物。茶树花属完全花,两性花,由花托、花萼、花冠、雄蕊群和雌蕊组成,是茶树繁育后代的重要器官,花器官的正常发育是茶树赖以繁衍的基础[1]。然而,作为叶用作物的茶树,开花结果会消耗大量的营养物质,导致茶叶产量和品质的下降。因此,开展茶树花发育的相关研究具有重要的理论意义和实践意义。【前人研究进展】生长素(即吲哚-3乙酸,indole-3-acetic acid, IAA)是调控植物诸多生物过程的重要内源激素,参与植物生殖发育的多个过程,包括雄蕊形成,花丝延伸,花粉发育及花药开裂等[2-3]。生长素在植物中的生物学功能主要通过其合成、运输及信号转导3个过程来实现,损害或抑制任何一个过程都会影响植物的正常生长发育以及对环境适应性的响应[4-5]。YUCCA基因家族是一类编码类黄素单加氧酶(flavin monooxygenase-like enzyme, FMO)基因,可催化吲哚丙酮酸直接转变成IAA,是色氨酸依赖的吲哚乙酸生物合成途径中的一个限速酶,在维持生长素含量方面起着关键作用[6-8]。目前,YUCCA同源基因已在多种植物中得到克隆,如草莓[9]、烟草[10]、拟南芥[2]和水稻[11]等,其中拟南芥中有11个YUCCA基因[2],水稻基因组中鉴定出7个类YUCCA基因[11]。【本研究切入点】本研究基于前期挖掘茶树花不育相关基因时[12],筛选出一条与YUCCA10基因高度同源的基因序列,通过对‘云茶1号’的全长转录组数据查找[13],获得含有完整编码的YUCCA10基因CDS序列,再对其序列进行克隆验证,并对YUCCA10基因的基本生物信息学特征进行分析。【拟解决的关键问题】探究YUCCA10基因在正常花和不育花中的表达规律,为深入探索YUCCA10基因和生长素合成对茶树花器官发育的调控机制提供理论基础。
1 材料与方法
1.1 试验材料
试验材料来源于云南省农业科学院茶叶研究所试验基地的正常茶树‘云抗10号’(目前利用该材料作为父本、母本均能获得子代)以及不育茶树,该不育茶树为利用‘佛香2号’与‘福鼎大白茶’杂交获得的一株不育花(参见文献[12,14])的花芽、花蕾、含苞待放花以及取正常茶树‘云抗10号’的芽、叶、茎、幼果、花瓣、雄蕊、雌蕊和不育花花瓣、雄蕊、雌蕊作实时荧光定量PCR检测用。
1.2 总RNA的提取及cDNA的合成
利用Trizol提取试剂盒,分别提取上述各样品的总RNA,通过跑1 %的琼脂糖凝胶电泳方法分析RNA的完整性以及是否有污染,利用Nanodrop检测RNA的浓度,将检测合格的总RNA样品利用M-MuLV第一链cDNA合成试剂盒合成cDNA用于基因验证,利用RevertAid Premium Reverse Transcriptase合成试剂盒合成cDNA用于实时荧光定量PCR分析。
1.3 CsYUCCA10基因CDS片段验证
根据查找获得的CsYUCCA10基因CDS序列设计4对特异引物(表1)进行CsYUCCA10基因的扩增验证,通过跑胶回收后,将纯化后的基因送到上海生工生物工程股份有限公司进行基因测序。
1.4 CsYUCCA10基因序列的生物信息学分析
在NCBI(http://www.ncbi.nlm.nih.gov/)网站进行BlastX比对分析;应用BioXM2.6软件进行氨基酸组成分析、多重序列比较和同源性分析;利用工具ExPASy (http://web.expasy.org/compute_pi/)在线分析蛋白的等电点和分子量;运用软件SOPMA预测蛋白的二级结构。
1.5 CsYUCCA10基因的qRT-PCR分析
以GAPDH基因(GE651107.1)为内参,利用验证后的CsYUCCA10基因序列,按照荧光定量PCR引物设计原则设计引物(表1)。参照BBI的SG Fast qPCR aster Mix定量PCR试剂和利用德国LightCycler 480进行荧光定量PCR反应。反应程序为:95 ℃预变性3 min后;采用变性温度95 ℃ 7 s,退火温度57 ℃ 10 s,延伸温度72 ℃ 15 s,45个循环;最后72 ℃延伸15 s。设实验重复3个,采用2-ΔΔCt法计算基因相对表达量。

表1 引物序列
2 结果与分析
2.1 CsYUCCA10基因CDS验证和序列分析
在前期利用数字表达谱技术筛选茶树不育基因时[12],获得一条与吲哚-3丙酮酸氧化酶(YUCCA10)基因高度同源的基因,该基因在‘福鼎大白茶’(父本花)和‘佛香2号’(母本花)中上调表达,在其杂交后代不育花中为下调表达。为了获得该基因完整编码序列,从‘云茶1号’全长转录组数据中查找到一条序列为1697 bp的CDS[13],通过NCBI中Blastx比对显示它具有YUCCA10完整的开放阅读框(ORF)。为了验证其全长,CDS设计4对特征引物进行扩增,经过高保真酶扩增(图1),分别将4对引物扩增的PCR产物回收测序拼接后,获得含有1137 bp的ORF(图2),编码379个氨基酸,命名为CsYUCCA10。

1:特征引物YUCCA-1F和YUCCA-1R扩增产物;2:特征引物YUCCA-2F和YUCCA-2R扩增产物;3:特征引物YUCCA-3F和YUCCA-3R扩增产物;M:DL 10 000 marker;4:特征引物YUCCA-4F和YUCCA-4R扩增产物1: Amplification product of characteristic primers YUCCA-1F and YUCCA-1R; 2: Amplification product of characteristic primers YUCCA-2F and YUCCA-2R; 3: Amplification product of characteristic primers YUCCA-3F和YUCCA-3R; M: DL 10 000 marker; 4: Amplification product of characteristic primers YUCCA-4F and YUCCA-4R图1 CsYUCCA10基因CDS扩增验证Fig.1 CDS amplification verification of CsYUCCA10 genes
2.2 CsYUCCA10基因的生物信息学分析
通过NCBI在线分析,该蛋白含有保守功能结构位点CzcO,属于 Pyr_redox_2超级家族(图3),利用在线工具ExPASy预测其理化性质,结果显示,该蛋白质的相对分子量为42.63 kDa,等电点8.88,说明该蛋白为碱性蛋白质。利用在线工具SOPMA预测CsYUCCA10蛋白的二级结构,含有α螺旋31.66 %,延伸链18.21 %,无规则卷曲42.48 %,β折叠7.65 %。
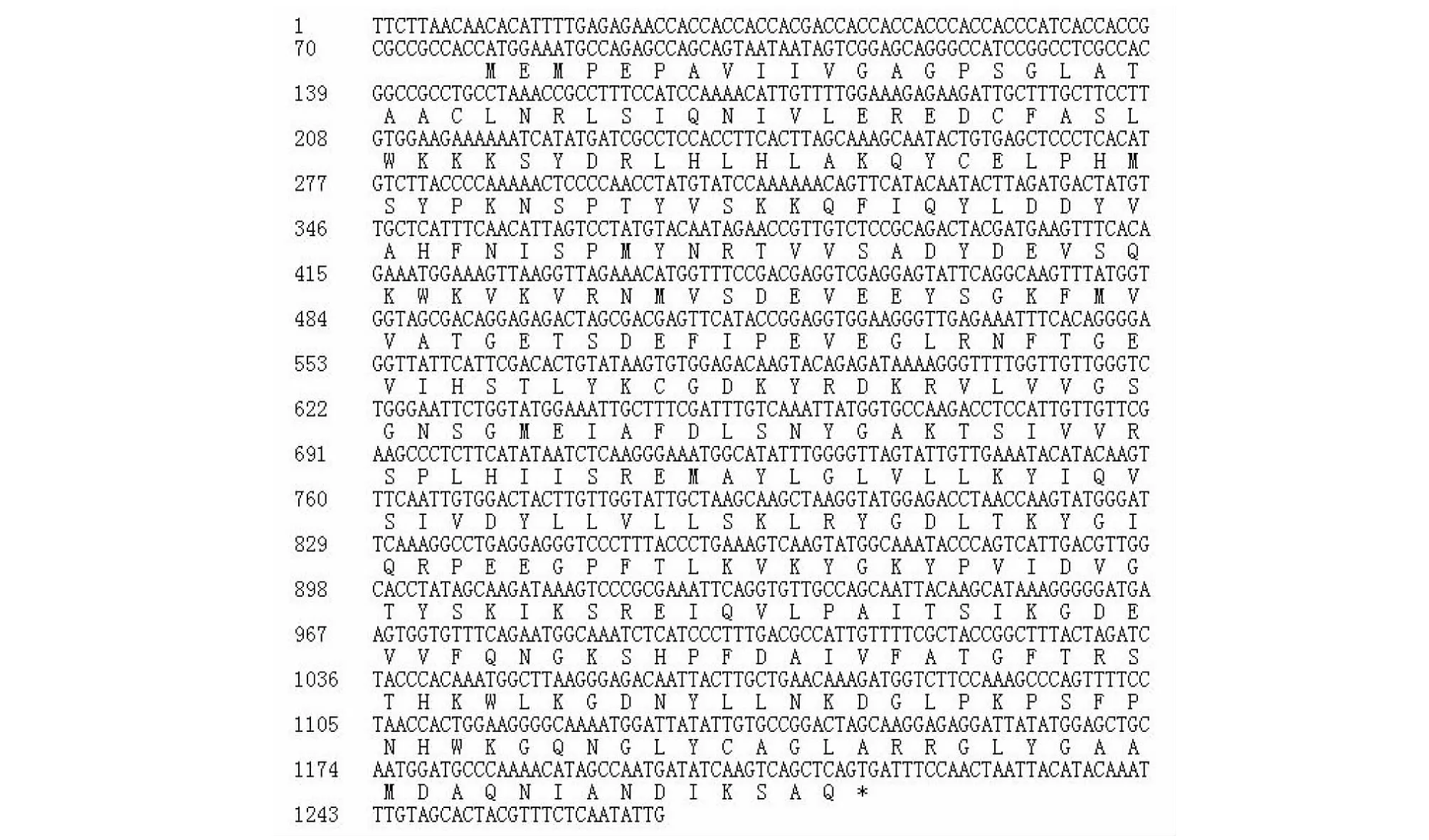
图2 CsYUCCA10 CDS与推导的氨基酸序列Fig.2 CDS sequences of CsYUCCA10 and their deduced amino acids
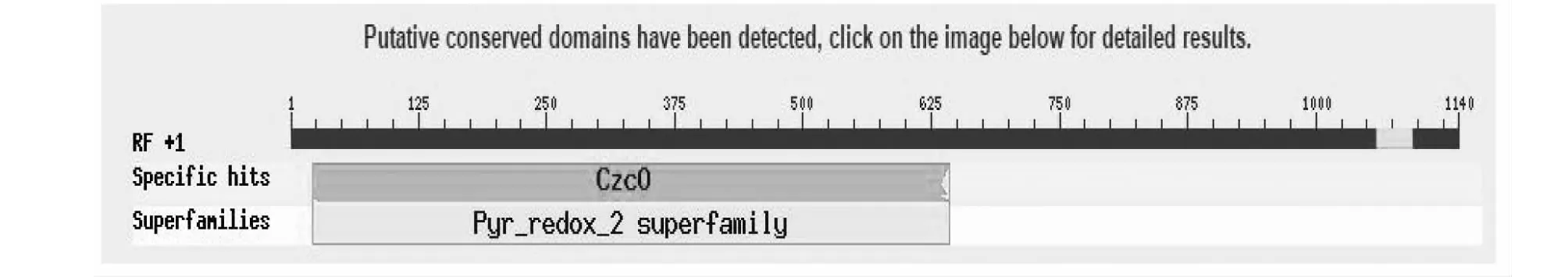
图3 CsYUCCA10蛋白功能性位点分析Fig.3 Functional site analysis of CsYUCCA10 protein
通过CsYUCCA10的氨基酸同源序列比对,发现与猕猴桃(Actinidiachinensisvar. Chinensis,登录号为PSR86028.1)相似性为81 %,与橄榄(Oleaeuropaeavar. Sylvestris,登录号为XP_022869081.1)的相似性为71 %,与葡萄(Vitisvinifera,登录号为XP_002269763.1)和莲(Nelumbonucifera,登录号为 XP_010245350.1)相似性为73 %。在拟南芥YUC基因家族蛋白中均含有黄素单加氧酶共有的还原型辅酶Ⅱ结合位点(NADPH-binding site)和FAD结合位点(FAD-binding site)[15]。分析发现茶树CsYUCCA10基因中的FAD-binding site序列为GAGPSG,NADPH-binding site序列为GSGNSG(图4),这2个位点保守域中甘氨酸残基对于辅因子结合和黄素单加氧酶活性是必须的。茶树CsYUCCA10具有保守甘氨酸残基,说明茶树CsYUCCA10具有其功能。
2.3 茶树CsYUCCA10基因的表达分析
采用实时荧光定量PCR技术,分析茶树CsYUCCA10基因在正常花和不育花不同发育期中的表达特征发现(图5),在正常花中随着花的生长发育表达量增加,花蕾为花芽的5.07倍,到含苞待放时表达最高,为花芽的6.1倍;然而在子代不育花中随着花的发育,表达呈减少趋势,花蕾期下降为花芽期的0.44倍,含苞待放期下降为花芽期的0.26倍;CsYUCCA10在正常花的花瓣、雄蕊、雌蕊均显著高于不育花(图6),在不育花中的表达量分别为正常花花瓣、雄蕊、雌蕊的0.13、0.04和0.07倍。这些结果说明了吲哚-3丙酮酸氧化酶基因在不育花中不能正常表达,均低于正常花,推测不育花中生长素不能正常合成,影响了花的发育导致不育。同时还分析了CsYUCCA10在正常茶树不同组织中的表达特性,发现在叶片和茎中表达量最高,在果中表达量最低,是叶的0.08倍(图7),说明CsYUCCA10的表达具有组织特异性。

方框A:FAD位点;方框B:NADPH位点Box A: FAD-binding site; Box B: NADPH-binding site图4 CsYUCCA10与其他YUCCA10基因的氨基酸比对Fig.4 Comparison of amino acid sequences of CsYUCCA10 with other reported YUCCA10 proteins
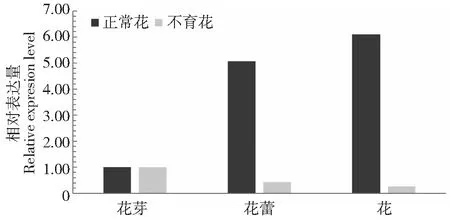
图5 CsYUCCA10在花不同发育期的表达特征Fig.5 The expressions of CsYUCCA10 in flowers of different development terms
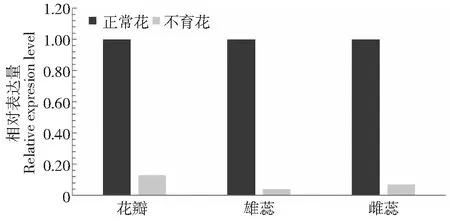
图6 CsYUCCA10在花不同组织中的表达特征Fig.6 The expressions of CsYUCCA10 in flowers of different tissues
3 讨 论
花是被子植物的繁殖器官,花的发育是植物繁衍后代的关键环节,受到多种因素的调控。对生长素的生物合成、信号转导以及极性运输相关突变体的研究表明,生长素在花器官的形成和发育中起着关键的调控作用[16-17]。植物中生长素的合成主要包括依赖色氨酸(Trp-dependent pathway)途径和非依赖色氨酸(Trp-independent pathway)途径,其中依赖于色氨酸的生长素合成途径是植物中主要的途径[15,18]。YUCs是依赖于色氨酸生长素合成途径中的关键基因,证明YUC基因家族在生长素的生物合成以及植物发育过程的作用证据来自于对拟南芥的yuc缺失突变体的研究。如拟南芥yuc2yuc6双突变体,其表现为雄蕊发育缺陷,而yuc1yuc4双突变体表现为花器官发育受阻,且没有完整的花器官,全部败育[2,19]。
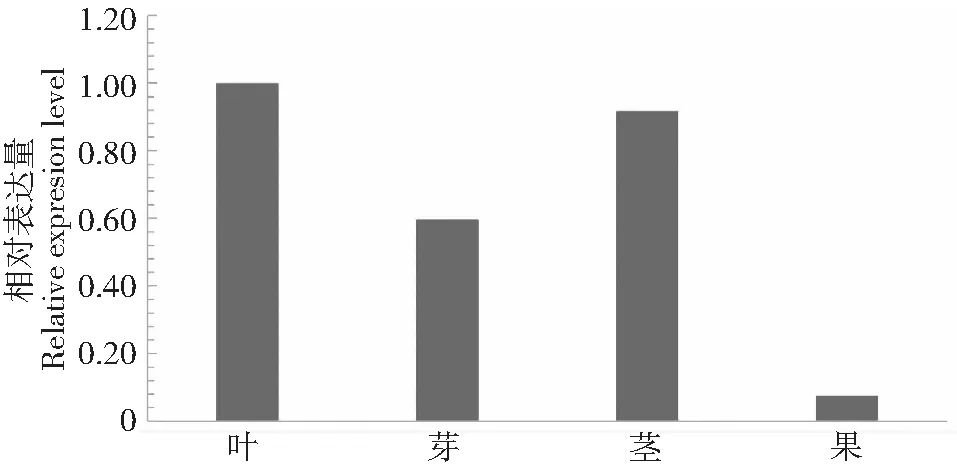
图7 CsYUCCA10组织特异性表达模式Fig.7 The tissue specific expression pattern of CsYUCCA10
本研究利用全长转录组数据信息,验证克隆了1个含有完整编码的茶树YUCCA10基因,该基因开放阅读框为1137 bp,编码378个氨基酸,与其他植物的YUCCA10具有较高的相似性,并且含有FAD和NADPH位点以及与辅因子结合和黄素单加氧酶活性结合所必须的甘氨酸残基,说明茶树YUCCA10在生长素合成途径中发挥其功能。采用qRT-PCR技术,检测茶树YUCCA10基因在正常茶树花和不育花中的表达规律,结果表明,YUCCA10基因表达量在正常花的花瓣、雄蕊、雌蕊中要显著高于不育花;在不同发育期,正常花中随着花的生长发育其表达量呈增加趋势,而不育花呈现减少趋势且显著低于正常花;茶树YUCCA10基因的表达还具有组织特异性。拟南芥中有YUCCA基因家族成员11个,都被证明参与了生长素的生物合成过程,其表达受到严格的调控,在时间和空间上调节模式有明显的不同来控制生长素合成的时空分布[2-3,7]。小麦的YUCCA10在生殖器官如花和种子中强烈表达,导入拟南芥有植株高大、茎秆粗壮的特点,存在部分植株败育,后期花器官变形、花的结构减少以及不能产生花粉,说明小麦YUCCA10对花器官和种子的形成起到关键的调控作用[20]。在拟南芥中YUCCA10参与胚胎发育与叶片形成[2,21]。因此,推测茶树YUCCA10可能参与花器官形成和叶片发育。
生长素对植物生长发育的调节主要依赖于生长素的合成、极性运输能使生长素积累在植物体某些特定部位,从而形成生长素浓度梯度,植物再对生长素信号的识别、下游生长素相关基因的表达,最终表现出生理反应[22-23]。项目组前期分析不育花和正常花中氨基酸组分时,发现不育花中的色氨酸明显高于正常的父本和母本花,分别是父母本的339 %和478 %[14]。推测可能是不育花中的色氨酸不能被转化成生长素,而导致在不育花中积累的结果。同时,分析茶树花不育基因的KEGG代谢通路发现了参与生长素信号转导通路中的相关基因包括生长素输入载体(AUX1/LAX)、生长素反应蛋白(AUX/IAA)家族、生长素响应(GH3)家族、生长素响应因子(ARF)家族以及SAUR家族等基因在不育花中均存在差异表达,说明了不育花中的生长素信号转导不正常[12]。
4 结 论
基于上述对茶树YUCCA10基因的表达特性分析以及前期分析不育花中的色氨酸和生长素信号转导通路相关基因。初步推测是由于不育花中YUCCA10基因的表达量低,使依赖于色氨酸的生长素生物合成量少,导致不育花中IAA含量低,影响了生长素信号通道途径,导致茶花发育不正常,引起茶花不育。
