鞘氨醇单胞杆菌Sphigomonas sp.WG产威兰胶的提取工艺研究
2019-04-08,,,
,,,
(中国石油大学(华东) 化学工程学院,山东 青岛 266580)
威兰胶是由产碱杆菌(Alcaligenessp.)发酵生产的一种微生物多聚糖,由D-葡萄糖、D-葡糖醛酸、D-葡萄糖和L-鼠李糖组合成四糖单元,再以四糖单元为重复单位形成分子量不同的微生物多聚糖[1-3]。威兰胶具有高稳定性、高粘度、剪切稀释性等理化性质,在建筑材料和石油开采领域有着广泛的应用,同时在医药、日用化工、油墨和食品等行业中也存在较大的应用潜力[4-6]。
20世纪80年代,美国C.P.Kelco公司在继黄原胶和结冷胶之后,研发出了威兰胶,并成为全球唯一的生产供应商。在国内,威兰胶的研究目前仍处于菌种筛选、发酵过程优化等初始阶段,但对于下游的威兰胶提取工艺研究相对较少。分离提取工艺是工业上获得威兰胶成品的关键工序,也决定着威兰胶产品的质量和生产成本[7-9]。
本研究从胶州湾海域筛选得到鞘氨醇单胞杆菌Sphingomonassp.WG作为威兰胶发酵生产菌株,经发酵获得威兰胶发酵液[10],采用乙醇作为沉淀剂,对Sphigomonassp.WG产威兰胶的提取工艺进行了设计和优化,以提高威兰胶的提取效率和最终产品质量。
1 材料与方法
1.1 菌种
鞘氨醇单孢杆菌[11]由作者实验室在胶州湾海域筛选获得,已保藏于中国典型培养物保藏中心(北京),保藏号为:CCTCC No.M2013161。
1.2 试剂
乙醇(体积分数95%,工业级)、葡萄糖、磷酸氢二钾、磷酸二氢钾和无水硫酸镁等购买于国药集团化学试剂有限公司,均为分析纯。
1.3 培养基
葡萄糖40 g/L,酵母膏2 g/L,磷酸氢二钾4 g/L,磷酸二氢钾2 g/L,无水硫酸镁0.1 g/L,调节pH为7.0~7.2。
1.4 培养方法
将鞘氨醇单孢杆菌种子液以体积分数5%转接至培养基中,在32.5 ℃、175 r/min搅拌条件下发酵72 h得到黄色粘稠状的威兰胶发酵液。
1.5 拟优化的威兰胶醇沉工艺流程
根据文献[12-15]报道的威兰胶醇沉工艺的差异,本研究设计了拟优化的威兰胶醇沉工艺流程(如图1所示)。其中,对发酵液加热处理与否、固液分离方式、乙醇用量、沉淀时间和沉淀温度的优化,以最终的威兰胶提取量为依据;而对干燥方式的选择,以威兰胶的粘度作为衡量产品质量的依据。

图1 拟优化的威兰胶醇沉工艺流程
1.6 威兰胶粘度测定
将干燥后的威兰胶产品进行粉碎研磨,收集可以通过50目(297 μm)孔筛的威兰胶干粉,使用SK-2型分析天平准确称量1.000 0 g威兰胶,加入199 mL去离子水溶解,配制成质量浓度为0.5%的威兰胶溶液,使用DV-E型粘度计(4号转子,30 r/min,25 ℃)测定威兰胶溶液的表观粘度。
1.7 威兰胶提取量的计算方法
威兰胶提取量(g/L)=威兰胶干质量/发酵液的体积。
2 结果与分析
2.1 发酵液加热处理对威兰胶提取量的影响
能耗是工业生产成本的主要组成部分,降低能耗不仅可以使威兰胶的提取成本降低,同时也有利于威兰胶的进一步推广应用。另外,热激处理有可能改变发酵液中威兰胶分子的存在状态,对威兰胶的分离提取产生影响。因此,本实验首先考察了发酵液加热处理(85 ℃加热20 min)对威兰胶提取量的影响,实验结果如图2所示。
实验结果表明,在所考察的乙醇用量范围内,对发酵液进行加热和不加热处理所获得的威兰胶提取量基本相同,这说明对发酵液进行热激处理对威兰胶的提取量没有明显影响。考虑到对发酵液进行加热需要大量热能,增加了分离过程的能耗,因此取消对发酵液进行热激处理的环节,直接对发酵液进行乙醇沉淀。

图2 发酵液加热处理对威兰胶提取量的影响
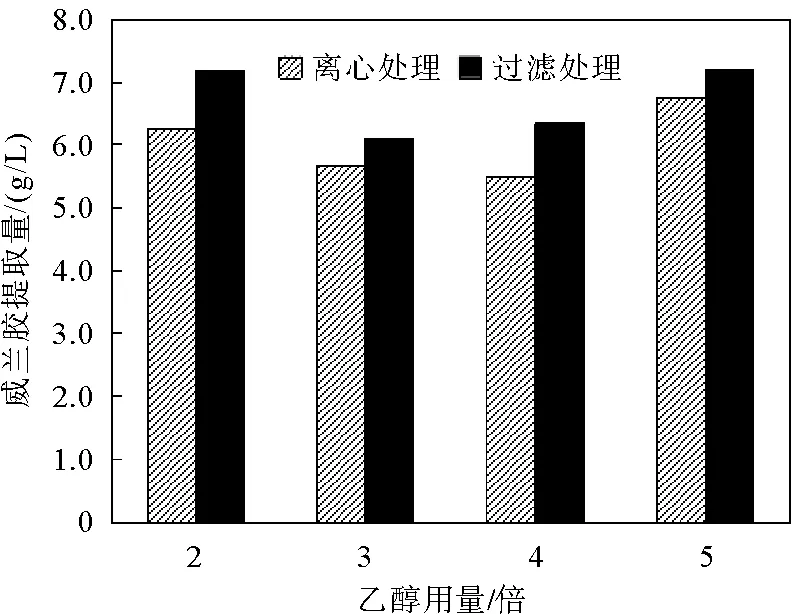
图3 固液分离方式对威兰胶提取量的影响
2.2 固液分离方式对威兰胶提取量的影响
离心和过滤是工业生产中两种常用的固液分离方法。其中,过滤法的能耗较低,但速度较慢;而离心法的能耗偏高,但处理速度较快。为寻找一种较为合适的沉淀分离方式,本实验比较了过滤和离心两种方法对威兰胶提取量的影响,结果如图3所示。
图3表明,在乙醇用量相同的情况下,过滤操作获得的威兰胶提取量均大于离心处理所得的量。其原因可能是在离心过程中由于离心力的限制,导致少量威兰胶未能从上清液中沉淀下来,进而造成一定量的损失。为了尽可能多地提取威兰胶产品,最好用过滤方式进行固液分离操作。但考虑生产效率和成本,工业上仍建议采用离心分离工艺。
2.3 乙醇用量对威兰胶提取量的影响
乙醇沉淀法是微生物多糖分离提取的常用方法,其用量与发酵液本身的性质有关。不同菌株发酵生产的发酵液在微生物多糖的含量、粘度、理化性质等方面存在差异,这些因素都会影响乙醇的最佳用量。因此,本实验分别考察了乙醇用量为发酵液体积1~6倍时的威兰胶提取情况,结果如图4所示。
图4表明,当乙醇用量较少时,威兰胶的提取量随乙醇用量的增加而逐渐上升,在乙醇用量达到5.5倍时,威兰胶的提取量获得最大值,继续增加乙醇用量,威兰胶的提取量出现下降。在实验过程中我们还发现,当乙醇用量为发酵液体积的2倍以下(1倍、1.5倍)时,混合溶液会呈现浑浊状态,威兰胶很难形成有效的絮状沉淀。当乙醇用量超过发酵液体积5.5倍后,溶液的极性可能使威兰胶分子的结构发生变化,使其无法进行有效的沉淀,导致提取量呈现下降趋势。因此确定95%乙醇的用量为发酵液体积的5.5倍。

图4 乙醇用量对威兰胶提取量的影响
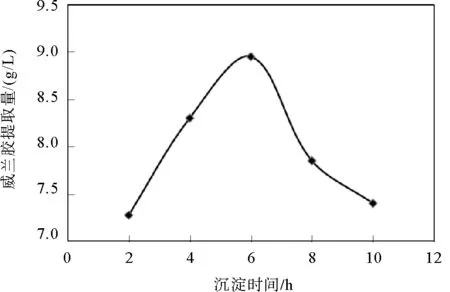
图5 沉淀时间对威兰胶提取量的影响
2.4 沉淀时间对威兰胶提取量的影响
乙醇沉淀威兰胶是威兰胶分子间相互作用聚集的过程,该过程需要一定的时间。本实验在乙醇用量为5.5倍发酵液体积的条件下,分别静置2、4、6、8和10 h进行沉淀,考察了沉淀时间对威兰胶提取量的影响,实验结果见图5。
从图5可以看出,在乙醇加入的初始阶段,威兰胶的提取量随着沉淀时间的延长而增加。当沉淀时间达到6 h时,威兰胶的提取量获得最大值,继续延长沉淀时间,威兰胶的提取量开始下降。此现象说明如果沉淀时间过短,威兰胶分子无法充分聚集、导致沉淀不完全;反之,如果沉淀时间过长,可能会使得少量已经聚集的威兰胶分子从沉淀状态重新溶解,同样导致提取量降低。由此可见,威兰胶提取过程中的沉淀时间应在6 h左右为宜。
2.5 沉淀温度对威兰胶提取量的影响
沉淀温度是影响威兰胶分子间相互作用并最终影响其提取量的又一因素,因此本实验考察了沉淀温度分别为4、10、20、30、40和50 ℃时的威兰胶提取量,实验结果如图6所示。

图6 沉淀温度对威兰胶提取量的影响
实验结果表明,在所考察的沉淀温度范围内(4~50 ℃),威兰胶提取量随沉淀温度的增加先增加后降低,并在沉淀温度为20 ℃时获得最大值。作者推测,温度过高可能使威兰胶在乙醇中的溶解度增大,致使威兰胶的提取量降低。因此,威兰胶的最佳沉淀温度为20 ℃。
2.6 干燥方式对威兰胶溶液粘度的影响
干燥是提取威兰胶产品的最后一个环节,其目的是脱除沉淀物中含有的乙醇和水分,不同干燥方式脱除水分的程度不同,对威兰胶分子结构造成的损害程度也有差异。因此,本实验考察了通风加热干燥(即烘干干燥)、真空干燥和真空冷冻干燥对威兰胶溶液粘度的影响,实验结果列于表1。

表1 干燥方式对威兰胶溶液表观粘度的比较

图7 优化后的威兰胶醇沉工艺
由表1可以看出,通风加热干燥和真空干燥得到的威兰胶溶液粘度基本相同,而真空冷冻干燥获得的威兰胶溶液的粘度比二者高出约45%。其可能原因是,在通风加热干燥和真空干燥过程中,水分损失较快、较多,甚至包括部分维持分子结构的结合水分子,导致威兰胶分子结构出现损伤,而在真空冷冻干燥过程中水分子升华缓慢,威兰胶分子结构受到的损伤较小。
2.7 优化后的威兰胶提取工艺
根据上述实验结果,获得的鞘氨醇单孢杆菌Sphingomonassp.WG产威兰胶的最佳醇沉工艺如图7所示。
3 结论
对鞘氨醇单孢杆菌Sphingomonassp.WG发酵液中提取威兰胶的醇沉工艺进行了系统优化,考察了发酵液加热处理、固液分离方式、乙醇用量、沉淀时间及沉淀温度对威兰胶提取量的影响,同时研究了3种干燥方式对威兰胶溶液粘度的影响。研究表明:对发酵液进行加热处理不会增加威兰胶的提取量;相对于离心操作而言,过滤能够获得更高的威兰胶提取量;最佳的乙醇用量、沉淀时间和沉淀温度分别为发酵液体积的5.5倍(95%乙醇)、6 h和20 ℃;真空冷冻干燥获得的威兰胶溶液的粘度比烘干干燥和真空干燥高出约45%。
