不同类型茶园土壤细菌多样性及群落结构研究
2019-04-06顾松松胡秋龙刘仲华龚志华
顾松松,胡秋龙,刘仲华,龚志华,李 适,谭 琳*
(1. 湖南农业大学 植物保护学院,湖南 长沙 410128;2. 湖南农业大学 园艺园林学院,湖南 长沙 410128)
土壤微生物在土壤物质和能量的转化、植物抗逆性、生长发育及生产力等方面发挥着极其重要的作用[1-2]。如根瘤菌(Rhizombiunm)和弗兰克菌(Frankia)等固氮细菌可以提高作物产量,增加植物对氮元素的吸收[3]。假单胞菌(Pseudomonas)、芽孢杆菌(Bacillus)和农杆菌(Agrobacterium)可通过产生植物激素或分子信号、竞争生长位点、铁载体等促生长机制促进植物生长,增强对病原菌的抗性[4-5]。根际是直接受植物根系和分泌物影响的土壤区域,是土壤微生物与植物相互作用的重要场所。近年来,利用生物工程技术在分子水平上对植物土壤微生物多样性的研究很多,但大多数主要集中在作物和森林[6-8],对茶树根际土壤微生物多样性的研究报道较少。本文选取有机、无公害和普通等3种不同管理模式的茶园,研究茶树根际土壤细菌多样性和群落结构,旨在为发挥微生物根际效益、调节土壤微生态环境、改善土壤质量提供数据支持和理论依据。
1 材料与方法
1.1 样品采集
选取有机、无公害和普通等3种不同管理模式的茶园土壤,采样地点分别为:有机茶园(湖南长沙县茶园,OTP)、无公害茶园(湖南长沙望城茶园,NPTP)和普通茶园(湖南农业大学茶园,CTP),每个实验茶园都大于666.7 m2。施肥和施药:有机茶园2、9月份施腐熟的家畜粪尿、菜籽饼肥以及商品有机肥,全年施肥量为 250~350 kg/666.7 m2,施用生物农药;无公害茶园2、5、7、9月份施尿素和复合肥,全年施肥量为 80~100 kg/666.7 m2,施用化学农药为主;普通茶园2、9月份施尿素,全年施肥量为 80~100 kg/666.7 m2,施用化学农药。
依据《土壤分析技术规范》(2006)按“S”点位采集土样。2017年8月,每个茶园取30个茶树根际土壤样品,每5个样品充分混合后再仔细混匀,剔除石块和杂物后堆成厚度均一的四方形,对角线法划分成四等分,去掉对角线2份,依此方法重复操作,直到样品重量达到所需,形成一个复合样品。每个茶园采集6个土壤复合样品,共计18个土壤复合样品,一部分用于测定物理化学性状,一部分用于分子实验。用于分子试验的土样,密封储存在-80℃超低温冰箱中备用。
1.2 土壤理化性状测定
土样送中国科学院南京地理研究所土壤分析实验室,检测pH、总有机碳(TOC)、硝酸盐氮(NO3-N)、氨氮(NH4-N)、总氮(TN)、有效磷(AP)和总磷(TP)。
1.3 DNA提取和扩增子测序
使用 Fast DNA Spin 试剂盒(MP Biomedicals LLC,USA)提取各样本总DNA。使用NanoDrop分 光 光 度 计(Nano-100,Aosheng Instrument Co Ltd.)测量 DNA 质量和浓度。使用 515F(5'GTGCCAGCMGCCGCGGTAA-3')和 806R(5'-GGACTACHVGGGTWTCTAAT-3')引物并结合自行设计用以区分样品的条形码,将提取的DNA用作模板用于扩增16SrRNA基因的V4区域。PCR扩增在50 uL反应体系中进行,并使用凝胶提取试剂盒(D2500-02,OMEGA BioTek)纯化 DNA。按照 VAHTS TM将所有样品组合成单个样品的文库制备,使用MiSeq试剂盒制备用于测序的样品文库,送中南大学测序(Miseq测序仪)。
1.4 序列预处理和生物信息学方法
通过FLASH程序[9]将具有至少30 bp重叠长度的成对末端序列组合成全长序列,组合后平均片段长度为253 bp。通过Btrim程序[10],将质量得分阈值>20或者5的设为窗口大小,用于筛选出不合格的序列。丢弃具有模糊碱基且仅保留245~260 bp范围内的序列作为靶向序列。UPARSE[11]用于去除嵌合体并将相似性为97%的序列分类为同一OUT(Optical Transform Unit)。将所有样本作为列并且所有OTU作为行的大矩阵生成为OTU表,从该表获得Resample OTU表以标准化总序列。所有序列预处理都是通过与这些生物信息学工具集成的内部平台(http://mem.rcees.ac.cn:8080)进行。
1.5 生态和统计分析
通过对Resample OUT表中观察到的物种数量进行计数得到Richness指数。使用Mothur程序[12]计算与稀释曲线相关的Chao1值[13]。使用程序包(v.2.3-5)在R(v.3.2.5)中根据物种丰度计算Shannon和Inverse Simpson指数。基于Faith方法测量系统发育多样性(PD),其是每个样品中OTU的总系统发育分支长度的总和。使用PyNAST将所选代表性OTU序列与GreenGene数据集对齐,并使用FastTree程序生成发育树文件。使用R中的Picante包(v.3.2.5)计算PD。UniFrac矩阵的主坐标分析(PCoA)[14]用于微生物群落结构变化。使用多变量方差分析(PERMANOVA)通过R(v.3.2.5)中的程序包(v.2.3-5)使用Bray-Curtis和Jaccard距离方法测试三组之间的差异。采用Pearson,Kendall和Spearman三种相关方法进行关联性分析。通过双尾t-test检验确定两组之间的显著性,并且使用单因素方差分析(ANOVA)获得多组的显著性。
2 结果与分析
2.1 三种类型茶园土壤的细菌多样性和群落结构差异性
通过高通量测序分析,从18个样品中获得了共419,685个有效序列,并且从序列中鉴定出17,403个OTU。3种茶园土壤OTU稀疏曲线趋于平缓,表明所测序列库容都可以较好地反映细菌群落的种类与数量,基本涵盖了3种茶园土壤中所有细菌种群,足以进行下游数据分析(图1)。通过细菌多样性指数Chao1来比较不同管理模式的茶园土壤中细菌α多样性。所有样本的Chao1多样性指数从3,042到6,200不等(图2),表明3种茶园土壤均表现出高水平的细菌多样性,有机茶园土壤具有最高水平的细菌多样性;有机茶园与普通茶园、无公害茶园土壤的细菌α多样性存在显著差异(P<0.05),普通茶园与无公害茶园土壤的细菌α多样性无显著差异。基于18个样品中相对丰度较高(>1%)的19个细菌菌群,在属水平上进行了分级聚类热图分析(图3)。结果表明,无公害茶园和普通茶园的土壤细菌群落结构和组成较为相似,与有机茶园存在显著性差异。进一步分析了不同管理模式的茶园土壤细菌群落的β多样性,细菌群落的主坐标分析(PCoA)图显示,在3种管理模式下,茶园土壤组之间存在明显的分离,有机茶园的细菌群落在第二轴上与另外两个茶园细菌群落能明显区分开,无公害茶园细菌群落在第一轴上与其他茶园细菌群落分离(图4)。基于MRPP、ADONIS和PERMANOVA算法的差异检验结果也表明3种茶园土壤细菌群落结构存在显著差异(表1)。

表 1 不同茶园土壤细菌群落结构差异性分析Table 1 Dissimilarity test of bacterial community structure in different tea plantation soils based on Bray-Curtis distance
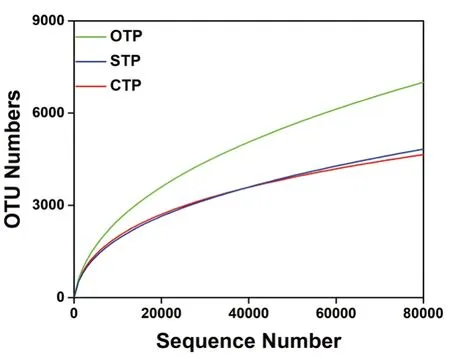
图1 不同茶园土壤细菌稀释曲线(有机茶园土壤,OTP;无公害茶园土壤,NPTP;普通茶园土壤,CTP。下同)Fig. 1 Rarefaction curves of soil bacteria from different tea plantations

图 2 不同茶园土壤细菌群落的Chao1指数Fig. 2 Chao1 index of bacterial community in different tea plantation soils

图 3 不同茶园土壤主要细菌菌属的聚类热图分析Fig. 3 Clustering heat map analysis of major generas in different tea plantation soils

图 4 不同茶园土壤细菌群落的主坐标轴(PCoA)分析Fig. 4 PCoA analysis of bacterial communities in different tea plantation soils
2.2 三种类型茶园土壤细菌群落组成差异性
3种茶园土壤的所有OTU被鉴定为36个门652个属。3种茶园土壤细菌群落中的主要菌门(>1%)共有13个,分别为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloro fl exi)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、齐古菌门(Thaumarchaeota)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、candidate division WPS-2、浮霉菌门(Planctomycetes)、蓝藻细菌门(Cyanobacteria)、硝化螺旋菌门(Nitrospirae)和未分类菌门(Unclassi fied)(图5a)。3种茶园土壤细菌群落中的主要菌属(>1%)共有19个,分别为未分类菌属(Unclassi fied)、纤细杆菌属(Ktedonobacter)、Gp2、Gp1、Gp3、亚硝基球藻菌属(Nitrososphaera),第3子类:南方古陆属(Subdivision3 generaincertae sedis)、伯克氏菌属(Burkholderia)、WPS-2南方苔藓属(WPS-2 genera incertae sedis)、短根瘤菌属(Bradyrhizobium)、斯巴达菌(Spartobacteria)、Actinoallomurus、Gp6、共生杆菌(Conexibacter)、盖伊拉菌属(Gaiella)、芽单胞菌(Gemmatimonas)、链霉菌(Streptophyta)、节杆菌属(Arthrobacter)和硝化螺菌属(Nitrospira)(图5b)。
3种茶园土壤的优势门类群相对丰度见表2。3种茶园样本在5个菌门(变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、candidate division WPS-2、 浮 霉 菌 门(Planctomycetes)、硝化螺旋菌门(Nitrospirae)中所占比例差异显著(P<0.05),其中有机茶园样本和其他茶园样本间差异尤其显著(P<0.05)。在相对丰度方面,有机茶园样本具有最高的变形菌门(Proteobacteria)(24.97%)、疣微菌门(Verrucomicrobia)(6.84%)、硝化螺旋菌门(Nitrospirae)(1.16%),而普通茶园样本的浮霉菌门(Planctomycetes)丰度最高(2.16%)。将3种管理模式的茶园土壤样品的OTU分布进行维恩图(Venn diagram)分析(图6)可知,3种茶园样本共有1,454个OUTs,在各自总OTU数量中占不同比例,分别为占有机茶园样本OTU数量(6, 056个)的24.01%、占无公害茶园样本OTU数(4,686个)的31.02%和占普通茶园样本OTU数(4, 310个)的33.74%。3种茶园土壤样本各自特有的OTU在各自总OTU数量中占不同比例,分别为有机茶园的56.29%、无公害茶园的37.81%和普通茶园的29.12%。该结果与聚类分析结果一致,即有机茶园管理模式下的土壤细菌群落组成与无公害茶园和普通茶园存在显著差异。
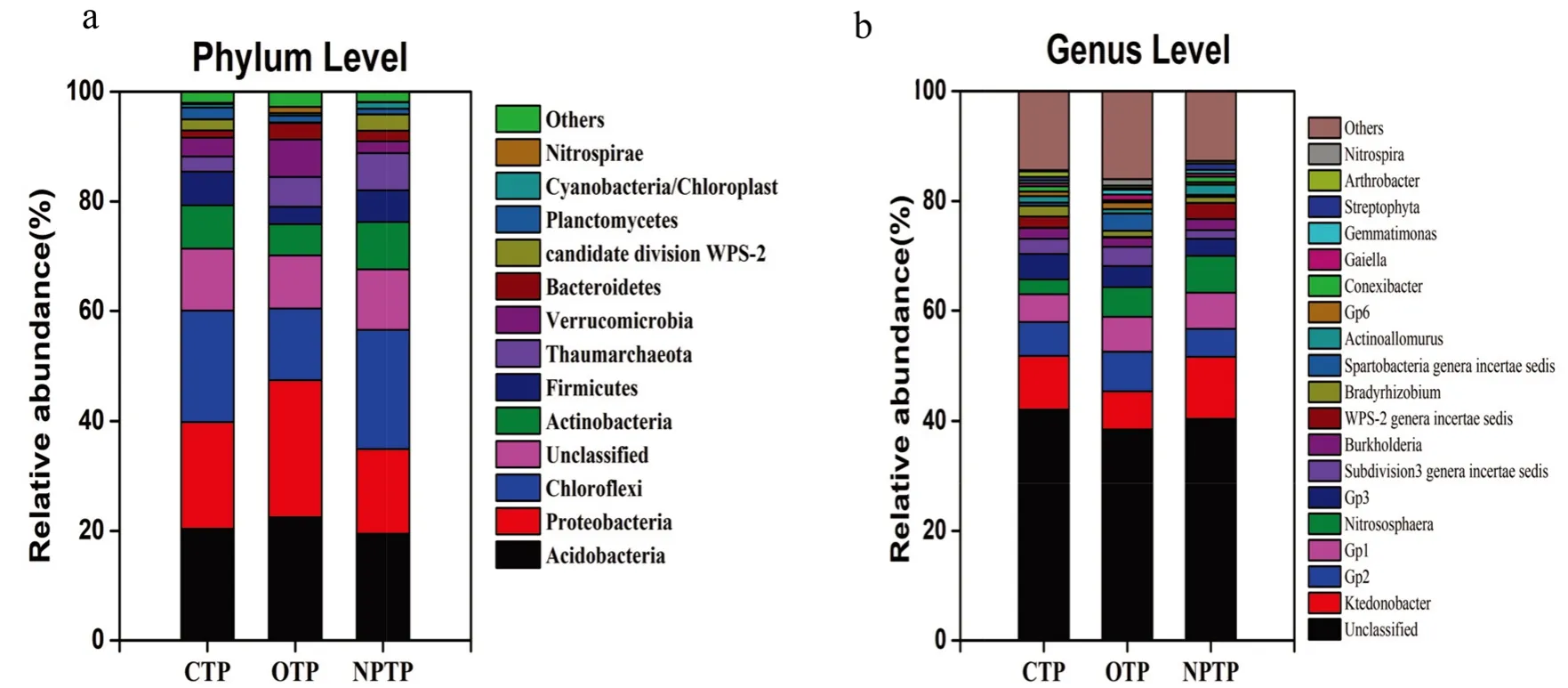
图 5 不同茶园土壤细菌群落主要菌门和属的相对丰度Fig.5 Relative abundance of domain phyla and genera in bacterial communities of different tea plantation soils
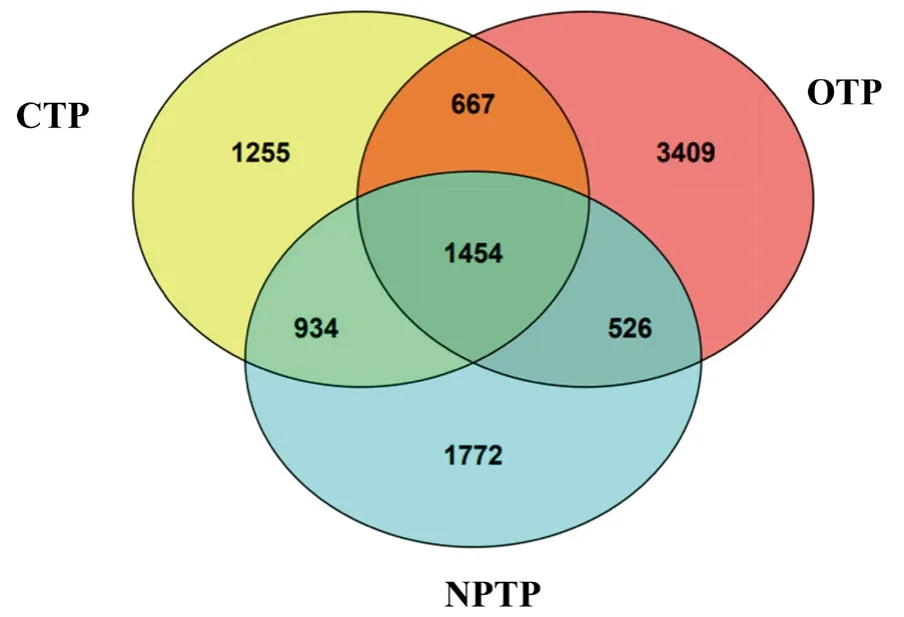
图 6 不同茶园土壤样品OTU分布的Venn分析图。图中数据代表不同OTU数量。Fig. 6 Venn diagram of OTU distribution of different tea plantation soil samples. The data in the figure represents the number of OTU
2.3 三种类型茶园土壤细菌群落结构与土壤理化性质的相关性
土壤样品理化性质测定结果见表3。其中TP、AP和NO3-N含量与pH值在三种茶园中存在显著差异,有机茶园土壤TP含量最高,无公害茶园次之,普通茶园含量最低;硝态氮含量有机茶园与普通茶园差异不明显,但都高于无公害茶园;有机茶园的AP含量与pH值为最高,无公害茶园与普通茶园差异不明显。通过对茶园土壤细菌群落结构与土壤理化因子间的mantel test分析,结果表明TP、AP和pH是土壤细菌群落组成的主要影响因子(表4)。

表2 不同茶园土壤细菌群落优势门的相对丰度Table 2 Relative abundance of dominant phylum in tea plantation soil bacterial community under different management mode

表3 不同茶园土壤理化性质Table 3 Soil properties of different tea plantations

表 4 不同茶园土壤理化性质与细菌群落结构相关性的mantel test分析Table 4 Mantel test analysis on the correlation between environmental factors of different tea plantations and soil microbial community structure
3 讨论
3.1 不同管理模式对茶园细菌多样性的影响
本研究基于高通量测序技术对3种不同管理模式的茶园土壤细菌多样性进行了初步研究,α多样性指数结果显示,3种不同管理模式的茶园土壤细菌多样性有显著性差异,且有机茶园多样性显著高于另外两种管理模式下的茶园;β多样性分析结果表明,有机、无公害以及普通茶园的土壤细菌群落结构存在显著差异。土壤微生物种群的丰度和多样性对土壤质量、功能和土壤生态系统的可持续性起着重要的作用。多样性指数是评价细菌群落多样性的重要指标,多样性指数越高表明细菌群落的丰富度和多样性越高。袁红朝[15]、徐永刚[16]研究表明施有机肥和秸秆还田均显著增加土壤细菌多样性。吕宁等[17]研究表明土壤细菌数量与物种丰度随着生物农药施用量增加而显著增加。张仕颖[19]、张雯雯[20]研究表明,施用化学农药会降低水稻田微生物群落的碳源利用能力,从而降低微生物多样性。本研究结果显示有机茶园中细菌群落的Chao1多样性指数明显高于另外两个茶园,可能一方面是由于有机肥的施用,土壤有机质和氮、磷、钾等可利用性增加,为更多的微生物提供了生长和繁殖的条件,从而土壤细菌多样性指数提高;另一方面,有机茶园中施用生物农药而非化学农药也是微生物多样性提高的一个重要原因。
3.2 不同管理模式对茶园细菌群落组成和结构的影响
本研究结果表明变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloro fl exi)在3种不同管理模式的茶园土壤细菌中都属于优势菌群。从属水平和OUT分布结果来看,有机茶园和无公害、普通茶园土壤有显著差异性。无公害和普通茶园土壤细菌群落结构中具有一定的同源性,但在低丰度的细菌群落结构方面存在一定特异性,且细菌的优势菌门丰度也存在显著差异。不同茶园土壤样品的优势门为变形菌门(Proteobacteria)(25.84%),其次为酸杆菌门(Acidobacteria)(21.53%)。这两个群体在土壤样品中经常被发现[21]。Janssen等[22]的研究结果表明各种土壤中细菌门中数量最多的是变形菌门(Proteobacteria)(39%)和酸杆菌门(Acidobacteria)(19%),虽然相对丰度比例不同,但与我们的结果一致。在处理后的OTP土壤样品中,变形菌门(Proteobacteria)(24.97%)的相对丰度最高。Li等[23]指出β变形菌(β-Proteobacteria)是具有共生性并与大量可利用的营养物有关。这可能在一定程度上能解释有机茶园土壤具有较高水平的细菌多样性。此外,有机茶园土壤中硝化螺旋菌(Nitrospirae)的丰度明显高于无公害和普通茶园。硝化螺旋菌(Nitrospirae)与氮循环密切相关,主要参与亚硝酸盐向硝酸盐的转化,在土壤生物地球化学循环中具有不可替代的生态作用[24]。Martiny等[25]的研究表明,在生物膜和大体积水样中,亚硝化体和亚硝化螺旋体都在硝化过程中发挥着重要的作用,能够有效促进土壤中的氮循环;同时氮含量的增加可以为茶园土壤细菌的生长提供足够的养分,从而提高茶园土壤细菌的多样性。
3.3 不同管理模式对茶园土壤理化性质的影响
有机肥能改变土壤理化性质[26],陈贵[30]、吴志丹[31]研究表明施用有机肥能显著增加土壤的有机质、全氮、碱解氮、有效磷、总磷和速效钾含量。杨君等[32]发现有机肥施用率高的茶园,其表层土壤中的磷含量高于其他施肥方式的茶园,有效磷的增加可以提高微生物多样性[37],提高茶园生产力[33]。pH值是影响土壤微生物群落结构的最强因素[38-39],提高土壤pH对土壤微生物生物量和细菌群落多样性具有积极意义[40]。有机肥料施用能改善土壤pH值[34-36],为土壤提供了有机碳源增加微生物活性[29],对土壤细菌多样性产生积极影响[27-28]。本研究结果表明,3种管理模式中有机茶园TP、AP含量和pH值显著高于其他两种茶园,且土壤理化性质和细菌群落结构之间的关系分析也显示,TP、AP和pH是影响茶园土壤细菌群落结构的主要土壤理化因子,与上述研究结果一致。
