外源6-BA对紫花苜蓿盛花期叶片光合、生理特性及结荚率的影响
2019-04-04宋佳琦王玉祥
宋佳琦,王玉祥,张 博
(新疆农业大学草业与环境科学学院 / 新疆西部干旱荒漠区草地资源与生态省部共建教育部重点实验室,新疆 乌鲁木齐 830052)
光合作用是植物生命活动的核心反应,是光化学同化物积累、转运的前提,是植物形成有效产量的保障。在经济作物的生产中发现,外源激素对植物光合作用有重要调控作用,其中细胞分裂素促进光合作用的进行,增加叶片内叶绿素蛋白的合成,减少叶绿素的降解,促进叶绿体中基粒的形成,影响叶绿体基因的表达和叶绿体DNA的合成[1-2]。外源细胞分裂素可以减轻植物叶片衰老,促进抗衰基因的表达,使植物组织中信使RNA含量升高,保护RuBp羧化酶的结构,使植物的光合作用可以顺利进行[3-4]。6-苄氨基嘌呤(6-Benzylaminopurine, 6-BA)是细胞分裂素的一种,其生物活性强,可有效延缓植物叶片衰老,提高叶片中抗氧化酶活性,及时清除叶片内过多的自由基[5-6],提高叶片的净光合速率、叶绿素含量,并减小叶片气孔阻力[7]。外源6-BA提高叶片光合能力不仅与气体交换参数相关,与光合机构中光合电子传递链也相关,帮助光合电子顺利传递,减轻光合机构的损伤程度[8-10]。外施6-BA还可提升大豆(Glycine max)[11]、羽扇豆(Lupinus micranthus)[12]、水稻(Oryza sativa)[13]等经济作物的结实率及种子产量,对植物的开花结实有重要影响。
紫花苜蓿(Medicago sativa)为簇生总状的无限花序,小花数量庞大,但种子产量低。目前有关紫花苜蓿种子生产的研究,多数集中于栽培措施方面,但紫花苜蓿种子产量依然较低。紫花苜蓿生殖生长过程中,光合作用的顺利进行有利于光化学同化物的产生和积累,为生殖器官的生长发育提供充足的营养物质,防止因营养物质的缺失导致小花败育及花荚的脱落,从而影响种子产量。通过叶面喷施乙烯利、多效唑增加了紫花苜蓿单位面积花序数、单位面积结荚花序数和每花序荚果数,提升了潜在种子产量[14-15],表明施用植物生长调节剂可影响苜蓿的种子产量。王玉祥[16]研究激素与水肥对苜蓿生殖生长和种子产量的影响,结果表明,在苜蓿盛花期喷施不同浓度的6-BA、 赤 霉 素 (Gibberellin, GA)和 生 长 素 (Auxin,IAA),对苜蓿的结荚率和种子产量有不同程度的影响,适宜浓度的6-BA可提高种子产量,但未从植物生理层面探讨影响苜蓿种子产量的原因。基于此,本研究以新牧4号紫花苜蓿为试验材料,现蕾期喷施不同浓度6-BA,探讨外源6-BA对苜蓿盛花期叶片光合作用、抗氧化系统及结实性的影响,以期为细胞分裂素在苜蓿生产中的应用提供理论依据。
1 材料与方法
1.1 供试材料
试验材料为新牧4号紫花苜蓿(Medicago sativa‘Xinmu No.4'),由新疆农业大学“西部干旱荒漠区草地资源与生态”省部共建教育部重点实验室提供。
1.2 试验处理
于2017年5至7月在新疆农业大学三坪农场试验站进行田间试验,2016年秋季播种,行距60 cm,播量 30 kg·hm-2,播深 1~2 cm,采用地下滴灌的方式进行灌溉,试验期间进行正常的田间管理。试验采用随机区组设计,在苜蓿返青期选取生长状况一致的地块划分小区,小区面积 15 m2(3 m × 5 m),试验设置4个处理,每个处理3次重复。苜蓿现蕾期用手持喷雾器喷施人工合成细胞分裂素(6-BA),6-BA 浓度设置为 10、20 和 30 mg·L-1,清水为对照。为了使6-BA能更好地附着在叶片,6-BA溶液及清水均含0.5%的吐温-20,喷洒量为每个小区2 L溶液,喷施时间为08:00和20:00,每天喷施2次,连续喷施 3 d。
1.3 测定内容与方法
在苜蓿盛花期随机选取功能叶测定光合参数和荧光参数,每个参数测定10次重复。同一时间随机选取相同叶位的苜蓿叶片,放在锡箔纸内包裹好,迅速放入液氮中,速冻24 h,然后将样品转入-40 ℃的冰箱内,用于测定生理指标。
1.3.1 光合参数的测定
天气晴朗时用光合仪(型号:PP-SystemCRIAS-2)进行测定,叶室温度约为30 ℃,光照强度约为2 000 μmol·(m2·s)-1,CO2浓度 (Ca)约为 420 μmol·L-1,测定最大净光合速率 [Pn,μmol·(m2·s)-1]、胞间 CO2浓度 (Ci, μmol·mol-1)、蒸腾速率 [Tr,μmol·(m2·s)-1]和叶片水分利用效率 (WUE,μmol·μmol-1)。
1.3.2 荧光参数的测定
天气晴朗时用植物效率分析仪(型号:Handy-PEA)测定叶片快速叶绿素荧光动力学曲线(O-J-I-P曲线),测定时间为16:00(光照最强),测定前在叶片上夹上叶夹,在黑暗条件下适应30 min后进行测定。试验用到荧光参数为:初始荧光(Fo),以吸收光能为基础的光化学性能指数(PIABS),最大光化学效率(Fv/Fm),光系统Ⅱ(PSⅡ)潜在光化学效率(Fv/Fo)。
1.3.3 生理指标的测定
可溶性糖含量采用蒽酮比色法测定,游离脯氨酸采用酸性茚三酮法测定,过氧化氢含量采用分光光度法测定,超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光下还原法测定,过氧化物酶(POD)活性采用愈创木酚比色法测定,过氧化氢酶(CAT)活性采用高锰酸钾滴定法测定[17]。
1.3.4 结实性观测
单序小花数:在盛花期,各小区随机选取30个花序,统计小花数量;单序荚果数:在完熟期,各小区随机选取30个花序,统计荚果数量;千粒重:在收获的种子中随机数出1 000粒种子称重,重复10次;单株种子产量:种子成熟后在各个小区中随机选取10株苜蓿,每株单独收获拷种。
结荚率 = (单序荚果数/单序小花数) × 100%。
1.4 数据处理
数据使用Excel 2010录入,Origin8.0作图。采用SPSS 20.0软件对种子产量、光合参数、荧光参数、抗氧化酶活性进行单因素方差分析及Duncan多重比较。
2 结果与分析
2.1 外源6-BA对苜蓿盛花期叶片光合参数的影响
10和 20 mg·L-16-BA处理后,苜蓿叶片 Pn、Tr、WUE 均显著高于对照,Ci显著 (P<0.05)低于对 照 (图 1),20 mg·L-16-BA 处 理 后 Pn、Tr、WUE值最大,分别高于对照39.34%、17.99%和18.06%,Ci低于对照 7.11%。在 30 mg·L-16-BA 处理下,苜蓿叶片 Pn和 WUE分别显著 (P<0.05)低于对照2.94%和14.05%,Ci显著高于对照6.33%。以上结果表明,10和20 mg·L-16-BA可提高苜蓿叶片的光合能力,提高叶片对CO2的利用率,减少细胞间隙CO2的积累。
2.2 外源6-BA对苜蓿盛花期叶片荧光参数的影响
初始荧光(Fo)是叶片在黑暗适应下PSⅡ反应中心完全开放时的荧光产量,如图2所示,随着6-BA处理浓度递增,Fo逐渐减少,表明6-BA可降低叶绿体类囊体膜结构的损伤。最大光化学效率(Fv/Fm)、PSⅡ潜在光化学效率(Fv/Fo)和光合性能指数(PIABS)可反映叶片光合机构的损伤程度及光抑制程度,20 和 30 mg·L-16-BA 处理后,Fv/Fm、PIABS和Fv/Fo均高于对照,表明外源6-BA可降低强光照射下叶片的光抑制程度,减小光合机构的损伤程度。
2.3 外源6-BA对苜蓿盛花期叶片抗氧化酶活性的影响
30 mg·L-16-BA处理,叶片中SOD活性显著高于 其 他 处 理 (P< 0.05)(图 3), 较 对 照 高 4.05%。10和20 mg·L-16-BA处理,显著提高POD和 CAT活性。6-BA 浓度为 20 mg·L-1时 POD 和 CAT 活性最强,分别高于对照5.62%和11.49%。说明外源6-BA可增强苜蓿盛花期叶片抗氧化酶活性,减缓活性氧对光合器官的破坏。
2.4 外源6-BA对苜蓿盛花期叶片渗透调节物质和过氧化氢含量的影响
10 mg·L-1处理下,苜蓿盛花期叶片中可溶性
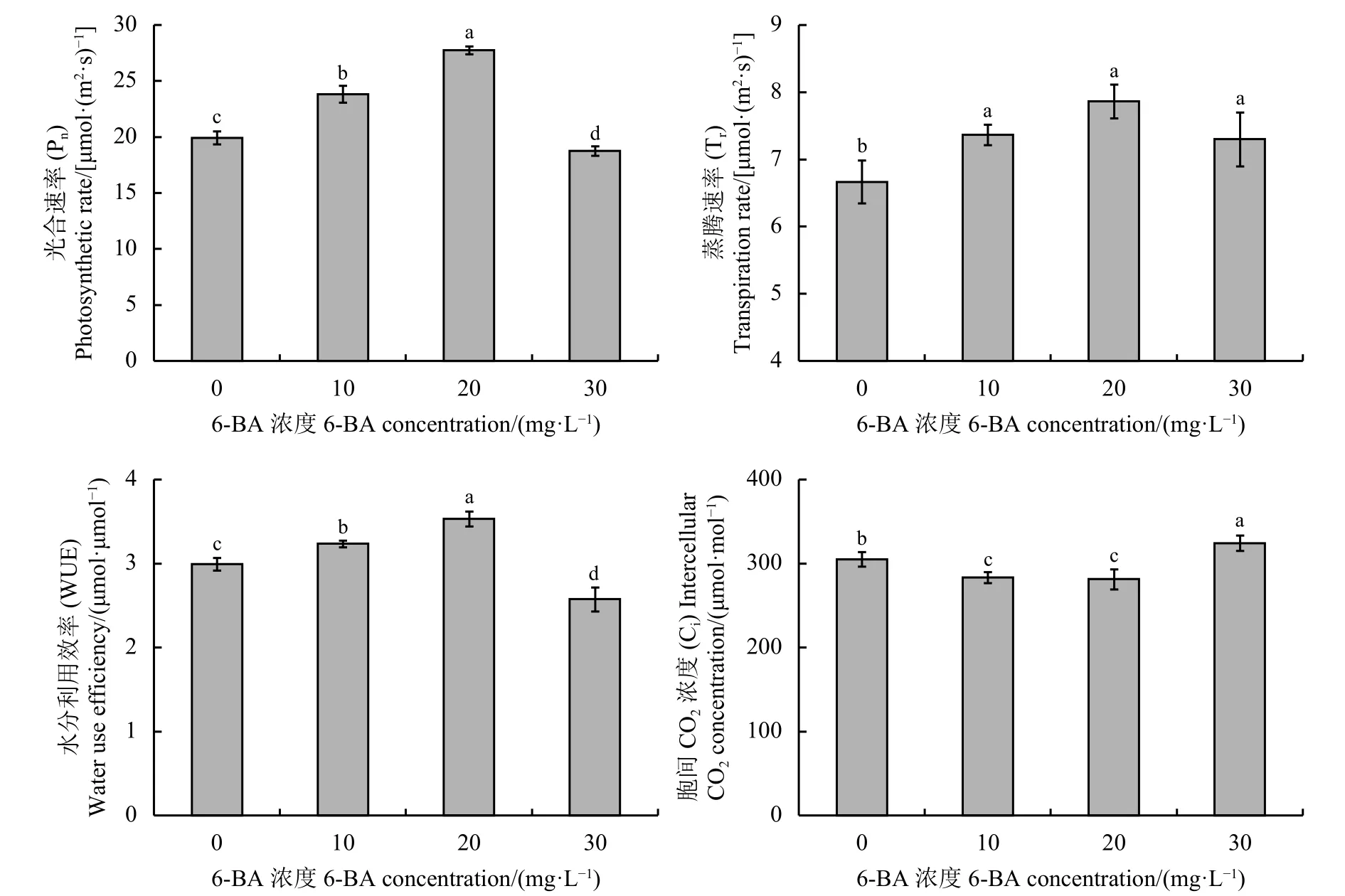
图 1 不同浓度6-BA对苜蓿盛花期叶片光合参数的影响Figure 1 Changes of photosynthetic parameters of alfalfa at flowering stage under different concentrations of 6-BA
糖含量显著高于其他处理 (P<0.05)(图4),其次为20 mg·L-1和 30 mg·L-1处理。不同浓度 6-BA 均使叶片内脯氨酸含量较对照显著增多(P<0.05),20 mg·L-1处理下,脯氨酸含量最高,是对照的1.36倍。10和20 mg·L-1处理下叶片中过氧化氢含量显著低于对照 (P<0.05),6-BA 浓度为 30 mg·L-1处理下,苜蓿叶片内过氧化氢含量较对照高0.51 nmol·g-1。
2.5 外源6-BA对苜蓿结实性的影响
随着6-BA浓度递增,苜蓿的单序小花数逐渐增多,30 mg·L-1处理单序小花数最多,显著高于对照(P<0.05)(表1);6-BA处理后苜蓿单序荚果数均显著高于对照;20 mg·L-1处理最高;同样在20 mg·L-1处理苜蓿结荚率最高 (57.06%),显著高于对照和 30 mg·L-1处理的。20 mg·L-1处理苜蓿种子千粒重显著高于对照和 30 mg·L-1处理的,10 mg·L-1处理种子千粒重是对照的1.31倍,说明10 mg·L-16-BA处理苜蓿种子较饱满。不同浓度6-BA对苜蓿单株种子产量影响较大, 20 mg·L-16-BA,苜蓿单株种子产量最高,为5.73 g,是对照种子产量的1.11倍,比10 mg·L-1处理单株种子产量提高了 3.43%(P>0.05)。以上分析表明,外源 6-BA 可提高苜蓿种子产量,20 mg·L-1处理最好,其次为10 mg·L-1。
3 讨论
外源6-BA可提高植物光合速率在多种经济作物中已有研究报道,张海娜等[18]研究发现,经10 mg·L-1的6-BA处理后,棉花(Gossypiumspp.)叶片Pn增加。经6-BA处理后葡萄(Vitis vinifera)叶片的Pn及叶绿素含量升高,并且延长葡萄叶片光合作用功能期[19]。在水分胁迫下,外施6-BA可以增强小麦(Triticum aestivum)的光合特性[20]。吴雪霞等[21]也发现在低温胁迫下,外源6-BA可以增强茄子
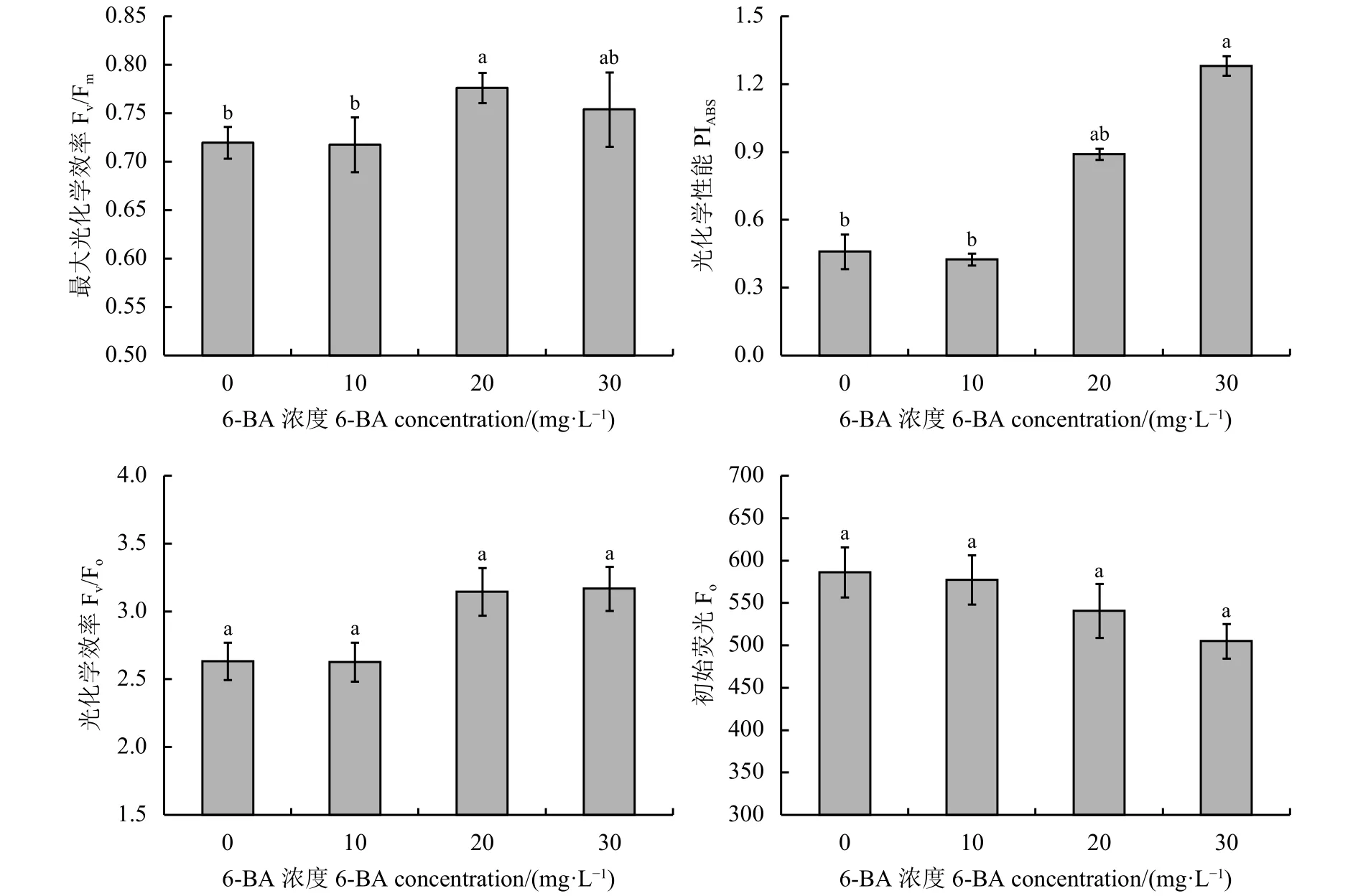
图 2 不同浓度6-BA对苜蓿盛花期叶片荧光参数的影响Figure 2 Changes of chlorophyll fluorescence parameters of alfalfa at flowering stage under different concentrations of 6-BA
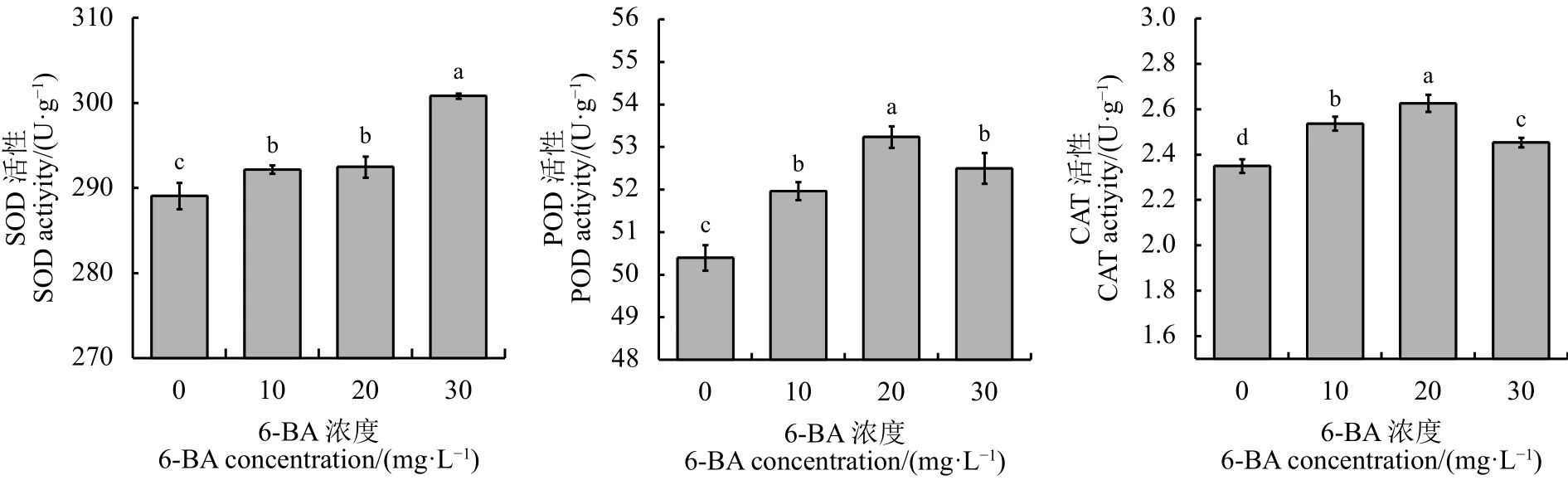
图 3 不同浓度6-BA对苜蓿盛花期叶片抗氧化酶活性的影响Figure 3 Changes of antioxidant enzyme activities in leaves of alfalfa at flowering stage under different concentrations of 6-BA
(Solanum melongena)幼苗光合能力,使茄子幼苗的Pn、Ci、Tr、Gs均有所提高。相关研究也表明,6-BA可影响植物叶片气孔运动,增加叶片气孔开度,减小气孔对CO2扩散的阻力,同时提高RuBP羧化酶等光合作用相关酶的活性,促进光合磷酸化反应的进行[22-23]。在本研究也发现,10和20 mg·L-16-BA 处理后,苜蓿叶片的 Pn、Tr、WUE 均高于对照,提高了苜蓿叶片的光合能力,并且促进光合作用中CO2的吸收和利用。而30 mg·L-16-BA处理后,苜蓿叶片的Pn低于对照。植物叶片Pn下降的原因分为两种情况,一是非气孔限制因素,表现为Pn下降的同时伴随Ci的升高;二是气孔限制因素,表现为Pn下降的同时,Ci也随之下降[24-25]。本研究中发现,6-BA 浓度为 30 mg·L-1的 处理下,苜蓿叶片Pn低于对照,Ci高于对照,表明叶片光合速率下降的原因主要为非气孔限制因素,这可能与光化学活性限制、1,5-二磷酸核酮糖羧化限制和无机磷限制等因素,阻碍了CO2的利用,从而造成细胞间隙CO2积累,降低了该处理下苜蓿的光合速率。
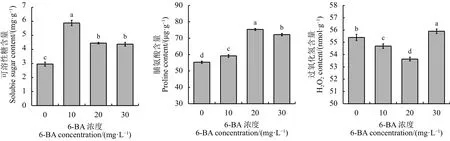
图 4 不同浓度6-BA对苜蓿盛花期叶片脯氨酸、可溶性糖及过氧化氢含量的影响Figure 4 Changes of proline, soluble sugar and hydrogen peroxide content in alfalfa during flowering stage under different concentrations of 6-BA
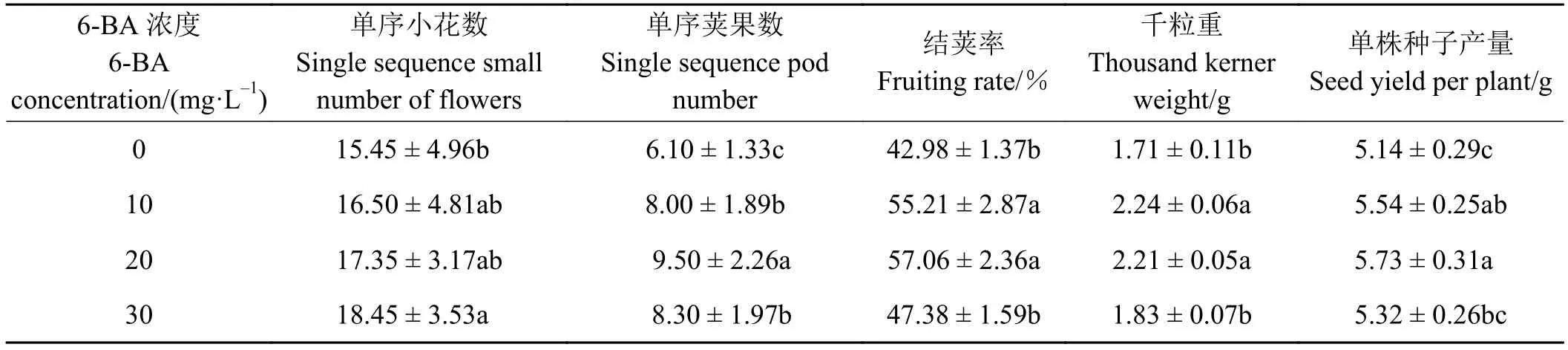
表 1 不同浓度6-BA对苜蓿结荚率的影响Table 1 Effect of different concentrations of 6-BA on alfalfa pod rate
叶绿素荧光动力学参数可以分析高等植物光系统Ⅱ(PSⅡ)内部不同光电子传递过程中的变化和调控作用。在外源6-BA处理后可以显著提高小麦旗叶的Fv/Fm、实际光化学效率(ΦPSⅡ)、光合电子传递速率(ETR)[26]。罗黄颖等[27]研究发现外施吡效隆(CPPU)和6-BA对盐胁迫下番茄(Lycopersicon esculentum)叶片的叶绿素荧光有影响,使番茄叶片主要荧光参数升高。张国斌等[28]也发现,在低温弱光胁迫下辣椒(Capsicum annuum)幼苗经6-BA处理后Fv/Fm、Fv/Fo等荧光参数有所提高。本研究中,喷施不同浓度6-BA使苜蓿叶片的Fo下降,Fv/Fm、Fv/Fo及PIABS升高;随6-BA浓度上升,苜蓿叶片的Fo逐渐降低,表明6-BA可保护叶片类囊体膜结构,减缓PSⅡ的反应中心失去活性。不同浓度6-BA均使苜蓿叶片Fv/Fm有不同程度的提升,说明6-BA可减轻苜蓿叶片在光合作用时的光抑制程度,减缓因光能过剩而使光合电子不能继续传递,对光合机构有保护作用。
外源6-BA可提高油茶(Camellia oleifera)叶片SOD酶活性,减少叶片内丙二醛(MDA)的积累,减轻油茶叶片膜脂过氧化作用[29]。经外源6-BA处理后,能延缓离体杂交水稻叶片的衰老,促进叶片内抗氧化酶中的SOD、POD、CAT的活性增强,减少活性氧的积累[30]。猕猴桃(Actinidia chinensis)经不同浓度6-BA处理后,叶片内叶绿素降解变慢,SOD酶活性下降缓慢,膜透性减小,延缓叶片衰老[31]。植物组织中抗氧化酶活性较高,可及时清除自由基,减缓活性氧等物质对光合机构的破坏,促进光合磷酸化反应,提高光和电子传递效率,有利于光合作用的进行。在本研究中,不同浓度6-BA均使苜蓿叶片内SOD、POD、CAT酶活性增强,脯氨酸及可溶性糖含量高于对照,减少了叶片内过氧化氢的积累,效果最佳的处理为20 mg·L-1的6-BA。
外源6-BA可提高植物的坐果率,增加产量,减少果实的脱落,张文学等[32]在齐穗期通过叶面喷施30 mg·kg-1的6-BA,发现6-BA可提高水稻的结实率,与对照相比提高3.85%,并且提高了种子的千粒重。在豇豆(Vigna unguiculata)、羽扇豆(Lupinus micranthus)、草地早熟禾(Poa pratensis)的研究中也发现,叶面喷施细胞分裂素可提高其结荚率和种子产量[33-35]。本研究中,10 和 20 mg·L-1的6-BA处理后,苜蓿的结荚率、千粒重及种子产量均高于对照,表明6-BA可提高紫花苜蓿结荚率和种子产量。但 30 mg·L-16-BA 处理下,虽然单序小花数最多,但单序荚果数较少,所以结荚率及种子产量仅略高于对照,这可能是由于喷施的6-BA溶液浓度较高,影响了苜蓿的内源激素调控网络,导致了苜蓿花和荚的脱落。
4 结论
20 mg·L-16-BA处理后,提高了苜蓿叶片的光合能力和叶片的抗氧化酶(POD、SOD、CAT)活性,减轻了叶片的膜脂过氧化程度,并提高了苜蓿的结荚率及单株种子产量,与对照相比,结荚率提高了14.08%,单株种子产量提高了11.48%。
