一株巨菌草内生生防菌的分离、鉴定及其基因组测序分析
2019-04-04宋昭昭贾雨雷黄在兴林标声林占熺
宋昭昭,贾雨雷,黄在兴,林标声,3,梅 兰,林占熺
(1. 福建农林大学生命科学学院,福建 福州 350002;2. 国家菌草工程技术研究中心,福建 福州 350002;3. 龙岩学院生命科学学院,福建 龙岩 364012)
巨菌草(Pennisetum giganteumsp.)属于禾本科狼尾草属多年生植物,其分蘖速度快、根系发达、叶面积宽[1],茎粗可达3.5 cm、株高最高可达708 cm,适宜在热带、亚热带栽培,已推广到巴布亚新几内亚、马来西亚、卢旺达、莱索托、南非、埃及及我国福建、广西和海南等地种植[2]。巨菌草为典型的C4植物,其营养丰富,纤维、粗蛋白、糖分等含量高、适口性好、根系发达、生物量大等[2-3],因此不仅广泛应用于栽培食药用菌[4]、生态脆弱区的治理与修复[5],同时还可用于发电、生产沼气及乙醇、造纸等领域[6-8]。是一种具有较强应用价值的能源草、生态草。
生物防治是使农业可持续发展的重要途径之一,内生菌(Endophyte)作为生防菌是近年来研究的热点[9]。内生菌是寄生在健康植物组织内、但不引起植物组织明显病害症状的一类微生物,包括真菌、细菌、放线菌及古细菌等多种微生物类群[10]。其作为生防资源在一定程度上可以减少对环境的污染。内生菌对其寄主植物起到生防作用主要通过4个主要途径:产生抗生素;竞争生态位和营养;诱导寄主产生系统抗性和促进植物生长[11]。关于植物内生菌在防治病害、促进植物生长发育、固氮方面等的作用,国内外均有一定研究[12]。其中,内生链霉菌的研究主要集中在水稻(Oryza sativa)、生姜(Zingiber officinale)、牛筋草(Eleusine indica)、柽柳(Tamarix chinensis)、香蕉(Musa paradisiaca)等植物上,但对巨菌草的内生菌研究却鲜有报道。
玉蜀黍平脐蠕孢(Bipolaris maydis)是引起禾本科植物玉米小斑病 (Corn southern leaf blight)的一种非专性寄生病原菌。该病菌引起的玉米小斑病是世界玉米种植区一种重要的叶部病害[13],玉米小斑病在中国玉米主产区每年都有不同程度的发生,个别年份甚至猖獗流行,可引起玉米(Zea mays)叶片过早干枯,轻者降低千粒重,重者导致果穗腐烂、种子发黑、发芽率降低,严重影响玉米的产量和品质[14]。目前,对玉米小斑病的防治主要为化学防治和选育抗病品种等手段,但效果较差。近年来,随着绿色农业的发展,采用内生菌拮抗玉蜀黍平脐蠕孢成为了防治玉米小斑病的一个重要研究方向。
本研究从巨菌草中分离出一株对玉蜀黍平脐蠕孢有抑菌活性的巨菌草内生菌,采用Illumina Miseq第二代测序技术对其基因组序列进行测序分析,以期为该菌株的功能基因组学研究提供基础数据,为深入研究该菌株在生物防治方面的作用及其遗传多样性提供理论基础。
1 材料和方法
1.1 材料
在国家菌草工程技术研究中心试验基地采集健康的巨菌草根、茎秆、叶片样本,样本采集后立即清洗干净,带回实验室处理。
植物病原菌: 玉蜀黍平脐蠕孢由福建农林大学国家菌草工程技术研究中心从多年栽培的巨菌草患病叶片中分离保存,传代培养采用PDA培养基(土豆 200 g,葡萄糖 20 g,琼脂 20 g,水 1 L,pH自然),28 ℃ 培养 3 d。
1.2 方法
1.2.1 内生拮抗菌株分离
样品用无菌水冲洗,75%酒精和2%次氯酸钠分别消毒1和5 min,无菌水冲洗3~5次。每100 mg样品与1 mL无菌水混合,充分研磨,进行10-2,10-3,10-4,10-5浓度梯度稀释,各取 100 μL 分别涂布于PDA培养基、LB培养基(胰蛋白胨10 g,酵母提取物 5 g,NaCl 10 g,琼脂 20 g,水 1 L,pH 7.2)、高氏一号培养基 (可溶性淀粉 20 g,硝酸钾 1 g,磷酸氢二钾 40.5 g,硫酸镁 0.5 g,氯化钠 0.5 g,硫酸亚铁 0.01 g,琼脂 20 g,水 1 L, pH 7.2)上,28 ℃
培养3~5 d,挑取具有不同形态特征的菌落,经多次平板划线纯化后,4 ℃保存备用。
对内生菌抑菌活性的初筛、复筛采用对峙法[15]。初筛出优良菌株进行复筛,每个处理3个重复。数据处理使用DPS数据处理软件。
1.2.2 内生拮抗菌株的菌株鉴定
形态特征和培养特征:参照《链霉菌鉴定手册》[16],利用细菌微量生化鉴定管对菌株JK7-2进行生理生化鉴定。
16S rDNA的序列分析:使用快速无毒DNA提取试剂盒(高提取量型)(福州麦力生物科技有限公司)提取基因组DNA,以此为模板,使用27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-ACGG TTACCTTGTTACGACTT-3')通用引物进行16S rRNA基因PCR。产物送上海生工测序。利用NCBI (National Center for Biotechnology Information)(www.ncbi.nih.gov/BLAST/)搜索其同源基因,采用DNAMAN进行序列同源性比对分析,采用MEGA7.0 软件构建 NJ (neighbor joining)分子系统进化树。
1.2.3 内生拮抗菌株的基因组测序和分析
使用 MOBIO PowerSoil® DNA Isolation Kit按照操作步骤提取基因组DNA,经琼脂糖凝胶电泳、Nanodrop检测和Qubit检测DNA质量。将纯化的基因组DNA经Covaris破碎仪随机打断成长度为300 bp小片段,经末端修复和加A尾后在片段两端连接接头制备DNA文库。
库检合格后,利用 Illumina HiSeq PE150高通量测序平台对该生防菌株DNA文库进行进行基因组测序。采用spade程序对去除接头序列的测序数据进行从头拼接,基因组序列基本评估,对拼接的数据进行评价。选取大于200 bp的 scaffold序列进行后续分析。采用Velvet 1.2.10组装软件进行序列组装,运用原核基因组注释工具prokka[17]对菌株基因组进行注释,并与GO,COG,KEGG等数据库进行比对分析。其中蛋白编码基因的GO注释采用根据Pfam的结果通过Pfam2go[18]软件来完成;蛋白编码基因的COG的注释采用blast软件来完成;蛋白编码基因的Pathway注释采用KEGG的KAAS自动化注释系统完成。通过对蛋白编码基因进行功能注释和分类,从而获得菌株基因组功能注释信息。
2 结果和分析
2.1 拮抗菌的筛选
从巨菌草根、茎、叶中分离到45株菌株。经过复筛得到10株抑菌率大于10%的菌株(表1),抑菌效果最好的菌株为JK7-2,抑菌率为28.57%,其发酵液对玉蜀黍平脐孺孢有强烈的抑制作用(图 1)。
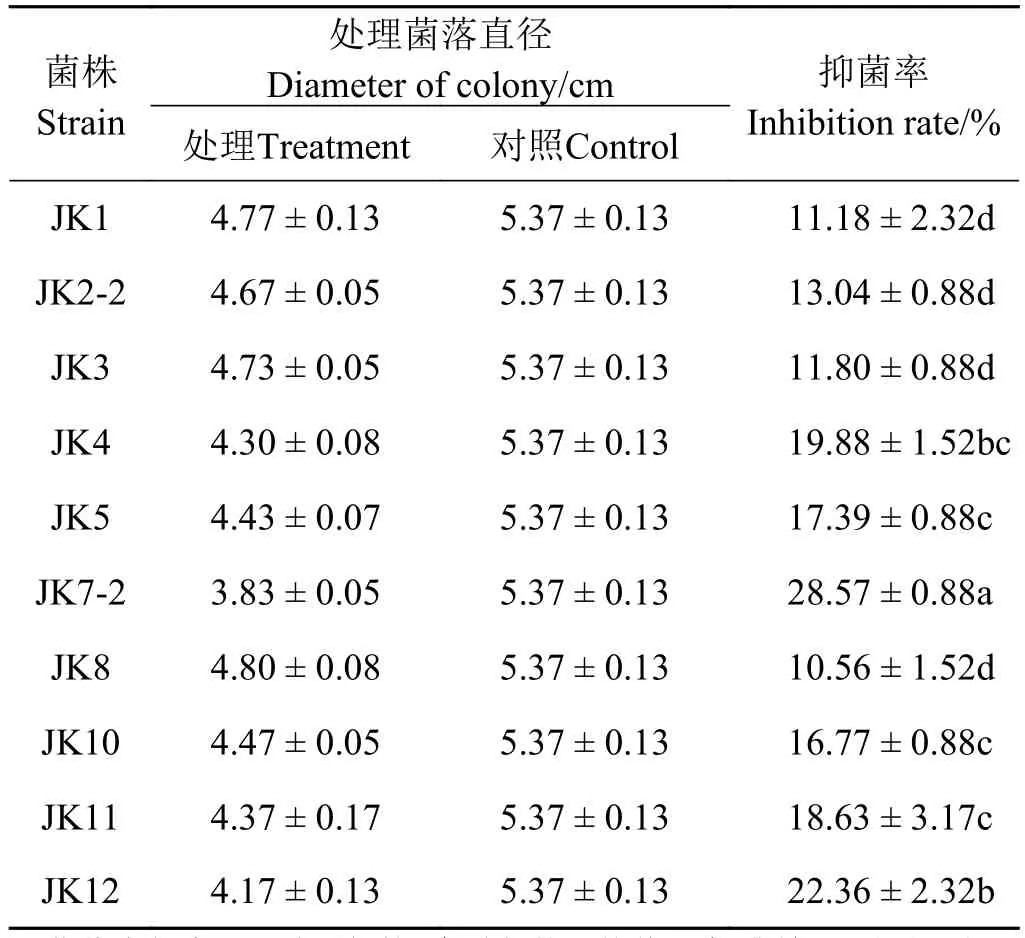
表 1 内生菌对玉蜀黍平脐孺孢的抑菌效果Table 1 Inhibition effect of endophytes to Bipolaris maydi
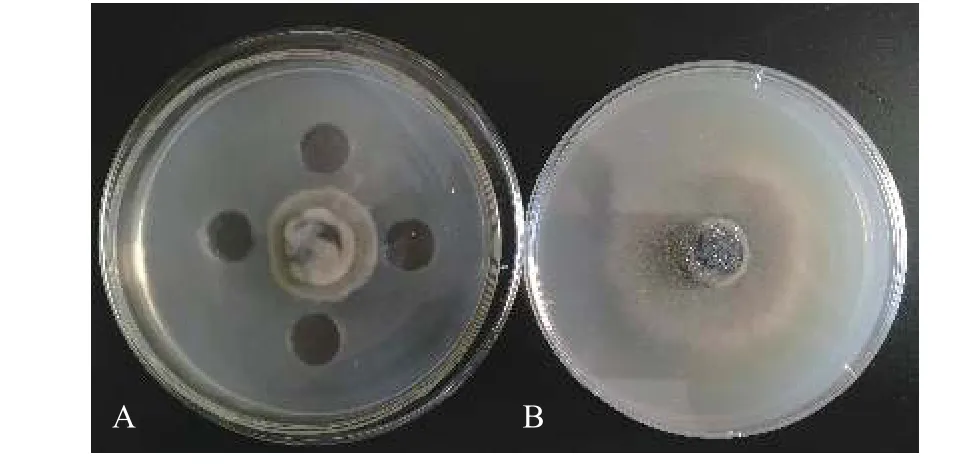
图 1 菌株JK7-2发酵液的抑菌试验Figure 1 Bacteriostasis experiment of strain JK7-2 with fermentation broth

表 2 菌株JK7-2对碳源的利用情况Table 2 Utilization of carbon source by strain JK7-2
2.2 拮抗菌的菌株鉴定
菌株JK7-2在高氏一号培养基上生长丰茂,菌落为浅灰色,气生菌丝发达,革兰氏染色为阳性。显微镜下观察,孢子丝直,柔曲,松敞螺旋形。部分生理生化特征鉴定结果如表2所列,菌株JK7-2能够利用葡萄糖、果糖、麦芽糖、半乳糖等碳源,但不能利用乳糖、棉籽糖、甘露醇和木糖等碳源。将本结果同《链霉菌鉴定手册》上不同种菌株进行比对,并结合JK7-2在培养基上形态及显微镜下观察结果,可初步判定为链霉菌属(Streptomycessp.)。
对JK7-2菌株进行16S rDNA序列测定,测序结果在NCBI数据库进行blast比较,利用软件MEGA7对菌株JK7-2的16S rDNA序列与同属的其他菌株的16S rDNA进行序列比对,构建系统进化树(图2)结果表明,菌株 JK7-2 与菌株Streptomycessp. SIIA 2050位于同一系统发育分支上,结合其生理生化特性和培养特征,该菌株属于链霉菌属的链霉菌。
2.3 基因组组装与注释
原始测序数据结果表明,菌株JK7-2基因组中有 5 207 939个原始读数 (raw reads),总碱基数为781 190 850。经过序列拼接得到77个骨架(scaffold),其中 40个大于 1 000 bp,GC含量为73.17%,序列长度为 8 818 289 bp。预测该菌株其编码 7 432 个基因,基因总长度为 7 654 773 bp,编码基因占基因组百分比为86.80%。将测序原始数据上传至NCBI数据库,获得SRA BioProject Accession(生 物 工 程 ID): PRJNA451251(alias:ERR1216363)。
2.4 Streptomyces sp. JK7-2蛋白质COG聚类分析
基于原核基因组注释工具 prokka对细菌基因组进行注释的基因预测结果表明,菌株JK7-2共预测得到7 432个基因,通过COG数据库进行blast比对分析(E-value<1E-10),成功获得COG功能注释的有6 677个蛋白基因(图3)。主要为一般功能预测、转录相关、碳水化合物运输与代谢、氨 基酸运输与代谢、能源生产和转换、次级代谢产物合成等。

图 2 基于菌株JK7-2及其他链霉菌属菌株的16S rDNA序列构建的NJ进化树Figure 2 NJ evolution tree constructed from strain JK7-2 and other 16S rDNA sequences of Streptomyces strains

图 3 菌株JK7-2的蛋白质COG聚类分析Figure 3 Protein COG cluster analysis of strain JK7-2
将预测基因的蛋白序列与GO数据库进行比对获得GO注释信息,蛋白编码基因的GO注释采用根据Pfam的结果通过Pfam2go软件来完成。GO注释包括基因的分子功能、参与的生物学过程、所处的细胞位置。如图4所示,共有8 758个基因成功获得GO功能注释。在生物学过程方面,主要与代谢过程(1 434个)、单组织过程、细胞内过程、和定位有关;在细胞组分方面,主要与膜(608个)、细胞(127个)、细胞部分和细胞器有关;在分子功能方面,主要与催化活性(1 817个)、结合(1 150个)、核酸结合转录因子的活性和转运活性有关。
2.5 KEGG代谢通路分类
根据KEGG对该菌株分析得知,菌株基因组共有1 611个基因得到注释。糖代谢、氨基酸代谢以及膜运输为菌株基因组最主要涉及的几种代谢通路,分别有222个、219个和133个基因注释结果(图5)。进一步通过KEGG PATHWAY数据库分析发现,菌株JK7-2有354个与抗生素合成有关通路得到注释。此外还发现20个链霉素和5个四环素已及17个青霉素等抗生素产生通路相关的基因。
3 讨论与结论
链霉菌属原核生物界放线菌目链霉菌科具有丝状分支菌丝的革兰氏阳性细菌[19],广泛分布于土壤、海洋、极端环境及一些生物体内[20]。该属的大多数成员能产生在医疗、农业、生物防治等领域具有重要意义的天然次级代谢物[21]。较土壤放线菌而言,植物内生放线菌研究较少且所处生境特殊,成为新菌株和天然活性化合物的新来源,在促生、抑制病虫害等方面具有广阔应用前景[22]。链霉菌能利用拮抗作用抑制其他植物病原微生物,其作用机制一般包括拮抗作用、竞争作用和诱导植物抗性作用等[23]。链霉菌可通过产生抗生素等多种活性物质,来抑制病原菌的生长和繁殖,在生物防治和环境保护领域具有广阔应用前景。
DNA是生命遗传信息的载体,但是,遗传信息和生命功能的体现却主要由蛋白质来完成,因此,蛋白质编码基因的功能注释是微生物全基因组分析的核心内容。通过对蛋白质编码基因的功能进行注释,才能对该物种的生命活动在分子的水平上有所认识[24]。本研究采用Illumina HiSeq第二代高通量测序技术对分离自巨菌草的具有抗病 原真菌特性的链霉菌菌株JK7-2进行基因组测序,从JK7-2菌株基因功能注释结果来看,COG数据库的比对结果显示转录相关、碳水化合物运输与代谢、氨基酸代谢是菌株主要的功能预测结果,值得注意的是,该菌株与次级代谢产物合成相关基因有349个,拥有这么多的次级代谢产物合成基因极有可能是该菌株产生多种生物抗菌活性物质的主要原因;通过GO数据库的比对,代谢过程、膜、催化活性等注释结果呈现出较高的相关性;利用KEGG数据库中的代谢通路分析手段,确定了菌株主要代谢通路的组成,发现多个与链霉素、青霉素和四环素产生等代谢通路相关的基因。根据这些信息,初步推测该菌株具有一定的抗生素代谢功能,为今后该菌株代谢功能,生物防治功能的探究奠定了基础。

图 4 菌株JK7-2 的GO功能归类Figure 4 GO functional classification of strain JK7-2

图 5 菌株JK7-2 的KEGG功能归类Figure 5 KEGG functional classification of strain JK7-2
抗生素是非常重要的一类来源于微生物次级代谢产物的药物。农用抗生素不仅可直接开发作为农药防治农作物的病虫草害,而且还为化学农药的创制提供了先导化合物[25]。链霉菌属是公认的抗生素和次级代谢产物主要来源,本研究通过对JK7-2基因进行预测,获得了多个抗生素和次级代谢产物合成基因,为相关化合物的合成机制研究提供数据。
本研究从巨菌草内分离出了一株内生菌JK7-2,通过形态特征、生理生化反应及16S rDNA序列分析结果将其鉴定为链霉菌,通过发酵液抑菌试验得知,该菌株对玉米小斑病菌有良好的抑制作用,这对开发新型绿色安全的抗微生物制剂和生物农药具有重要意义。本研究的相关结果将为Streptomycessp. JK7-2 的功能基因组学研究及相关次级代谢产物的生物合成途径研究提供帮助;同时从分子生物学的角度初步探究了该菌株的生长代谢及抑菌功能机制,为今后巨菌草内生链霉菌生物防治相关机制研究的深入开展提供了重要的数据参考。
