黄芩苷对酯多糖损伤AC16心肌细胞的保护作用及机制研究
2019-04-03包斯图翟羽佳
王 智,王 娟,包斯图,翟羽佳
1北华大学附属医院,吉林 132001;2通辽市医院,通辽 028000;3吉林市中心医院,吉林 132001
脓毒症是一种全身感染性疾病,可引起多脏器功能衰竭、休克,尽管在医疗技术发达的今天,脓毒症28天死亡率仍高达32%[1]。脓毒症心肌损伤是脓毒症的主要合并症,据统计脓毒症患者40%~50%出现心肌抑制,7%发生心力衰竭[2]。LPS是G-菌细胞壁的主要成份,也是目前公认的脓毒症动物及细胞模型的诱导剂[3]。大量研究证实[4,5],LPS可导致炎性因子直接损伤心肌细胞并产生大量活性氧,损伤线粒体膜,影响ATP合成,激活细胞凋亡程序,进而导致心功能障碍的发生。
黄芩苷是唇形植物黄芩的有效成分之一,其具有抗凋亡,抗肿瘤,抗炎,抗病毒,抗氧化,清除自由基,调节免疫等多种生物学作用[6,7]。赫连曼等[8]通过制备高血压心肌病大鼠模型,证实黄芩苷可通过抑制内质网应激引发的心肌细胞凋亡,从而逆转心室重构。另有学者证实[9,10],黄芩苷对于衣霉素、羟自由基损伤的心肌细胞均有一定的保护作用。本团队在前期研究中证实,黄芩苷可通过抑制心室肌细胞β-AR/PKA/CaMKⅡ信号通路表达,从而起到减少心肌细胞凋亡,逆转心室重构的作用[11]。但黄芩苷对于酯多糖损伤心肌细胞的保护作用尚未见报道,本研究拟通过培养人源AC16心肌细胞并制备酯多糖损伤模型,在细胞学水平模拟脓毒症心肌损伤模型,观察黄芩苷对酯多糖损伤心肌细胞线粒体的保护作用,为黄芩苷治疗脓毒症心肌损伤提供基础理论依据。
1 材料与方法
1.1 药物、试剂与仪器
黄芩苷(江北药业,批号 13659,纯度≥98%;黄芪总黄酮(齐鲁制药有限公司);二乙酸荧光素(美国Spectrum公司,货号F1184);AC16细胞购自广州莱德尔公司;AnnexinV-FITC / PI凋亡检测试剂盒(美国Invitrogen公司,货号V13241);;甘油醛-3-磷酸脱氢酶(GAPDH)一抗、凋亡蛋白酶活化因子-1(Apaf-1)、(英国Abcam公司,货号ab4825); caspase-9,caspase-3一抗(中国博士德公司,货号分别为BA0690,BM3957);WD-9413B型凝胶成像系统(北京六一生物科技有限公司);四唑盐比色法(MTT)试剂盒(北京碧云天公司,货号20170305) SD Cell 型转移电泳槽(美国Bio-rad公司);VE-180 型垂直板电泳装置(北京原平皓生物科技有限公司);FACSCanto Ⅱ型流式细胞仪(美国 BD公司);SpectraMax M4型多功能酶标仪(美国Molecular Devices公司)。
1.2 细胞培养与分组
人源AC16心肌细胞于10%胎牛血清中,于5%浓度CO2条件下置于37 ℃恒温箱中进行培养,培养24 h后,检测细胞活力,取生长对数期的细胞随机分为6组:对照组、LPS组(100 ng/mL LPS)、黄芩苷高剂量组(18 μmol/L+100 ng/mL LPS)、黄芩苷中剂量组(9 μmol/L +100 ng/mL LPS)、黄芩苷低剂量组(4.5 μmol/L +100 ng/mL LPS)[9]及黄芪总黄酮组(20 mg/L+100 ng/mL LPS)[12],共同培养6 h。
1.3 细胞活力检测
采用二乙酸荧光素染色检测AC16心肌细胞活力。取生长对数期AC16细胞置于6孔板中培养24 h,细胞贴壁后弃掉培养液及未贴壁细胞。贴壁细胞分为6组,对照组正常培养,酯多糖(LPS)组细胞加入100 ng/mL LPS,黄芩苷组细胞在LPS组细胞基础上分别加入18、9、4.5 μmol/L黄芩苷,黄芪总黄酮组在LPS组基础上加入20 mg/L黄芪总黄酮,培养24 h后,用PBS缓冲液将二乙酸荧光素浓度调定在2.5 μg/L,20 ℃条件下避光孵育20 min,在显微镜下进行观察,确认二乙酸荧光素积累活细胞内(激发波长488 nm,发射波长530 nm),并进行拍照。
1.4 细胞存活率检测
采用四唑盐比色法(MTT)试剂盒检测各组细胞存活率,严格按照说明书操作;在酶标仪检测吸光度为450 nm条件下计算OD值,细胞存活率=实验组OD值/对照组OD值×100%。
1.5 心肌细胞三磷酸腺苷(ATP)含量检测
每组细胞培养24 h后,吸除6孔板中培养液并加入200 μL裂解液。裂解后4 ℃条件下2 000 rpm,离心10 min取上清。将样品加入96孔板后,加入100 μL ATP检测工作液,震荡混匀。使用多功能酶标仪测定相对光单位值。根据标准品的检测值绘制出标准曲线,根据标准曲线计算出样品中ATP浓度。
1.6 流式细胞仪检测心肌细胞凋亡率
制备单细胞悬液:各组心肌细胞胰酶消化20~25 min,加入小牛血清终止消化;沉淀重复上述步骤,如此反复实验几次,用300目尼龙网过筛去掉较大团块;低速(500 rpm)离心5 min,弃上清。沉淀加入生理盐水,离心5 min,弃上清;重复3次,制成单细胞悬液,调整细胞的浓度为1×105个,加入AnnexinV-FITC 5 μL,充分混匀后再加入PI 5 μL混匀,常温下避光反应15 min,AnnexinV-FITC、PI荧光选取FSC作为阈值,排除样品中的各种碎片及鞘液中的小颗粒,在CELQuest软件获取并分析数据,心肌细胞凋亡率=早期凋亡细胞%+晚期凋亡细胞%。
1.7 Western Blot检测各组心肌细胞Cyt C、Apaf-1、caspase-9、caspase-3表达
提取各组心肌细胞蛋白,BCA法测定各组蛋白浓度,制备上样液。取各组待测样品20 μL和5 μL蛋白Marker,加入至SDS-PAGE电泳装置中,进行电泳,转膜后脱脂牛奶封闭2 h,加入相应一抗(1∶1 000),4 ℃孵育过夜,TBST洗膜3次,加入二抗anti-rabbit(1∶1 000)室温孵育2 h,TBST洗膜3次,ECL显像,暗室曝光,扫描胶片,用凝胶图象处理系统分析。目的蛋白的相对表达量=目的蛋白的灰度值/内参GAPDH的灰度值。
1.8 统计学处理

2 结果
2.1 二乙酸荧光素染色监测AC16细胞活力
与对照组相比,LPS组心肌细胞结构不完整,细胞体积缩小,密度明显降低;与LPS组相比,黄芩苷低、中、高剂量组与黄芪总黄酮组虽然心肌细胞体积出现不同程度的缩小,但心肌细胞密度明显提高(见图1)。
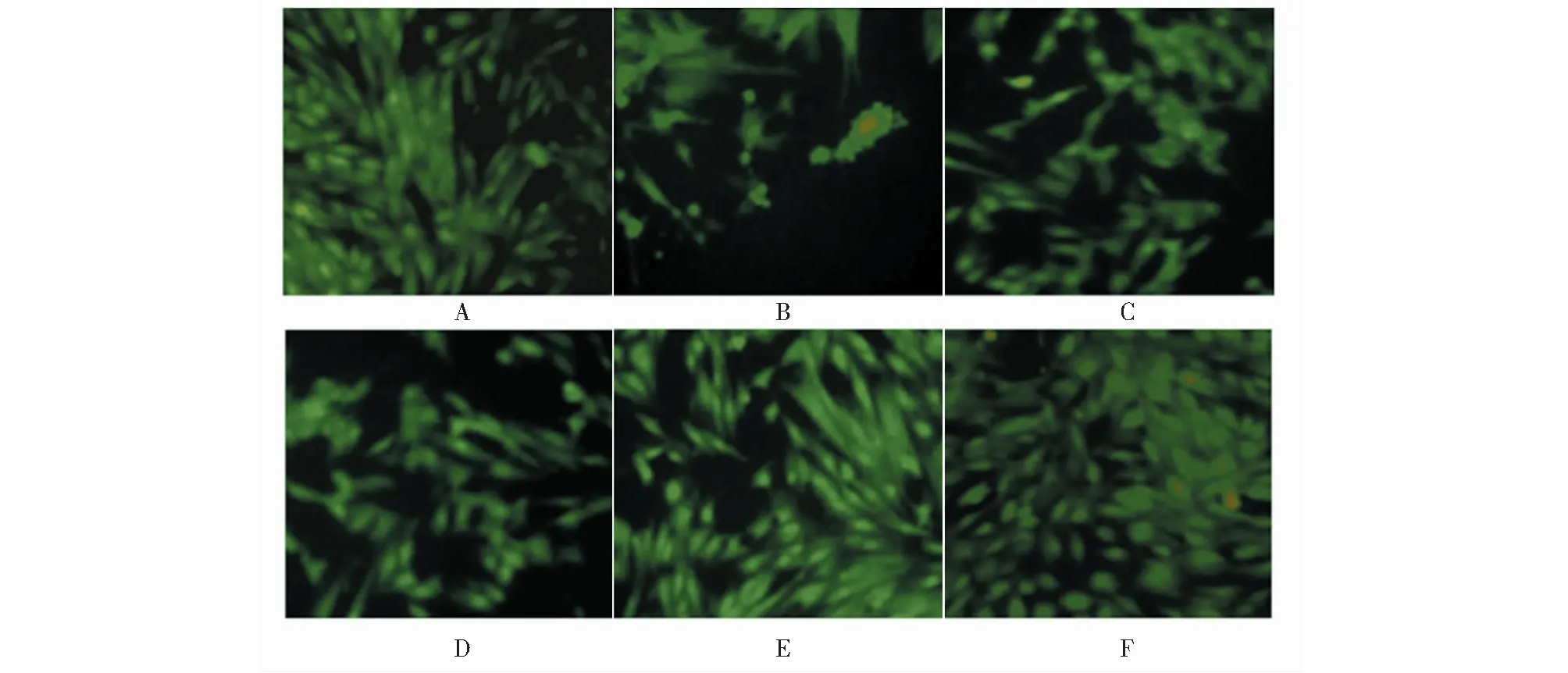
图1 黄芩苷对LPS损伤AC16细胞二乙酸荧光素染色(×200)Fig.1 Baicalin staining of LPS-damaged AC16 cells with fluorescein diacetate (×200)注:A:对照组;B:LPS组;C:黄芩苷低剂量组;D:黄芩苷中剂量组;E:黄芩苷高剂量组;F:黄芪总黄酮组。Note:A:control group;B:LPS group;C:baicalin-L;D:baicalin-M;E:baicalin-H;F:total flavonoids of astraglus.

图2 黄芩苷对LSP损伤AC16细胞存活率的影响Fig.2 Effect of baicalin on the survival rate of LSP-damaged AC16 注:对照组:Control;LPS组:LPS;黄芩苷低剂量组:Baicalin-L;黄芩苷中剂量组:Baicalin-M;黄芩苷高剂量组:Baicalin-H;黄芪总黄酮组:TFA;与对照组相比,*P<0.05,与LPS组相比,#P<0.05。Note:Control group:control;LPS group:LPS;baicalin low dose group:baicalin-L;baicalin medium dose group :baicalin-M;baicalin high dose group:baicalin-H;total flavonoids of astraglus group:TFA;compare with control group,*P<0.05;compare with LPS group,#P<0.05.
2.2 黄芩苷对AC16细胞存活率影响
与对照组相比,LPS组存活率降低,差异有统计学意义(P<0.05);与LPS组相比,黄芩苷低、中、高及黄芪总黄酮组存活率均升高,且随着剂量的升高而升高,差异有统计学意义(P<0.05)(见图2)。
2.3 各组AC16细胞三磷酸腺苷(ATP)含量
与对照组相比较,LPS组ATP含量降低,差异有统计学意义(P<0.05);与LPS组相比,黄芩苷低、中、高及黄芪总黄酮组ATP含量均升高,且随着剂量的升高而升高,差异有统计学意义(P<0.05)(见图3)。
2.4 各组AC16细胞凋亡率检测
流式细胞仪分析结果显示:对照组细胞凋亡率为4.7%,LPS组细胞凋亡率为27.0%,黄芩苷低、中、高剂量组及黄芪总黄酮组细胞凋亡率分别为21.0%、14.5%、8.6%及12.5%。与对照组相比,LPS组心肌细胞凋亡率上升,差异有统计学意义(P<0.05);与LPS组相比,黄芩苷高、中、低剂量组及黄芪总黄酮组心肌细胞凋亡率下降,差异有统计学意义(P<0.05)(见图4)。

图3 黄芩苷对LPS损伤AC16细胞ATP含量的影响Fig.3 Effect of baicalin on ATP content in AC16 cells injured by
2.5 各组AC16细胞中Cyt C、Apaf-1、caspase-9及caspase-3表达
与对照组相比,LPS组心肌细胞中Cyt C、Apaf-1、caspase-9及caspase-3表达升高,差异有统计学意义(P<0.05);与LPS组小鼠相比,黄芩苷高、中、低剂量组及黄芪总黄酮组心肌细胞Cyt C、Apaf-1、caspase-9、caspase-3表达降低,差异有统计学意义(P<0.05)(见图5,表1)。
3 讨论
在脓毒症急性期,对心肌细胞损伤以线粒体损伤为主,可导致患者心功能受损,影响患者预后。脓毒症心肌损伤学说较多,有研究证实[13],脓毒症大鼠血清中一氧化氮、血管内皮素-1等舒张血管因子表达均减少,说明脓毒症可能通过破坏血管内皮正常舒张功能,导致冠脉相对缺血引发心肌损伤。另外,线粒体损伤是目前研究脓毒症心肌损伤的热点之一,心脏搏动昼夜不停,需要大量能量维持心肌细胞正常的生理作用,因此在人体中所有细胞中心肌细胞线粒体最为发达。已有研究表明[14-16],脓毒症可通过炎症因子损伤、氧化应激损伤、钙超载及线粒体损伤等多重机制导致心肌细胞发生凋亡。李登辉在基础研究中发现[17],脓毒症大鼠在早期血清肌钙蛋白(cTnI)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)即可出现升高,且炎症因子与心肌损伤标记物表达呈正相关,说明脓毒症在早期可通过炎症反应损伤心肌细胞。本团队在既往的研究中发现,黄芩苷在多种心血管疾病中,均有抑制心肌细胞凋亡的作用,其机制与阻断β-AR/PKA/CaMKⅡ信号通路、内质网应激信号通路有关[8,11]。王鹏等[18]通过观察黄芩苷对缺血再灌注大鼠心肌细胞,证实黄芩苷对正常心肌细胞自噬无影响,但可显著减少缺血再灌注心肌梗死面积,并降低再灌注后过度自噬的发生。本研究通过在细胞培养液中添加LPS制备脓毒症心肌损伤模型,并给予不同浓度黄芩苷进行治疗。研究发现,LPS损伤的AC16心肌细胞活力及细胞存活率下降,细胞凋亡增多,经黄芩苷治疗后心肌细胞活力及细胞存活率均升高,且细胞凋亡数量减少。说明LPS确实损伤心肌细胞,并导致心肌细胞凋亡,而黄芩苷对于LPS损伤心肌细胞有明显的保护作用。

图4 黄芩苷对LPS损伤AC16细胞凋亡率的影响Fig.4 The effect of baicalin on the apoptosis rate of AC16 cells injured by LPS注:A:对照组;B:LPS组;C:黄芩苷低剂量组;D:黄芩苷中剂量组;E:黄芩苷高剂量组;F:黄芪总黄酮组。Note:A:control group;B:LPS group;C:baicalin-L;D:baicalin-M;E:baicalin-H;F:total flavonoids of astraglus.
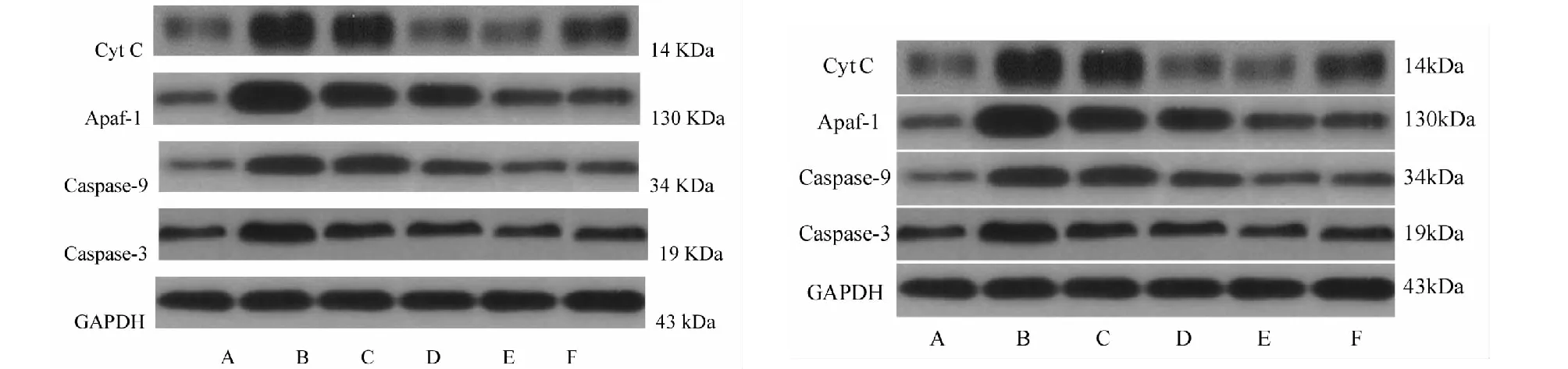
图5 黄芩苷对LPS损伤AC16细胞Cyt C、Apaf-1、caspase-9及caspase-3表达电泳图Fig.5 Electrophoresis pattern of baicalin,Cypac C,Apasp-1,caspase-9 and caspase-3 in AC16 cells injured by baicalin 注:A:对照组;B:LPS组;C:黄芩苷低剂量组;D:黄芩苷中剂量组;E:黄芩苷高剂量组;F:黄芪总黄酮组。Note:A:control group;B:LPS group;C:baicalin-L;D:baicalin-M;E:baicalin-H;F:total flavonoids of astraglus.

组别GroupCyt C/GAPDHApaf-1/GAPDHcaspase-9/GAPDHcaspase-3/GAPDH对照组 Control0.62±0.080.43±0.050.13±0.010.35±0.06LPS组 LPS1.84±0.25∗2.28±0.31∗1.16±0.14∗1.52±0.28∗黄芩苷低剂量组 Baicalin-L1.47±0.19#1.26±0.2#1.02±0.11#0.68±0.08#黄芩苷中剂量组Baicalin-M0.84±0.16#1.10±0.08#0.57±0.04#0.62±0.05#黄芩苷高剂量组Baicalin-H0.56±0.09#0.83±0.07#0.42±0.04#0.36±0.04#黄芪总黄酮组Total flavonoids of astraglus0.79±0.06#0.82±0.09#0.61±0.05#0.86±0.13#
注:与对照组相比,*P<0.05,与LPS组相比,#P<0.05。
Note:Compare with control,*P<0.05;compare with LPS group,#P<0.05.
在本研究中发现,黄芩苷可有效增加LPS损伤AC16细胞中ATP的含量,保证细胞能量供给,这可能是黄芩苷增加细胞活性,减少心肌细胞凋亡的重要因素之一。细胞凋亡可能不是细胞唯一的死亡方式,但却是目前在结构、生化及基因水平已知蛋白质构成的死亡通路唯一形式。Cyt C/ Apaf-1/caspase-9/caspase-3信号通路,是心肌细胞线粒体凋亡的主要信号通路之一。当线粒体损伤发生后,释放到胞质中的Cyt C与多聚化的Apaf-1结合,再与辅因子ATP结合,形成复合体,在此过程中促凋亡因子Bax与抑制凋亡因子Bcl-2亦参与了Cyt C与Apaf-1的结合,共同激活caspase-9形成凋亡体,开启瀑布效应激活caspase-3的因子,触发凋亡反应[19-20]。本研究证实,黄芩苷可有效抑制AC16心肌细胞中Cyt C/ Apaf-1/caspase-9/caspase-3信号通路的表达,并且剂量越高,细胞中表达越低。与之前的实验结果共同分析,推测黄芩苷可能通过阻断Cyt C/ Apaf-1/caspase-9/caspase-3信号通路的激活,并增强心肌细胞中ATP的含量,减少心肌细胞凋亡, AC16细胞受到LPS损伤得以缓解,进而增强心肌细胞活力及生存率。但其作用靶点是从内源性凋亡信号通路上游即开始发挥抑制作用,亦或对Cyt C/ Apaf-1/caspase-9/caspase-3信号通路的中间蛋白及相关催化酶均有抑制作用,需进一步实验加以佐证。
综上所述,黄芩苷可抑制LPS损伤心肌细胞中Cyt C/ Apaf-1/caspase-9/caspase-3信号通路的表达,减少心肌细胞凋亡,增强线粒体内ATP的合成,从而起到提高心肌细胞活性及生存率的作用,并为黄芩苷在脓毒症心肌损伤的临床实践治疗中提供基础理论依据。
