G蛋白偶联受体120激动剂促进巨噬细胞胆固醇流出的研究
2019-04-02张小奕李红霞黄秀清唐蔚青
安 童 张小奕 李红霞 满 永 窦 琳 黄秀清 唐蔚青
动脉内膜下巨噬细胞大量吞噬修饰的低密度脂蛋白而形成富含胆固醇酯的泡沫细胞是动脉粥样硬化发生、发展的关键步骤[1]。巨噬细胞胆固醇反向转运即巨噬细胞通过其表面转运蛋白将胆固醇流出到细胞外的接受体并转运回肝脏进行代谢的过程,已被认为具有抗动脉粥样硬化的作用[2];而巨噬细胞胆固醇流出是巨噬细胞胆固醇反转运的第一步也是关键步骤[3-5]。因此促进巨噬细胞胆固醇流出对动脉粥样硬化的防治具有十分重要的意义。
G蛋白偶联受体120(G protein-coupled receptor 120,GPR120)是具有7次跨膜保守结构的视紫红质家族受体,长链脂肪酸是其天然配体,化合物GW9508也可以激活GPR120。激活的GPR120可拮抗细菌脂多糖和肿瘤坏死因子等诱导的巨噬细胞炎症,促进巨噬细胞由M1型向M2型转化[6-7]。然而,GPR120在巨噬细胞胆固醇代谢中的作用未见报道,本文以GW9508激活RAW264.7巨噬细胞GPR120,研究其在胆固醇流出中的作用及可能的机制。
材料与方法
1.材料 RAW264.7小鼠单核巨噬细胞株购自中国医学科学院细胞库;GW9508购自美国Cayman公司;载脂蛋白(apolipoprotein,apo)A1、高密度脂蛋白(high density lipoproteins,HDL)、牛血清白蛋白(bovine serum albumin,BSA)购自美国sigma公司;NBD-胆固醇(22-(N-(7-Nitrobenz-2-Oxa-1,3-Diazol-4-yl)Amino)-23,24-Bisnor-5-Cholen-3β-Ol)、Trizol购自美国Invitrogen公司;反转录试剂盒、MTS购自Promega公司;2xSYBR购自日本Takara公司;BCA蛋白浓度测定试剂盒购自美国Thermo公司;PCR引物由北京赛百盛生物公司合成;兔抗人ATP结合盒转运体(ATP-binding cassette,ABC)A1和G1和B族清道夫受体1(Scavenger receptor class B type 1,SR-B1)单克隆抗体购自美国NOVUS公司;鼠抗人β-actin单克隆抗体、辣根过氧化物酶标记羊抗兔和羊抗鼠IgG相关抗原抗体购自北京中杉金桥生物公司。
2.方法 (1)RAW264.7细胞在含10%FBS、青霉素(105U/L)、链霉素(105U/L)的DMEM培养基,于37℃、5%CO2的培养箱中培养。
(2)将RAW264.7细胞接种于6孔板中培养;换含0.2%BSA的DMEM培养基,负载2μg/mL荧光标记的胆固醇(NBD-TC)24 h;经含0.2%BSA的DMEM培养基平衡细胞12 h后;用50~200μmol/L的GW9508处理细胞18 h;换无酚红的DMEM培养基(含15μg/mL apo-A1和35μg/mL HDL)孵育细胞5h;收集培养基,同时用1N的氢氧化钠破碎细胞;使用荧光酶标仪(激发波长485nm,发射波长535nm)分别测量培养基及细胞的荧光强度。胆固醇流出率为:培养基的荧光强度/(培养基的荧光强度+细胞内的荧光强度)×100%。
(3)将RAW264.7细胞接种于96孔板中培养;用50~200μmol/L的GW9508处理细胞18h;每孔加入40μL的MTS试剂,培养箱孵育4 h;于酶标仪490nm处读取各孔吸光值;以空白对照组吸光度值为基准,计算细胞存活率。
(4)50~200μmol/L的GW9508处理RAW264.7细胞18h,用RIPA裂解液提取细胞总蛋白,BCA法检测蛋白浓度。将25μg蛋白经8%的SDS-PAGE凝胶电泳分离后,电转移至PVDF膜上。于含5%脱脂牛奶的TBST中室温封闭2 h;用相应抗体(ABCA1、ABCG1、SR-B1、β-actin)于4℃孵育24 h后,TBST洗膜;用与一抗相应的辣根过氧化物酶标记的二抗于室温孵育PVDF膜2 h;TBST洗膜后用ECL化学发光法检测,Image J软件分析蛋白条带灰度值。
(5)100和200μmol/L的GW9508处理RAW264.7细胞18h,用Trizol提取总RNA;经DNA酶处理后,将2μg的RNA反转录为cDNA。定量PCR反应体系为20μL,含0.2 ng的cDNA,5 pmol/L引物,和10μL 2xSYBR。定量PCR反应条件为:50℃,2 min;95℃,10 min;95℃,15 s;60℃,1 min,循环40次。引物序列见表1。
3.统计学方法 采用GraphPad Prism 6.0软件进行统计分析。计量数据以均数+标准差表示,两组间比较采用t检验。以P<0.05为差异有统计学意义。

表1 检测基因的引物序列
结 果
1.GPR120激动剂GW9508促进RAW264.7细胞的NBD-胆固醇流出 为了观察GPR120激活是否能够促进巨噬细胞胆固醇流出,我们用50~200 μmol/L的GPR120激动剂GW9508处理负载NBDTC的RAW264.7细胞,经分析NBD-TC的流出率后发现:与对照组(0μmol/L GW9508)相比,100、150和200μmol/L的GW9508均可以促进NBD-TC向细胞外apo-A1和HDL-C的流出,且呈剂量依赖性;NBDTC流出率分别增加了8%、10%及18%(图1)。
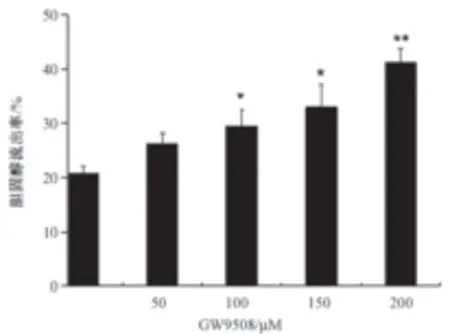
图1 50-200μmol/L的GW9508对RAW264.7细胞胆固醇流出的影响(n=4)注:与 对 照 组(0μmol/L)相 比,*P<0.05;**P<0.01
2.50~200μmol/L的GW9508均不影响RAW264.7细胞的存活率 为了检测50~200 μmol/L的GW9508是否具有细胞毒性,我们用GW9508处理RAW264.7细胞18h后,用MTS方法检测了细胞存活率,发现与对照组(0μmol/L GW9508)相比,50、100、150和200μmol/L的GW9508均不改变细胞的存活率(图2)。因此,50、100、150和200μmol/L的GW9508均无细胞毒性。
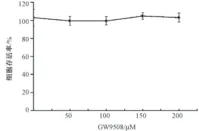
图2 GW9508对RAW264.7细胞存活率的影响(n=5)
3.GPR120激动剂GW9508提高RAW264.7细胞ABCA1、ABCG1的表达 ABCA1、ABCG1和SRB1是巨噬细胞胆固醇流出的主要转运体。为了探讨GPR120是如何促进RAW264.7细胞胆固醇流出的,我们用100及200μmol/L的GW9508处理细胞18h后,定量PCR方法检测了细胞ABCA1、ABCG1和SR-B1的mRNA水平,发现与对照组(0μmol/L GW9508)相比,100及200μmol/L的GW9 508分别升高了ABCA1的mRNA水平3.6倍和6.8倍,分别升高了ABCG1的mRNA水平1.6倍和3.3倍,但没有改变SR-B1的mRNA水平(图3A)。
同时,我们用50~200μmol/L的GW9508处理RAW264.7细胞18h后,Western blot方法检测了ABCA1、ABCG1和SR-B1的蛋白水平,发现与对照组(0μmol/L GW9508)相比,GW9508可以升高ABCA1和ABCG1的蛋白表达水平且呈剂量依赖性;100、150及200μmol/L的GW9 508分别上调了ABCA1的蛋白水平1.4倍、1.8倍和4.8倍,分别上调了ABCG1的蛋白水平1.3倍,3.2倍和5.1倍。然而,50~200μmol/L的GW9508均不影响SR-B1的蛋白表达水平(图3B~C)。
4.GPR120激动剂GW9508提高RAW264.7细胞LXRα的表达水平 肝X受体(Liver X receptors,LXRs)和过氧化体增殖物激活受体(Peroxisome proliferators-activated receptors,PPARs)都可以参与ABCA1和ABCG1的表达调控,为了确定是否它们在GW9508诱导的Raw264.7细胞ABCA1和ABCG1表达中也起调控作用,我们用定量PCR的方法检测了它们的表达水平,发现:100和200μmol/L的GW9508均可上调Raw264.7细胞LXRα的mRNA水平,分别上调了0.6倍和1.25倍,且差异有统计学意义;但不影响LXRβ、PPARα和PPARγ的mRNA水平(图4)。
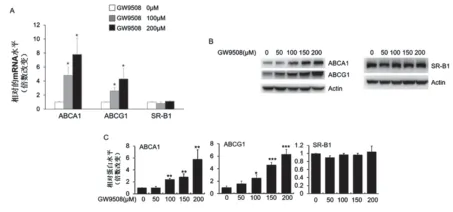
图3 GW9508对Raw264.7细胞的胆固醇转运体ABCA1、ABCG1和SR-B1表达水平的影响(n=3) A:实时定量PCR检测ABCA1、ABCG1和SR-B1的mRNA表达水平;B:Western blot检测ABCA1、ABCG1和SR-B1蛋白表达水平;C:相关蛋白的统计结果;注:与对照组(GW9508 0μmol/L)相比,*P<0.05;**P<0.01;***P<0.001
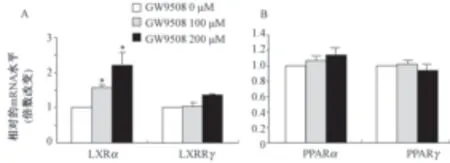
图4 GW9508对Raw264.7细胞的LXRs和PPARs的mRNA水平的影响(n=3)。注:与对照组(GW9508 0μmol/L)相比,*P<0.05
讨 论
动脉内皮下的巨噬细胞通过细胞膜上的转运体(ABCA1、ABCG1和SR-B1)将细胞内过剩的胆固醇转运到细胞外apoA1和HDL-C上,这个过程称为胆固醇流出;它是胆固醇反向转运的第一步,也是关键步骤[1,3]。在巨噬细胞,ABCA1经水解ATP获得能量后,将细胞内的游离胆固醇和磷脂经细胞膜转运到细胞外乏脂的apoA-1上,形成新生的高密度脂蛋白(nHDL),起始了HDL的形成和巨噬细胞胆固醇的逆向转运。ABCG1的主要功能是将细胞内的游离胆固醇转运到细胞外成熟的HDL颗粒上[8]。另外,表达于巨噬细胞的清道夫受体SR-B1也可以介导细胞内的胆固醇流向细胞外的HDL颗粒[9-10]。
GPR120是脂肪酸受体家族成员,在巨噬细胞中高表达。研究发现:与配体结合的GPR120通过激活与其偶联的G蛋白的α亚基Gαq,介导以下生理功能:刺激肠道分泌胰高血糖素样肽-1(Glucagonlike peptide 1,GLP-1),增强胰岛β细胞分泌胰岛素,提高脂肪、肝脏和骨骼肌组织对胰岛素的敏感性;调节脂肪细胞分化、脂肪组织抗炎、以及棕色脂肪的能量代谢等[6,11-13]。另外,激活的GPR120也可以通过β-抑制蛋白(arrestin)2拮抗细菌脂多糖和TNFα等诱导的巨噬细胞炎症,促进巨噬细胞由M1型向M2型的转化[7]。在本研究中,我们首次发现:激活RAW264.7巨噬细胞的GPR120可以促进细胞内的胆固醇向细胞外流出,这一功能是通过上调ABCA1和ABCG1的表达而实现的,而与SR-B1无关。
多种因素在转录和转录后水平严密调控ABCA1和G1的表达。其中核受体家族成员LXRs及PPARs在ABCA1和G1的表达调控中其重要作用;LXR(α和β)是配体激活的核受体,LXRα高表达于巨噬细胞、肝脏和小肠等脂代谢活跃的组织器官,而LXRβ在全身广泛表达。在巨噬细胞,激活的LXR与视黄醛X受体(retinoid X receptor,RXR)形成异源二聚体,可激活其靶基因ABCA1和G1的转录[14]。激活的PPARα和PPARγ也分别可与RXR结合,既能直接激活ABCA1和G1的转录;也能通过激活LXRα,间接上调ABCA1和G1的转录[15]。我们研究的发现:GPR120激动剂GW9508可以上调Raw264.7巨噬细胞LXRα的mRNA表达水平,但不影响LXRβ、PPARα和PPARγ的mRNA表达水平;由此说明:GPR120上调Raw264.7巨噬细胞ABCA1和ABCG1的表达可能是通过激活LXRα来完成的。具体GPR120是如何激活LXRα的,还需要进一步的实验进行证实。
综上所述,我们的研究证实了:在巨噬细胞中,激活的GPR120可以通过LXRα通路上调ABCA1和ABCG1的表达,进而促进细胞内胆固醇向细胞外apoA-1和HDL流出。本研究为动脉粥样硬化的防治提供了新的思路。
