降温方式对鸭梨采后FAD及LOX基因表达及其褐变的影响
2019-04-02樊晓岚李月圆张引引韩云云闫师杰肖丽霞
樊晓岚,李月圆,张引引,韩云云,李 玲,闫师杰,*,肖丽霞*
(1.天津农学院园艺园林学院,天津 300384;2.山西农业大学食品科学与工程学院,山西 太谷 030801;3.天津农学院食品科学与生物工程学院,天津 300384;4.天津市农副产品深加工技术工程中心,天津 300384;5.扬州大学食品科学与工程学院,江苏 扬州 225127)
鸭梨(Pyrus bretschneideri Rehd cv. Yali)是蔷薇科梨属植物,因果柄突起形似鸭头而得名,属中国白梨[1]。鸭梨属耐贮运梨品种,适时(9月中旬)采后适当处理并贮于0 ℃可延长贮藏期至次年的5~6月份,但是流通环节中发生的果心褐变现象(黑心病)很大程度影响了其商品价值[2-3]。鸭梨在入库后30~50 d开始出现果心褐变,至150~180 d时褐变大规模爆发[4],其中30~50 d出现的褐变称为早期褐变,此时鸭梨果心部位出现少量褐变[5],但果肉仍为雪白色,认为是机体组织冷耐受能力不足引起的低温伤害,而贮藏晚期150~180 d褐变组织逐渐发展至果肉部位,直至果实组织全部褐变,完全失去销售价值,此时发生的褐变多归纳为衰老造成的机体紊乱。在一些对植物抗冷品种选育的研究中发现,当植物细胞膜脂中不饱和脂肪酸(unsaturated fatty acids,UFA)含量高时,机体表现出对低温的适应性[6]。同时在一些对易发生冷害热带水果的研究中也发现,随冷藏时间延长,机体UFA与饱和脂肪酸(saturated fatty acid,SFA)的比率降低,认为UFA含量与冷害发生密切相关[7]。脂肪酸去饱和酶(fatty acid desaturase,FAD)能催化机体内SFA特定位置形成双键以形成UFA,在一些模式作物中过表达ω-3FAD可以大大提高植株中UFA含量[8],从而显著提高其抗冷性[9]。对桃果实的研究显示,ω-3FAD基因转录本含量的下降是果实冷害发生的重要原因[10]。另外,脂氧合酶(lipoxygenase,LOX)在高等植物中存在较多,其能催化一些多不饱和脂肪酸(一般是顺,顺-1,4戊二烯结构)转变为SFA,参与了机体多种氧化、过氧化作用,被认为是调控机体成熟衰老的关键酶[11-12]。杨青珍[13]研究了猕猴桃以两种降温方式降至贮藏温度后,贮藏期间其冷害与LOX活性的关系。目前关于ω-3FAD的研究多集中在番茄[14]、桃[15]、香蕉[16]、石榴[17]等果实采后贮藏中的参与机制等,但在鸭梨中鲜见报道;LOX表达与鸭梨褐变形成的相关性已得到证实,但其作用机制仍不清楚。
因此本实验拟通过研究不同方法降温后鸭梨贮藏期间果心褐变指数、果心脂肪酸组成、FAD基因表达情况、LOX活力与LOX基因表达情况,从抗冷性角度解释缓慢降温减少鸭梨褐变的深层机理,为鸭梨采后贮藏研究提供理论参考。
1 材料与方法
1.1 材料与试剂
鸭梨采自河北省石家庄市深州市大城北村,于2015年9月13日采摘(根据农户大量采收经验,9月中旬为适时采收),选择单果质量约(230±10)g、无虫害、无机械损伤的果实进行实验。采摘后套网套装入内衬微孔膜(大小80 cm×75 cm、厚度0.05~0.06 mm、孔径15~20 μm,由国家农产品保鲜工程技术研究中心生产),分装60 箱,每箱25 个果实。将实验材料用厢式货车装载,常温运输到天津农学院。
常用化学试剂均为国产分析纯;反转录试剂盒(RR047A PrimeScript™ RT reagent Kit with gDNA Eraser)、荧光定量试剂盒(RR820A TB Green™ Premix Ex Taq™ II) 宝日医生物技术(北京)有限公司;引物由上海生工公司合成。
1.2 仪器与设备
Thermo 2000c型紫外分光光度计 美国Thermo Fisher Scientific科技有限公司;PX2聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Thermo公司;LX-200迷你离心机 海门市其林贝尔仪器公司;CFX Connect温度梯度定量PCR仪、ChemiDoc X RST凝胶成像仪 美国Bio-Rad公司;A11 BS25分析研磨机德国IKA公司;雪花状制冰机 上海迭戈生物科技有限公司。
1.3 方法
1.3.1 样品处理
分别采用急速降温和缓慢降温对鸭梨进行处理。30 箱急速降温处理(0 ℃预冷24 h,此时微孔膜敞开)后,直接放入(0.0±0.5)℃贮藏(此时微孔膜盖上);另外30 箱缓慢降温处理果实于12 ℃预冷24 h,待果品温度为12 ℃开始降温,每5 d降2 ℃,共30 d降至0 ℃贮藏。每贮藏30 d进行一次实验,随机从每个处理分别选取45 个果实,30 个用于观察果心褐变情况,另15 个取果心组织进行液氮冷冻,并于-80 ℃超低温冰箱保存备用。将贮藏0 d的鸭梨果实(即为刚采摘的新鲜鸭梨)相应处理作为对照材料。
1.3.2 果心褐变指数测定
熟悉常用量具的性能和使用方法,掌握产品各项技术指标,严格执行企业标准、检验规程,进行产品加工过程的质量检验和控制,以及产品的实验和测试,对生产加工过程中出现的产品质量问题进行处理和分析,并及时反馈,针对现场做好制程解析,并进行改善活动,严格执行各项规章制度和工作纪律,树立服务生产的意识。
随机选择的30 个果实,每10 个为一组,共3 组。沿果实赤道部位横切,依据果心横切面褐变面积和程度划分褐变级别,褐变级别与计算方法参考何利华等[18]的方法。
1.3.3 鸭梨果心部位脂肪酸含量的测定与双键指数的计算
果心组织脂肪酸的提取和含量测定参考何子顺等[19]的方法。双键指数(double binding index,DBI)计算参考Shen Wenyun等[20]的方法。
1.3.4 LOX活力的测定
LOX酶液制备及活力测定参照闫师杰等[2]方法。以每毫克果肉每分钟在234 nm波长处吸光度变化0.01为一个酶活力单位(U),单位为U/mg。
1.3.5 鸭梨果心部位总RNA的提取及检测
参考何利华[18]、Gasic[21]等的方法提取RNA,使用核酸蛋白仪测定波长260 nm和280 nm处吸光度,检测总RNA纯度;经质量分数1.2%琼脂糖凝胶电泳检测RNA完整性。如果电泳图完整且OD260nm/OD280nm均在1.9~2.1之间,说明提取的总RNA质量高,适合用于下一步实验。
引物参考美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)登录的中国白梨基因组信息,使用Primer premier 5软件在FAD1、FAD2、FAD3基因保守区设计一对跨内含子引物;LOX引物参照本实验室已获得的鸭梨LOX片段序列设计[22];内参基因引物为鸭梨PbActin。实时荧光定量反转录(quantitative real time reverse transcription, qRT)-PCR引物序列见表1。
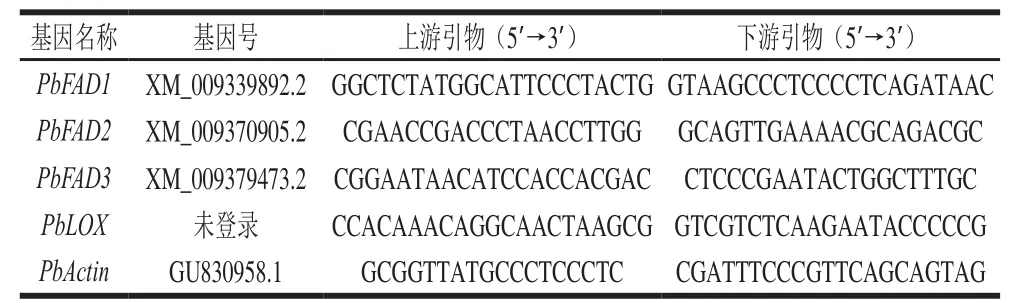
表 1 qRT-PCR特异性引物序列Table 1 Speci fi c primer sequences used for qRT-PCR
1.3.7 cDNA第一条链获取与荧光定量PCR
使用反转录试剂盒获取cDNA第一条链,第一步去除基因组DNA,反应体系包括500 ng/μL RNA、2 μL 5×gDNA Eraser Buffer、1 μL gDNA Eraser,加RNase Free dH2O至10 μL,42 ℃孵育2 min;第二步反转录,反应体系包括10 μL第一步反应液、1 μL PrimeScript RT Enzyme Mix1、1 μL RT Primer Mix、4 μL 5×PrimeScript Buffer 2、4 μL RNase Free dH2O,总体积为20 μL;反应液混匀后立即进行反转录反应:37 ℃孵育15 min,85 ℃热激5 s。cDNA溶液于-20 ℃保存或立即用于PCR反应。
荧光定量PCR使用荧光定量试剂盒。qRT-PCR反应采用25 μL体系:12.5 μL 2×SYBR Premix Ex TaqTMII(Tli RNaseH Plus)、2 μL上引物、2 μL下引物(10 μmol/L)、1 μL cDNA模板(100 ng/μL)、7.5 μL ddH2O;qRT-PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共30 个循环。
以鸭梨PbActin基因为内参基因,以降温前(贮藏0 d)样品中相关基因表达量为标尺,采用2-ΔΔCt方法计算基因相对表达量。
1.4 数据处理与分析
采用SPSS 16.0软件对以上实验所获数据进行统计分析,使用Duncan法比较平均值之间的差异性,P<0.05表示差异显著,P<0.01表示差异极显著。用Excel 2010软件绘图。
2 结果与分析
2.1 不同降温方式对鸭梨贮藏过程中果心褐变指数的影响

图 1 不同降温方式对鸭梨冷藏期间果心褐变指数的影响Fig. 1 Effect of different cooling methods on core-browning index of Yali pears during cold storage
由图1可知,鸭梨急速降温组与缓慢降温组分别于贮藏30 d和60 d开始出现果心褐变。随着贮藏时间的延长,鸭梨果心褐变指数呈不同程度增长趋势。其中,缓慢降温组褐变指数增长趋势比急速降温组缓和,同一贮藏期,在60~180 d急速降温组褐变指数极显著大于缓慢降温组(P<0.01)。贮藏结束时(180 d),缓慢降温组的褐变指数仅0.05%,而急速降温组高达0.31%。以上结果说明,对于适时采收的鸭梨(9 月中旬),采用缓慢降温处理方法能有效延缓果实衰老,抑制鸭梨果心褐变。
2.2 不同降温方式对鸭梨贮藏过程中果心脂肪酸含量的影响
膜脂上脂肪酸分布影响着细胞膜流动性,UFA比例越高流动性越好。在遇到低温环境时,较高的膜流动性保证了细胞正常的物质交换,机体的抗冷性也就越高[23]。本实验检测到鸭梨果心部脂肪酸主要包括硬脂酸(C16:0)、棕榈酸(C18:0)、油酸(C18:1)、亚油酸(C18:2)、亚麻酸(C18:3)。经两种降温处理后鸭梨贮藏期间果心部位脂肪酸分布如表2所示。鸭梨果心的SFA以棕榈酸为主,UFA以亚油酸和亚麻酸为主。鸭梨果心中UFA含量最高的是亚油酸,其次是油酸、亚麻酸。贮藏30 d,缓慢降温组果心中3 种UFA含量均显著高于急速降温组(P<0.05);贮藏60~180 d期间急速降温组果心亚麻酸含量均显著高于缓慢降温组(P<0.05)。整体来看,缓慢降温很好地保持了贮藏初期(0~30 d)鸭梨果心部位UFA含量,而急速降温由于直接置于0 ℃,机体通过一系列调控作用产生更多的UFA来增强抗冷性,以适应温度骤变,这是植物体内自发产生的低温应答机制[24]。

表 2 不同降温方式下鸭梨贮藏过程中果心部位各种脂肪酸含量及双键指数的变化Table 2 Change in fatty acid contents and double-binding index in core tissue of pears subjected to different cooling treatments
DBI是衡量组织中脂肪酸不饱和度的重要指标。如表2所示,贮藏期间鸭梨果心DBI整体呈先增加后下降的变化趋势,缓慢降温组和急速降温组分别在贮藏的120 d和60 d出现最大值。与急速降温组比较,缓慢降温组的DBI变化相对平缓,较好地维持了果实品质。在贮藏期间,急速降温组鸭梨果心脂肪酸不饱和度均显著大于缓慢降温组,冷藏环境诱导了机体的抗冷反应;而相比缓慢降温,急速降温使鸭梨抗冷反应更剧烈,果心中UFA总含量、脂肪酸不饱和度均显著高于缓慢降温的鸭梨,导致果实出现冷害症状,果心褐变严重。
2.3 不同降温方式对鸭梨贮藏过程中果心部位FAD相对表达量的影响
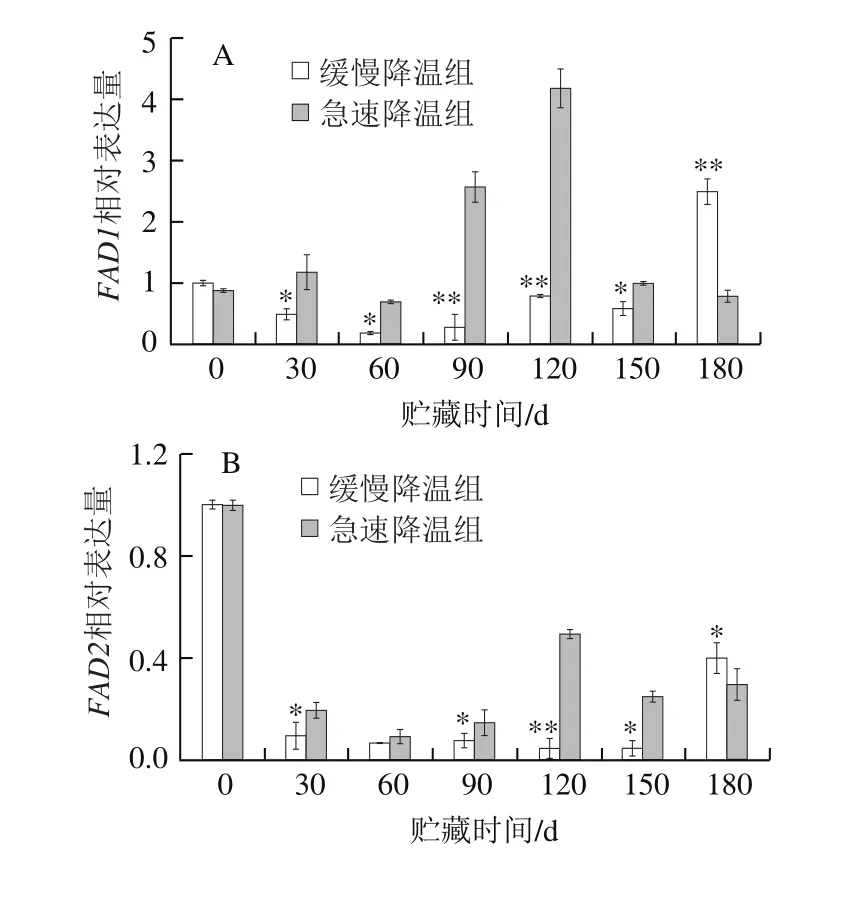
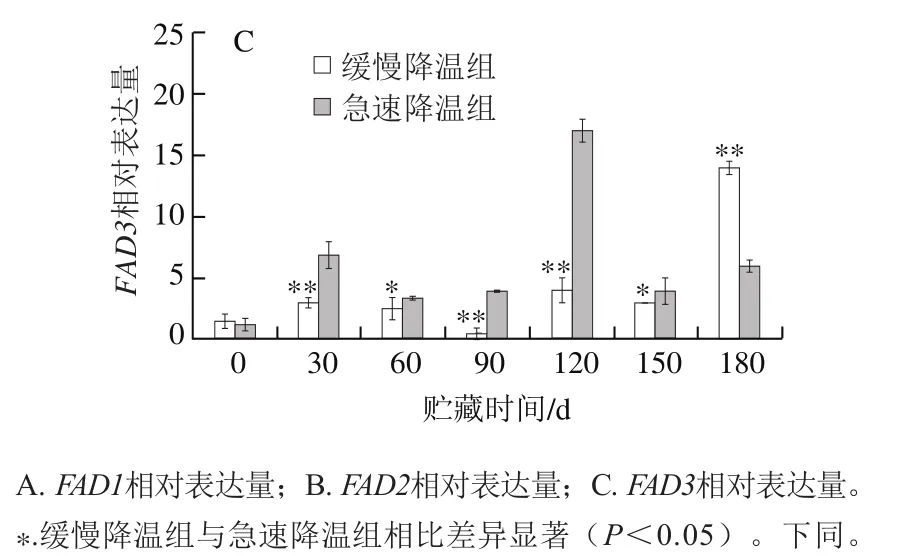
图 2 不同降温方式对鸭梨贮藏过程中果心部位FAD相对表达量的影响Fig. 2 Relative expression levels of FAD gene in core tissue of Yali pears during cold storage after different cooling treatments
目前经全基因组测序确定白梨ω-3FAD共3 个,本实验根据中国白梨基因组信息中3 个ω-3FAD基因序列设计引物,为FAD1、FAD2、FAD3。由图2A可知,急速降温果实FAD1在0~30 d时明显上调,120 d达到峰值(4.3),120~180 d下降至初始值附近。缓慢降温组FAD1基因在贮藏30~150 d不活跃。由图2B可知,FAD2基因在贮藏期间是受到抑制的,经急速降温与缓慢降温处理后,贮藏各时期FAD2相对表达量均低于初始值,且同一贮藏时间急速降温的FAD2相对表达量显著高于缓慢降温(P<0.05)。由图2C可知,FAD3在鸭梨贮藏中较为活跃,贮藏前30 d,相对表达量明显上调,30 d时缓慢降温组和急速降温组分别为初始表达量的2.0、5.4 倍,且贮藏30~150 d,急速降温组FAD3相对表达量显著高于缓慢降温组(P<0.05)。总之,对于3 个ω-3FAD,贮藏30~180 d中,急速降温组中3 个基因都被低温诱导,在120 d达到峰值后下降并趋于平缓,与果心褐变指数120 d达到最大值相吻合,这与魏雯雯[15]在桃中研究结果相一致。而缓慢降温组,因为经过梯度降温,在贮藏期间(30~180 d)鸭梨受冷害情况有所缓解,在贮藏结束180 d时,3 个基因相对表达量才达到最大值,这在葡萄柚[25]的贮藏实验中也有相同的发现。
2.4 不同降温方式对鸭梨贮藏过程中果心部位LOX活力及LOX基因相对表达量的影响
LOX广泛存在于植物体内,启动生物膜上UFA发生过氧化反应,生成一系列生物活性物质,在植物生长发育、果实成熟衰老和胁迫应答等方面发挥重要功能[26]。由图3A可知,两个处理组的鸭梨LOX活力均为先上升后下降然后上升的趋势。其中,在贮藏0~90、150~180 d,急速降温组的LOX活力都高于缓慢降温组。贮藏0 d,由于田间热未散去,且鸭梨衰老度低,LOX活力处于较低水平。在0~30 d,缓慢降温经历30 d梯度降温,温度较高,使鸭梨保持较高的生理代谢水平,受到冷害胁迫不严重,因此LOX活力水平低于急速降温处理,这与韩云云等[27]的研究结果一致。随着贮藏时间的延长,缓慢降温与急速降温组在60 d时LOX活力达到峰值,此时在30~60 d果心褐变指数都有不同程度的升高(图1),这是因为0 ℃低温胁迫诱导LOX活力升高,导致膜结构完整性下降,加剧了低温对鸭梨果实的伤害,但是由于缓慢降温的LOX活力稍低于急速降温处理,因此果心褐变没有急速降温处理严重。
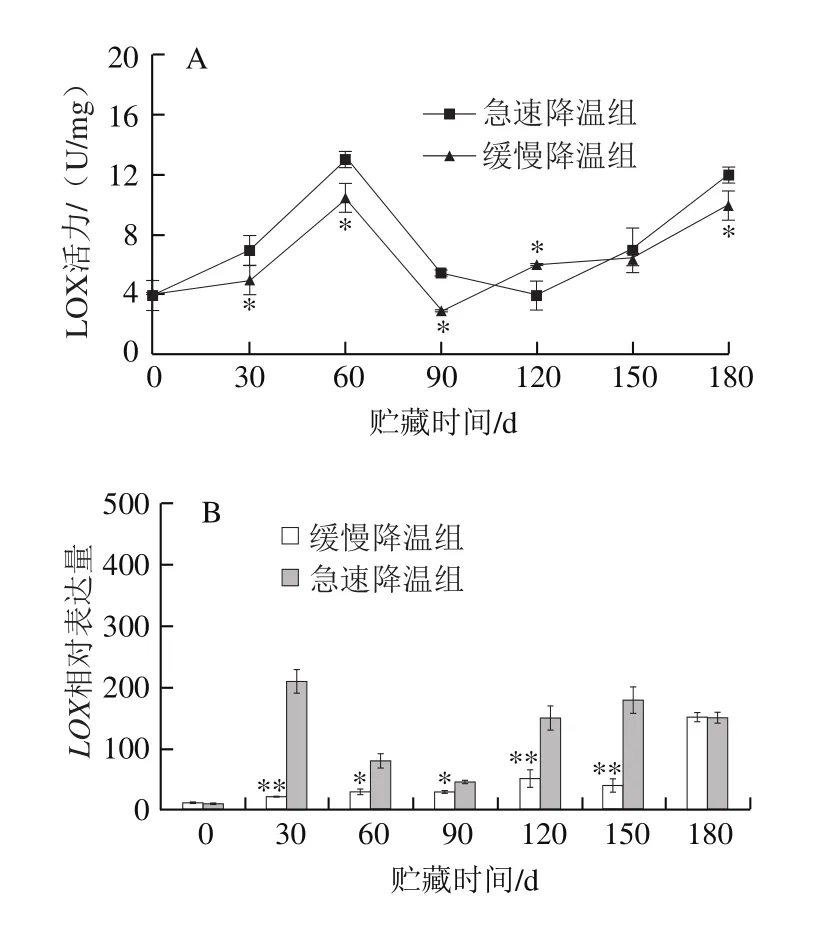
图 3 不同降温方式对鸭梨贮藏过程中果心部位LOX活力(A)及LOX基因相对表达量(B)的影响Fig. 3 LOX activity (A) and relative expression level of LOX gene (B) in core tissue of Yali pears during cold storage after different cooling treatments
由图3B可知,两个处理组LOX基因相对表达量均呈现先缓慢上升至高峰后逐渐下降,贮藏末期又上升的趋势。贮藏0~30 d,急速降温组LOX相对表达量急剧升高,可能是由于鸭梨从室温下突然进入(0±1)℃的冷库环境,受到的冷害胁迫激活了LOX基因的表达,加速了膜脂过氧化。贮藏30~150 d期间,急速降温组的LOX相对表达量高于缓慢降温组,说明缓慢降温处理抑制了LOX基因的表达,从而延缓鸭梨果心褐变的发生。
3 讨 论
减少鸭梨果心褐变发生一直都是研究鸭梨贮藏的热点问题。有研究指出缓慢降温处理适时采收的鸭梨,可以有效抑制其果心褐变,延长贮藏期,提高贮藏品质[28],这是因为适时采收的鸭梨抗冷能力较差,急速降温处理会使果实发生冷害,导致果心褐变[29]。本实验中的鸭梨采于9月中旬,属于适时采收,采用缓慢降温处理降低了果心褐变指数,这与以往的研究结果相一致。
低温贮藏可延缓成熟衰老进程,是维持采后果实品质最有效的方法之一。然而冷敏果实在低温贮藏过程中易发生生理失调,造成冷害,导致品质下降[30]。植物冷害主要涉及膜流动性改变[31]、代谢酶活性降低[32]等;因此当植物处于低温时,会启动对低温胁迫的响应,体内为了防止细胞大量失水调节渗透势,减少酶活力的降低程度,保护膜结构使其处于稳定状态。相应地,细胞膜组成成分也发生改变,UFA含量增加,有利于植物抗冷[33-34];因此急速降温处理中,受到低温诱导,果心中UFA含量增加,以适应环境温度骤变。ω-3FAD基因也受冷害诱导,急速降温组相对表达量变化较大,而缓慢降温由于程序降温,减少了冷害伤害,这与对番茄[35]、蜜瓜[36]的研究结果相一致。LOX能够催化膜脂过氧化作用,增加脂质的不饱和度,改变细胞膜的流动性,从而导致细胞膜完整性的损失和透过性加大,造成细胞膜区室化的打破,为多酚氧化酶与酚类底物提供反应场所,使组织产生不可逆的损伤,最终引起褐变等代谢紊乱[37-38]。另外在荔枝[39]、香蕉[40]、龙眼[41]和皇冠梨[42]中也发现,LOX作用于细胞膜,造成膜脂降解和区室化分布被打破,从而引起果实褐变。本实验中,由于急速降温组中LOX活力以及相对表达量在贮藏大部分时期高于缓慢降温组;因此急速降温的果心褐变情况比缓慢降温严重,也印证了上述观点。因此,对于9月中旬(适时采收)的鸭梨,采用缓慢降温的方法贮藏,能显著降低果心褐变指数,较好地维持贮藏品质。
4 结 论
本实验采用急速降温和缓慢降温方式对采后鸭梨进行处理,通过测定果心褐变指数、果心中脂肪酸含量、3个ω-3FAD基因相对表达量、LOX活力和LOX基因相对表达量,发现急速降温导致鸭梨果心褐变严重,同时为了抵御低温胁迫,相应的UFA含量增加,受冷害影响贮藏期间ω-3FAD表达量增加,LOX活力升高,导致膜完整性下降,并且低温激活LOX基因表达,加速了膜脂过氧化,降低鸭梨贮藏品质。因此,对于适时(9月中旬)采收的鸭梨,可以采用缓慢降温的方法维持鸭梨的品质。
