桃仁多肽螯合亚铁的抑菌活性及结构表征
2019-04-02杨玉蓉李安平钟政昌喻舟峰
杨玉蓉,李安平,2,*,钟政昌,喻舟峰
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.特医食品加工湖南省重点实验室,湖南 长沙 410004;3.西藏农牧学院食品科学学院,西藏 林芝 860000)
与无机盐补铁剂相比,多肽螯合亚铁更易被肠道吸收、生物学效价更高,是研究的热点[1-2]。目前对多肽螯合亚铁的研究多集中于螯合工艺、结构表征和生物利用度等方面。Hoz等[3]的研究表明多肽螯合亚铁对肠道无副作用;Jaiswal等[4]的研究显示金属元素与多肽螯合后能够有效提高二价金属的生物利用度;斯兴开[5]和Lin Huimin[6]等的研究证实带鱼多肽螯合亚铁能够有效改善大鼠的缺铁性贫血症状;廉雯蕾等[7]的研究表明米蛋白肽螯合亚铁具有良好的化学稳定性;纪晓雯等[8]研究酪蛋白肽螯合铁的螯合机制,证明多肽与亚铁离子的主要螯合位点是羰基。多肽螯合亚铁除具有营养特性外,同时还具有其他生物活性,如抑菌活性和抗氧化活性等[9-10]。霍健聪等[11]的研究表明带鱼下脚料酶解肽螯合亚铁对大肠杆菌、金黄色葡萄球菌等均有较强的抑制作用。林慧敏等[12]发现马鲛鱼、带鱼、鳀鱼、梅童鱼蛋白酶解肽螯合亚铁也有不同程度的抑菌作用。因此,本研究对桃仁脱脂后提取出的蛋白质进行酶解,然后进行超滤分离获得各种分子质量的多肽,将多肽与亚铁离子螯合后,探究各多肽螯合物的抑菌活性,并采用傅里叶变换红外光谱对多肽金属螯合物进行结构表征,以期为多肽螯合亚铁在开发功能性食品过程中减少防腐剂的添加提供理论依据。
1 材料与方法
1.1 材料与试剂
野桃仁产自西藏林芝;大肠杆菌ATCC25922、金黄色葡萄球菌ATCC25923由中南林业科技大学食品科学与工程学院实验室保存。
大豆多肽(分子质量小于5 000 Da) 恒发生物科技有限公司;玉米多肽、小麦多肽(分子质量小于5 000 Da) 苏州亿贝嘉食品添加剂有限公司;氯化钠、四水合氯化亚铁、无水氯化钙、七水合硫酸镁、盐酸羟胺、邻菲罗啉、乙酸钠(均为分析纯) 国药集团化学试剂有限公司;牛肉膏、蛋白胨 北京奥博星生物技术有限责任公司;琼脂粉 北京鼎国昌盛生物技术有限责任公司。
1.2 仪器与设备
IRTracer-100傅里叶变换红外光谱仪 日本岛津公司;真空冷冻干燥机 美国GOLD-SIM公司;高速冷冻离心机 美国Thermo Fisher Scientific公司;超净工作台苏州安泰空气技术有限公司;生化培养箱 上海博迅实业有限公司医疗设备厂。
1.3 方法
1.3.1 桃仁多肽的提取分离和不同分子质量桃仁多肽螯合亚铁的制备
桃仁经脱皮和粉碎,用石油醚脱脂,得桃仁粕;桃仁粕经碱溶酸沉、冷冻干燥后得桃仁蛋白粉;桃仁蛋白粉用碱性蛋白酶进行酶解,酶解液于8 000 r/min离心15 min;上清多肽液用超滤装置进一步分离,获得3 个不同分子质量的桃仁多肽组分PKP1(大于10 000 Da)、PKP2(5 000~10 000 Da)、PKP3(小于5 000 Da),以及未超滤组分PKH;分别将PKH、PKP1、PKP2和PKP3组分与亚铁离子螯合,得到桃仁多肽螯合亚铁PKH-Fe、PKP1-Fe、PKP2-Fe和PKP3-Fe;各组分冷冻干燥后于-20 ℃贮藏备用。
1.3.2 多肽螯合物的制备
桃仁多肽与亚铁、锌、钙和镁离子螯合物的制备:将分子质量小于5 000 Da的桃仁多肽配制成质量分数为4%的溶液,然后按桃仁多肽溶液与螯合金属盐溶液质量比为2∶1分别加入四水合氯化亚铁、七水合硫酸锌、无水氯化钙和七水合硫酸镁,再在加入四水合氯化亚铁的多肽溶液中加入抗坏血酸使其最终质量分数为0.1%,混合均匀后于45 ℃水浴中反应60 min,接着加入无水乙醇沉淀,4 000 r/min离心10 min得沉淀物并干燥,干燥物分别为桃仁多肽螯合亚铁、桃仁多肽螯合锌、桃仁多肽螯合钙和桃仁多肽螯合镁粉末,于-20 ℃条件下保存。
不同植物多肽螯合亚铁的制备:参考Huang Saibo等[13]的方法并加以修改。将分子质量均小于5 000 Da的桃仁多肽、大豆多肽、玉米多肽和小麦多肽配制成质量分数为4%的溶液,其余操作同上。
1.3.3 多肽螯合亚铁离子的螯合率测定
采用邻菲罗啉比色法[14]测定多肽螯合亚铁的亚铁离子质量,以不加亚铁离子的标准液为空白对照,在波长510 nm处测定吸光度,绘制标准曲线(y=0.211x-0.004 5,R²=0.999 1),据此计算多肽螯合亚铁中亚铁离子质量。螯合率的计算如下式所示。
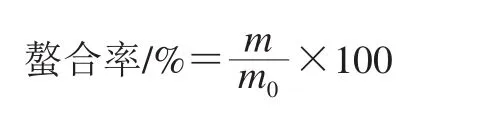
式中:m0为反应溶液中亚铁离子质量/mg;m为多肽螯合亚铁的亚铁离子质量/mg。
1.3.4 菌种活化
参考Wang Fengsheng[15]的方法并稍加修改。将大肠杆菌(ATCC25922)菌种接种至牛肉膏蛋白胨(nutrient broth,NB)斜面培养基中进行活化,在37 ℃下培养24 h后取一环菌种接至50 mL NB液体培养基中,再在37 ℃下培养24 h,制得菌落浓度为106~107CFU/mL的菌悬液,4 ℃保存待用。
金黄色葡萄球菌(ATCC25923)接种至含有2%(质量分数,下同)琼脂的7.5%氯化钠肉汤培养基斜面进行活化,在37 ℃下培养24 h后取一环菌种接至50 mL 7.5%氯化钠肉汤培养基中,再在37 ℃下培养24 h,制得菌落浓度为106~107CFU/mL的菌悬液,4 ℃保存待用。
1.3.5 各多肽金属螯合物抑菌活性的测定
参照da Cruz Almeida等[16]的平板打孔法测定各多肽金属螯合物的抑菌活性。以大肠杆菌为供试菌种。分别将各种待测物配制成40 mg/mL的溶液,以ξ-聚赖氨酸为阳性对照,无菌水为空白对照。取100 μL待测样液加入8 mm的培养基加样孔中,37 ℃恒温培养24 h,观察并测定抑菌圈直径。
1.3.6 多肽螯合亚铁的最小抑菌浓度测定
参考Gomes[17]和杨静[18]等的二倍稀释法测定各样品对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度(minimum inhibitory concentration,MIC)并稍加修改。将待测多肽螯合亚铁、四水合氯化亚铁和ξ-聚赖氨酸配制成40、20、10、5、2.5、1.25、0.625、0.312 5 mg/mL的溶液,以ξ-聚赖氨酸为阳性对照,以无菌水为空白对照。采用平板打孔法,取100 μL待测样液加入检测平板孔径为8 mm的圆孔内,37 ℃下恒温培养24 h,观察抑菌圈直径,以出现抑菌圈的最低质量浓度为MIC。
1.3.7 傅里叶变换红外光谱分析
参考Hou Tao等[19]的方法并稍加修改。取1~2 mg不同多肽及其金属螯合物粉末分别与200 mg KBr置于玛瑙研钵中混合研磨,研细后置于压片模具上150 MPa加压5 min。然后用IRTracer-100傅里叶变换红外光谱仪对样品扫描,扫描范围4 000~400 cm-1,分辨率4 cm-1。
1.4 数据统计与分析
2 结果与分析
2.1 不同分子质量桃仁多肽与亚铁离子螯合物的抑菌活性及螯合率
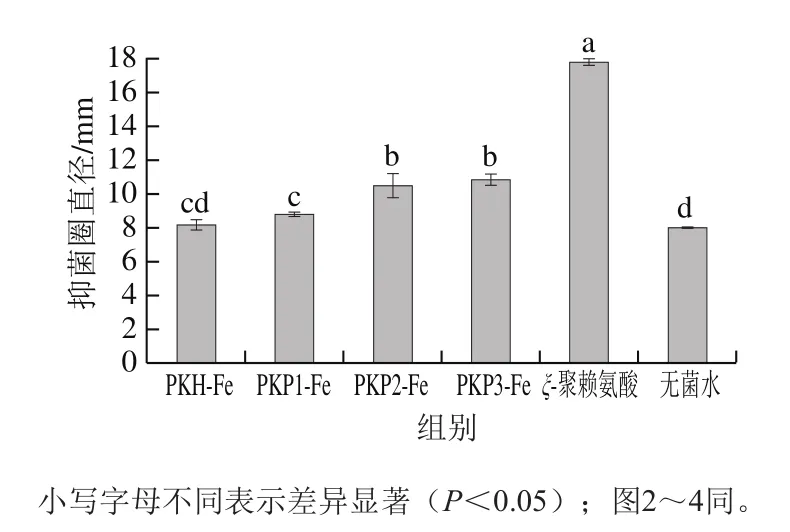
图 1 不同分子质量多肽与亚铁离子螯合物的抑菌圈直径Fig. 1 Inhibition zone diameters of ferrous-chelating peach kernel peptides with different molecular masses
采用邻菲罗啉比色法测得PKH-Fe、PKP1-Fe、PKP2-Fe和PKP3-Fe的亚铁离子含量分别为(118.10±1.81)、(81.45±1.72)、(121.05±1.61)、(145.51±0.81)mg/g。从图1中可知,分子质量较小的PKP2-Fe和PKP3-Fe组分的抑菌圈直径均显著大于分子质量较大的PKP1-Fe组分。PKP1-Fe组分和未经分离的PKH-Fe组分抑菌圈直径没有显著性差异(P>0.05)。林慧敏等[20]研究带鱼多肽螯合亚铁的抑菌活性时也发现小分子质量(1 000~3 000 Da)的带鱼多肽螯合亚铁的抑菌活性高于分子质量较大(5 000~10 000、3 000~5 000 Da)和未经超滤的多肽螯合亚铁。桃仁多肽分子质量与其抑菌圈直径的相关性分析表明,两者呈显著负相关,Pearson相关系数为0.862。因此可知,小分子质量多肽与亚铁离子的螯合物具有更强的抑菌活性。

图 2 不同分子质量桃仁多肽组分与亚铁离子的螯合率Fig. 2 Ferrous chelating rates of peach kernel peptides with different molecular masses
由图2可知,桃仁多肽与亚铁离子的螯合率从大到小依次为PKP3-Fe、PKP2-Fe、PKP1-Fe,与桃仁多肽分子质量呈负相关。
2.2 桃仁多肽与不同金属离子螯合物的抑菌活性
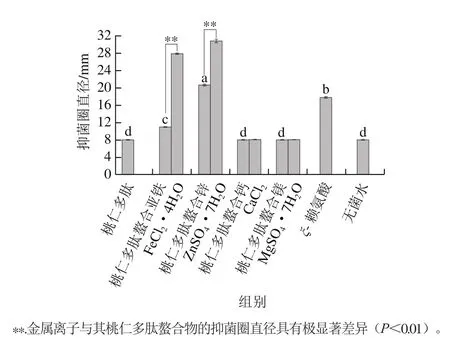
图 3 桃仁多肽与不同金属离子螯合物的抑菌圈直径Fig. 3 Inhibition zone diameters of peach kernel peptide chelating different metal ions
从图3可知,4 种金属离子与多肽形成的螯合物的抑菌圈直径之间存在显著性差异(P<0.05),其中桃仁多肽螯合锌具有最大的抑菌圈直径,达到20.63 mm,甚至高于阳性对照ξ-聚赖氨酸,其次是桃仁多肽螯合亚铁,其
抑菌圈直径显著高于未出现抑菌圈的桃仁多肽螯合钙和桃仁多肽螯合镁(P<0.05)。桃仁多肽、空白对照、钙离子、镁离子均未形成抑菌圈,亚铁离子和锌离子具有较大的抑菌圈直径,且当桃仁多肽与其螯合后仍具有一定的抑菌活性。钙离子和镁离子与桃仁多肽螯合前后的抑菌圈直径均没有变化,但亚铁离子和锌离子与桃仁多肽螯合后的抑菌圈直径极显著降低(P<0.01)。因此,推测桃仁多肽螯合亚铁和桃仁多肽螯合锌的抑菌活性分别与亚铁离子、锌离子的抑菌活性有关。此结论与林慧敏等[12]发现4 种低值鱼蛋白酶解肽没有抑菌活性,而经亚铁修饰后则出现不同程度的抑菌作用的结果类似。
2.3 不同植物多肽与亚铁离子螯合物的抑菌活性
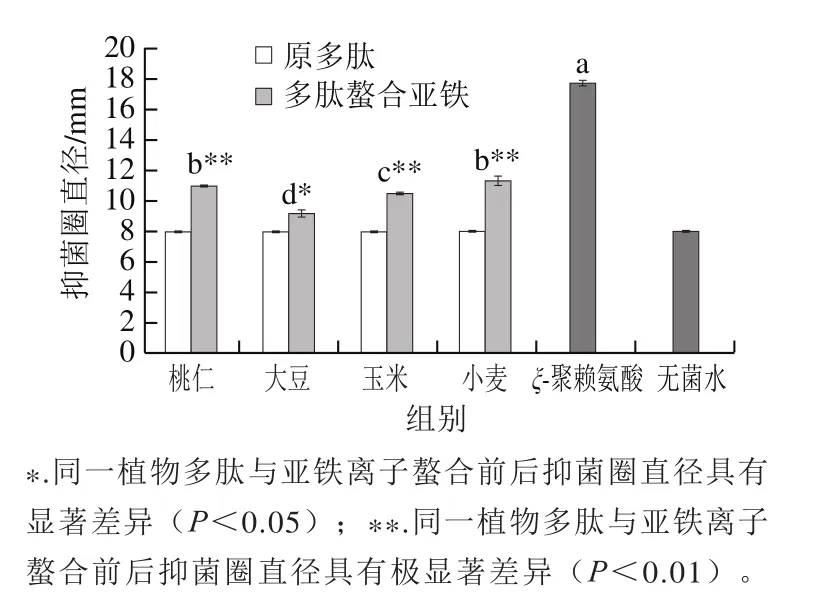
图 4 不同植物多肽与亚铁离子螯合物的抑菌圈直径Fig. 4 Inhibition zone diameters of ferrous-chelating peptides from different plants
由图4可知,桃仁多肽、大豆多肽、玉米多肽和小麦多肽均无抑菌圈形成,但当其与亚铁离子螯合后,螯合物的抑菌圈直径均显著提高(P<0.05,P<0.01),具有一定的抑菌活性。4 种多肽亚铁螯合物中小麦和桃仁多肽螯合亚铁的抑菌圈直径较大,分别达到11.34 mm和10.97 mm,显著大于大豆多肽螯合亚铁和玉米多肽螯合亚铁(P<0.05)。
2.4 不同植物多肽与亚铁离子螯合物的MIC
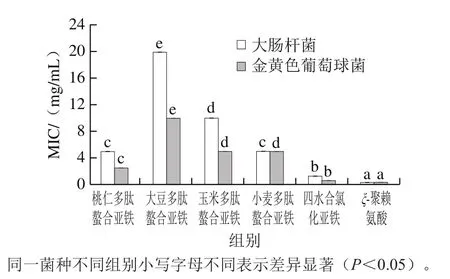
图 5 不同植物多肽与亚铁离子螯合物的MICFig. 5 MIC of ferrous-chelating peptides from different plants
由图5可知,4 种植物多肽亚铁螯合物对大肠杆菌的MIC存在显著性差异(P<0.05)。其中,桃仁多肽螯合亚铁和小麦多肽螯合亚铁的MIC最小,均为5.0 mg/mL,具有最强的抑菌活性;大豆多肽螯合亚铁的MIC最大,为20.0 mg/mL,抑菌活性最弱。4 种多肽螯合亚铁对金黄色葡萄球菌的MIC也有显著性差异(P<0.05),桃仁多肽螯合亚铁的MIC仅为2.5 mg/mL,显著小于大豆、玉米和小麦多肽螯合亚铁。桃仁多肽螯合亚铁在4 种植物多肽亚铁螯合物中具有对大肠杆菌和金黄色葡萄球菌最强的抑制作用。霍健聪等[11]认为带鱼多肽螯合亚铁对大肠杆菌和金黄色葡萄球菌有较强的抑制作用,与本研究结果相似。钟明杰[21]发现多肽螯合亚铁对革兰氏阳性菌(如金黄色葡萄球菌和枯草芽孢杆菌)的抑菌效果优于对革兰氏阴性菌(如大肠杆菌和沙门氏菌)的抑菌效果。
2.5 桃仁多肽及其不同金属离子螯合物的傅里叶变换红外光谱

图 6 桃仁多肽及其不同金属离子螯合物傅里叶变换红外光谱Fig. 6 FTIR spectra of peach kernel peptide and peach kernel peptide chelating different metal ions
由图6可知,桃仁多肽与不同金属离子螯合后,在3 300、1 550、1 400、1 100、600 cm-1附近的吸收峰与螯合前相比发生了明显位移。在3 300 cm-1附近的宽峰属于酰胺A带,是由N—H的伸缩振动导致的特征峰[22]。桃仁多肽螯合亚铁离子、锌离子、钙离子和镁离子后,在酰胺A带的特征峰出现不同程度的红移,可推测桃仁多肽分子中的N—H在与金属离子螯合后形成了N—Fe、N—Zn、N—Ca和N—Mg结构。Chen Jun等[23]通过分析罗非鱼皮多肽螯合钙的傅里叶变换红外光谱图得出罗非鱼皮多肽分子的N—H参与形成肽钙螯合物的结论。酰胺I带(1 700~1 600 cm-1)主要是由C=O伸缩振动引起的[24-25],N—H的弯曲振动和C—N的伸缩振动引起酰胺II带(1 600~1 500 cm-1)[26]。在酰胺I带和酰胺II带中,桃仁多肽与桃仁螯合金属离子特征峰有不同程度的位移,推测金属离子与多肽分子的C=O和N—H键形成了配位键。
1 400 cm-1附近为氨基酸残基侧链基团—COO-伸缩振动引起的吸收峰[27]。桃仁多肽在此处的吸收峰位于1 396.46 cm-1处,其与不同金属离子螯合后此处的特征峰均发生明显的蓝移,移至1 415.75~1 423.47 cm-1范围内,可推测有—COO—Fe、—COO—Zn、—COO—Ca和—COO—Mg结构形成。Liu Wenying等[28]用傅里叶变换红外光谱对鲑鱼骨胶原肽螯合钙分析时也认为多肽分子与钙离子形成了—COO—Ca结构。1 100 cm-1附近的吸收峰由C—O的伸缩振动导致[29]。桃仁多肽与亚铁离子和钙离子螯合后此处的吸收峰发生蓝移,桃仁多肽与锌离子和镁离子螯合后此处的吸收峰红移,由此可推测金属离子与C—O形成C—O—Fe、C—O—Zn、C—O—Ca和C—O—Mg结构。400~800 cm-1范围内的吸收峰由C—H和N—H伸缩振动导致[30]。桃仁多肽与钙离子和镁离子螯合后在此处出现强吸收峰,可推测形成了N—Ca和N—Mg结构。
2.6 不同植物多肽及其亚铁螯合物的傅里叶变换红外光谱
从图7和表1可知,不同植物多肽与金属离子螯合后,其傅里叶变换红外光谱发生改变,在3 300、1 550、1 100、600 cm-1附近的吸收峰与螯合前相比发生明显位移。在酰胺A带,桃仁、大豆、玉米和小麦多肽与亚铁离子螯合后的吸收峰有不同程度的位移,推测桃仁、大豆、玉米和小麦多肽与亚铁离子螯合后形成了N—Fe结构;其在酰胺I带和酰胺II带的特征峰也有不同程度的位移。桃仁、大豆和玉米多肽的—COO-吸收峰位于1 396.46 cm-1处,小麦多肽的吸收峰在1 398.39 cm-1处,螯合亚铁离子后吸收峰均发生明显的蓝移,移至1 419.61~1 427.32 cm-1范围内,可推测有—COO—Fe结构形成。桃仁多肽在1 122.57 cm-1处的C—O吸收峰在螯合亚铁离子后发生蓝移,其他3 种多肽螯合亚铁离子后发生明显红移,推测形成C—O—Fe结构,该变化与Zhou Ji等[31]的结果类似。
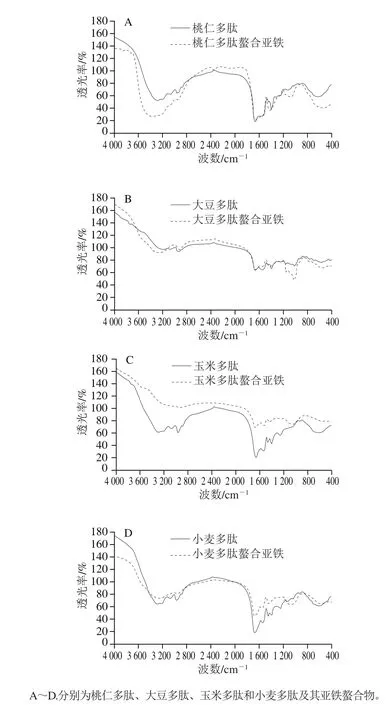
图 7 不同植物多肽及其亚铁螯合物傅里叶变换红外光谱Fig. 7 FTIR spectra of different plant peptides and their ferrous chelates
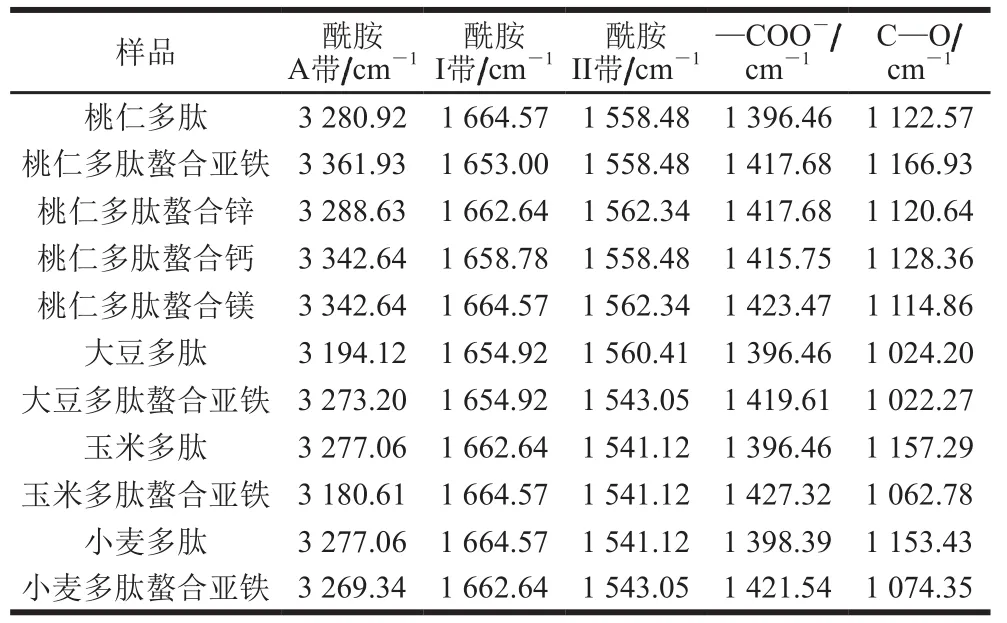
表 1 不同多肽及其不同金属螯合物傅里叶变换红外光谱特征峰Table 1 FTIR characteristic peaks of different samples
3 结 论
分子质量小的桃仁多肽与亚铁离子螯合率更高,其螯合物具有更大的抑菌圈直径,分子质量小于5 000 Da的桃仁多肽与亚铁离子和钙离子能螯合成具有较强抑菌活性的螯合物,而桃仁多肽螯合钙和桃仁多肽螯合镁均无抑菌活性;桃仁多肽、大豆多肽、玉米多肽和小麦多肽与亚铁离子所形成的螯合物间的抑菌活性有显著性差异(P<0.05),其中桃仁多肽螯合亚铁和小麦多肽螯合亚铁的抑菌活性最强,其对大肠杆菌的MIC均为5.0 mg/mL,对金黄色葡萄球菌的MIC分别为2.5、5.0 mg/mL;傅里叶变换红外光谱分析表明亚铁离子与4 种多肽分子的—COO-、N—H、C=O形成配位键,多肽与亚铁离子能有效地螯合形成多肽亚铁螯合物。
