ICP-OES法测定地质样品中稀土元素
2019-04-02杜宝华盛迪波
杜宝华,盛迪波,宋 平
(湖南省核工业中心实验室,长沙 410100)
地质样品中的稀土元素分析分为两类:1)稀土总量的测定(其中包括稀土元素分组含量的测定),通常采用阳离子交换树脂分离光度法、容量法、草酸盐分离重量法等;2)稀土分量的测定,通常采用现代仪器分析,主要有电感耦合等离子光谱法、等离子体质谱法、X-射线荧光光谱法等[1]。分光光度法、容量法、草酸盐分离重量法等属于经典的化学分析方法,缺点是分析手续较为繁琐,分析过程较长,分离不彻底等,并且各个环节条件不易掌握,对于微量、甚至痕量的稀土总量测定结果误差较大,从分析质量和时间上不能满足批量样品的分析;X-射线荧光光谱法特别是对混合稀土试样重稀土分量的测定,分析速度快,准确度较高,但是该方法灵敏度不高,并且存在较为严重的基体效应[2]。电感耦合等离子体质谱仪和电感耦合等离子体原子发射光谱仪目前已成为稀土分量测定的主要分析仪器,尤其是电感耦合等离子质谱法灵敏度高,干扰小,准确度高,特别是测定低含量的稀土元素具有较高的优越性,但是质谱仪价格较高,设备投入成本高,并且不适宜含量较高的样品分析。
电感耦合等离子体原子发射光谱法具有分析精度高、动态线性范围宽、分析精密度好、基体干扰小等优良特点,是测定地质样品中微量、常量稀土元素的主要分析仪器之一。目前,采用电感耦合等离子光谱法测定地质样品中的稀土元素已有报道,采用阳离子树脂交换分离后采用电感耦合等离子光谱法进行测定[3-4],但都需要过柱分离,比较麻烦,杜梅等[5]采用电感耦合等离子体发射光谱法测定包头稀土矿中稀土总量,用碱熔后只用水提取过滤,溶解沉淀后进行测定,样品中大量铁及部分钙等基体元素会对部分稀土元素造成背景叠加及光谱干扰。本文采用过氧化钠熔融分解样品,以热的三乙醇胺-EGTA混合水溶液提取,通过过滤分离,除去大量基体元素,用酸溶解沉淀ICP-OES测定,建立了地质样品中稀土分量与总量(分量之和)的测定方法;同时,以混合酸溶解样品后直接测定作为对照试验,发现检出限较低,分析速度较快,适宜大批量的样品分析,但仅用于易被混合酸溶解的地质样品;对于难以用酸分解完全的稀土铌钽酸盐类矿物,分析结果严重偏低。
1 实验部分
1.1 仪器及条件
iCAP 6300(美国热电公司)(电荷注入式检测器),iTEVA操作软件,仪器主要工作参数见表1。

表1 仪器主要工作参数Table 1 Main working parameters of ICP-OES
1.2 标准溶液及主要试剂
1 000 mg·L-115种稀土混合标准溶液;过氧化钠、三乙醇胺、EGTA、盐酸和盐酸羟胺(试剂均为分析纯);混合提取溶液:每100(5+95)mL三乙醇胺溶液中加入0.08 g EGTA固体。
1.3 实验方法
溶样方法Ⅰ[6]:称取样品0.250 0 g(精确至0.000 1 g)置于30 mL的聚四氟乙烯坩埚,用3滴去离子水润湿,加入 (HNO3∶HF∶HClO4=10∶7∶1)置于120℃控温电热板上,盖上坩埚盖,加热2 h后,取下坩埚盖,升温至200℃左右蒸至湿盐状;取下坩埚加入2 mL HNO3溶解盐类,再于200℃左右蒸至湿盐状,取下冷却至70~80℃。加入1+1的王水8 mL浸取盐类,缓慢加热溶解盐类、坩埚底有气泡产生并且溶液清亮后,冷却后转入25 mL容量瓶,定容、摇匀,测定方法同以下碱熔测定手续。
溶样方法Ⅱ(碱熔):称取样品于0.5 g(0.000 1 g)刚玉坩埚中,加入过氧化钠约4 g,搅拌均匀后,再覆盖一层过氧化钠,放入升温至650~700℃的马弗炉中熔融10~15 min,呈现暗红色透明流体,中间取出坩埚轻轻晃动一次,取出后稍冷,放入200 mL玻璃烧杯中,加入100 mL已加热至80~90℃的混合提取液,用小玻璃棒不断搅拌,以防局部温度过高溶液溅出而导致沉淀损失;待反应完全后,洗出坩埚。烧杯置于小电炉上,加热至沸后取下,稍冷后,趁热利用中速定性滤纸过滤,用5 g·L-1的氢氧化钠溶液冲洗烧杯及沉淀8~10次,再用去离子水冲洗一次烧杯与沉淀后用25 mL 2 mol·L-1热盐酸溶液(含有2%的盐酸羟胺)分次溶解相应烧杯内沉淀残留物和滤纸上沉淀,一并用50 mL容量瓶承接,定容,摇匀待测。
点燃等离子体,吸入去离子水稳定20~30 min后,调节光谱仪为最佳化,进行自动寻峰, 用空白溶液作为低点, ρRE=0.25、0.50、1.00和5.00μg·mL-1作为低系列混合标准溶液进行校准,测定低含量样品;利用ρRE=10.00、40.00、80.00和120.00μg·mL-1作为高系列混合标准溶液进行校准,测定高含量样品。
2 结果与讨论
2.1 分析谱线的选择及背景校正
仪器软件自带自动扣背景,由于稀土元素原子结构相似,离子半径相近,发射谱线波长相近等因素,需要人为进行左右背景校正取舍,背景位置扣除选在待测元素离峰平坦处;根据发射光谱法分析谱线的选取原则,选择光谱干扰少、灵敏度高的谱线作为元素的分析谱线;测定元素分析线波长及背景校正见表2。

表2 元素分析谱线与背景校正Table 2 Analytical spectral lines and background correction of elements
2.2 三乙醇胺用量的确定
样品采用过氧化钠熔融,提取后过滤可除去样品中大量的硅、铝、钛、磷等基体干扰离子,但是溶液中大量铁与稀土元素进行共沉淀,大量的铁会对部分稀土元素测定产生不同程度的背景叠加与光谱干扰,在碱性溶液中,三乙醇胺能同时络合铁、铝、锰和铜等多种金属离子形成稳定的配离子,加入量太少,分离不完全,加入太多,可能影响稀土元素的氢氧化物沉淀,通过试验表明:适量的三乙醇胺不会影响稀土元素的定量沉淀。三乙醇胺用量试验见表3。
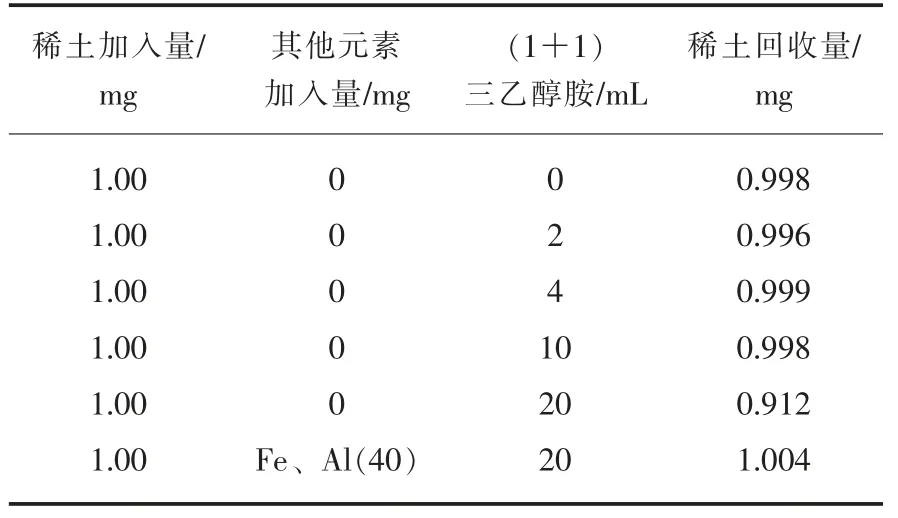
表3 三乙醇胺用量对稀土氢氧化物沉淀影响Table 3 Effect of triethanolamine dosage on precipitation of rare earth hydroxide
由表3可见,1+1的三乙醇胺加入量在小于等于10 mL时,对稀土回收量没有影响,因此选择100 mL(5+95)的三乙醇胺的量是适宜的。
2.3 EGTA用量的确定
EGTA、EDTA和OH-与稀土元素都具有较强的配位络合常数[7],见表4。

表4 络合常数比较表Table 4 Comparison of the complexation constants
当样品中含有较高的钙元素时,仍有少量的钙会同稀土共沉淀,钙对Lu、Gd、Tb和Sm等元素带来不同程度的谱线叠加和背景干扰。EDTA与EGTA在碱性溶液中对钙的络合常数比较相近(lg K Ca-EDTA=10.7,lg K Ca-EGTA=11.0);在碱性溶液中EGTA、EDTA及OH-对金属离子与稀土元素都有较强的配位络合作用,但从上表看出,OH-的络合作用最强,EGTA对稀土和镁离子的络合能力弱于EDTA的络合能力 (lg K Mg-EDTA=8.7,lg K Mg-EGTA=5.2),而样品中的镁在强碱性溶液中形成氢氧化镁,氢氧化镁胶体沉淀是微量、痕量稀土元素有效的共沉淀剂。综上所述,选用EGTA作为络合钙等基体元素比选用EDTA合理。
EGTA使用量需要试验确定,加入量太少,分离不完全,夹杂干扰元素太多,不利于测定;虽然稀土的氢氧化物络合常数大于EGTA对稀土元素的络合常数,并且介质中氢氧根离子大量过量,这有利于稀土沉淀物的形成;但EGTA加入太多,仍然有可能与稀土元素形成配离子,进入到溶液,影响稀土元素的定量沉淀,导致结果偏低。通过试验表明:适量的EGTA不会影响稀土元素的定量沉淀,EGTA用量试验见表5。
由表5可见,在100(5+95)mL的三乙醇胺溶液中加入0.08 g的EGTA对稀土回收量没有影响,因此,选择0.08 g EGTA的加入量。
2.4 精密度试验
采用国家一级标准标准物质(GBW07159)进行精密度试验(n=6),见表6。
2.5 准确度试验
采用两个国家一级标准标准物质进行准确度试验,见表7。
2.6 方法检出限
按照选定的测定条件,对全流程空白测定11次,以3倍标准偏差计算方法的检出限(LD),数据见表8。

表5 EGTA用量对稀土氢氧化物沉淀影响Table 5 Effect of EGTA dosage on the precipitation of rare earth hydroxide
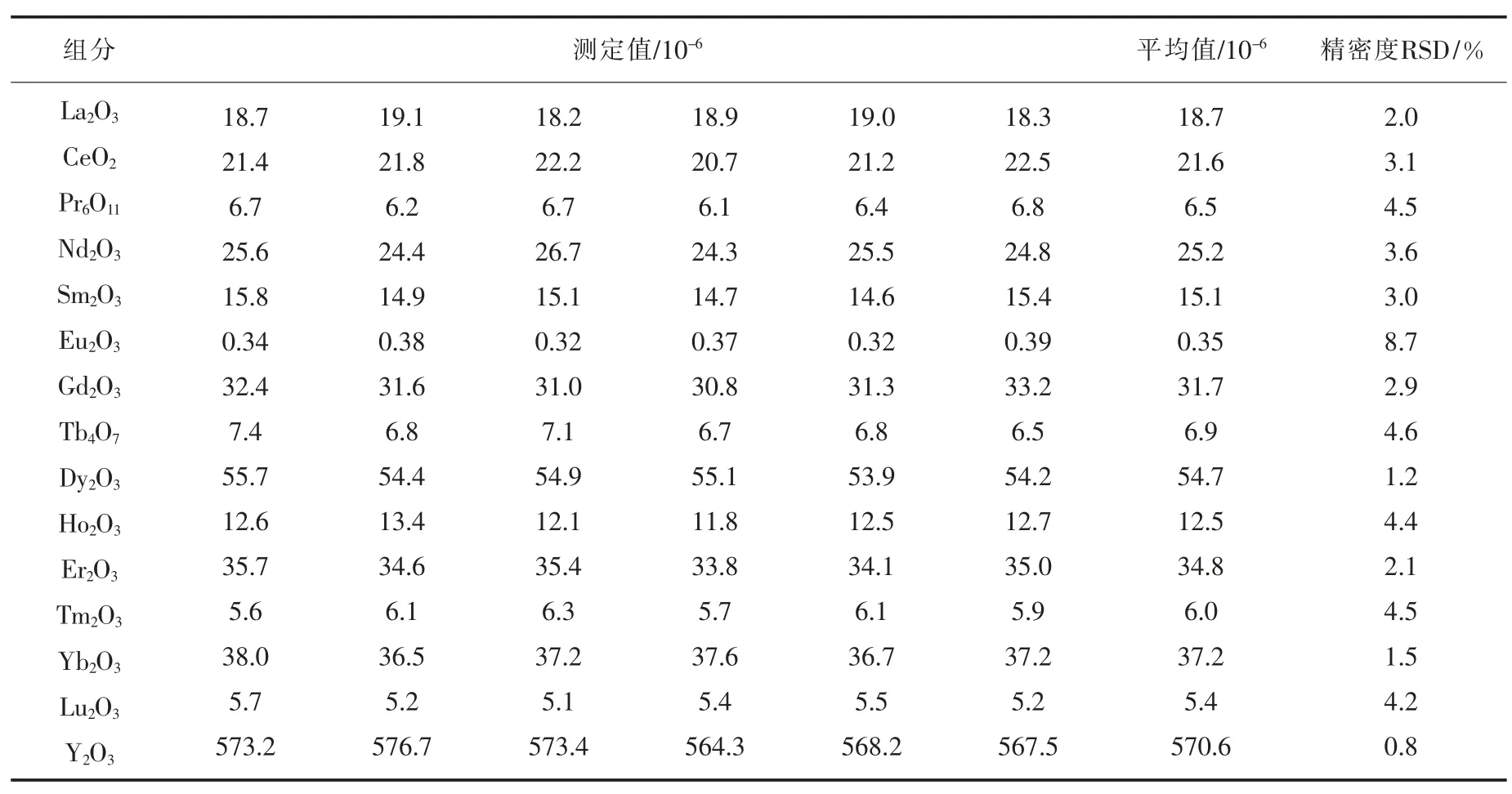
表6 精确度试验Table 6 Precision test of method

表7 准确度试验Table 7 Accuracy test of method
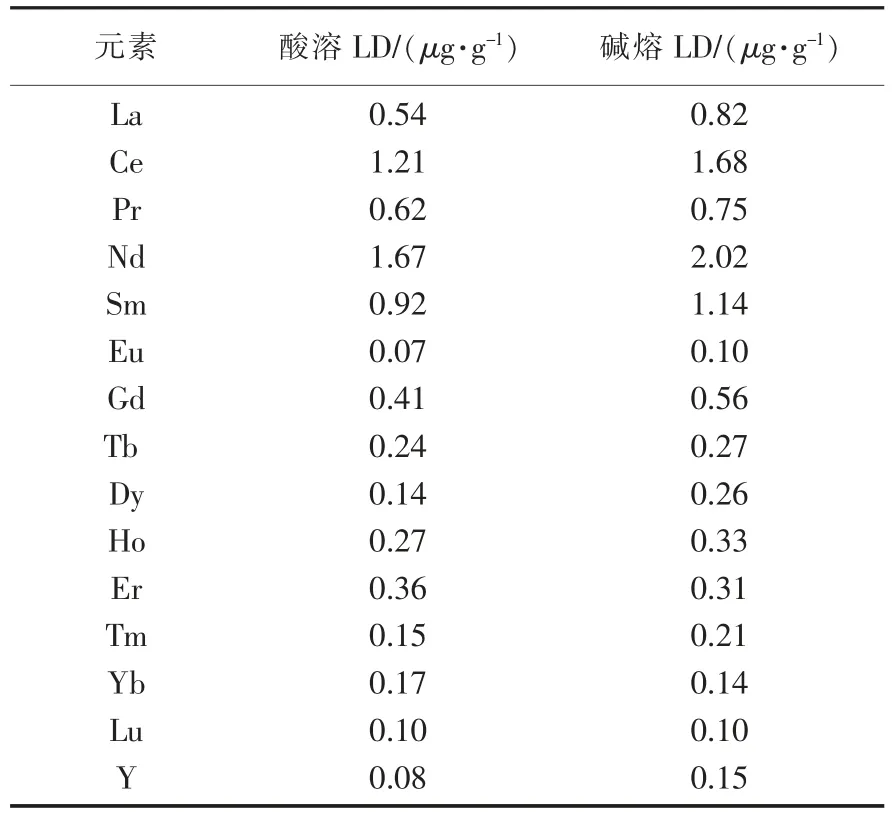
表8 方法检出限Table 8 Detection limits of the method for element
3 结论
通过碱熔处理样品ICP-OES测定地质样品中的稀土元素,操作较为简单、快速、精密度好,准确度高,此方法适合几乎所有含稀土矿物的样品分析,特别是对难溶的铌钽酸盐类矿物以及磷酸盐矿物、氟碳铈矿等测定结果效果良好;同时用混合酸溶作为对照试验的结果可知:对于易被酸溶解的矿物类型与碱熔、外检结果一致。该方法已对批量的地质样品进行分析测试,分析结果可靠,结果满意。
