不同细菌胞外产物对腐败希瓦氏菌低温下生长代谢的影响
2019-03-30叶晶鑫杨胜平丁靖宇钱韻芳
谢 晶 叶晶鑫 杨胜平 丁靖宇 钱韻芳
(1. 上海海洋大学食品学院,上海 201306;2. 上海水产品加工及贮藏工程技术研究中心,上海 201306)
水产品在流通过程中鲜度极易降低,随着流通时间的延长发生不可逆转的腐败变质,主要是因为酶自溶,化学氧化和微生物等多种因素的作用[1]。其中,微生物的生长活性是影响水产品腐败变质的主要原因。低温冷藏是延长水产品货架期最常用的方法,但仍有部分微生物在特定条件下能代谢产生腐败产物,迅速生长繁殖成为优势菌群,即特定腐败菌(specific spoilage organism,SSO)[2]。这些特定腐败菌会降解蛋白质产生生物胺、三甲胺等挥发性散发腐败臭味的物质,而且研究[3-5]发现冷藏条件下微生物的生长和对食品的致腐败能力与微生物之间的相互作用息息相关。微生物之间的相互作用主要是依靠细菌胞外产物即无菌上清液(cell-free supernatant,CFS)中的群体感应系统(quorum sensing,QS)的调控,微生物的群体感应系统中含有群体感应信号分子,这些信号分子可以调控自身和环境中其他微生物生物膜的生长、胞外蛋白酶的合成和活性以及产生腐败产物的能力等[6-9]。例如Zhu等[8]发现在25,4 ℃条件下,荧光假单胞菌(P.fluorescens)无菌上清液可以抑制波罗的海希瓦氏菌(S.baltica)的生长和致腐能力。水产品在冷藏条件下,常见的腐败菌属有希瓦氏菌、假单胞菌和气单胞菌等。本课题组[10]前期研究发现冷藏凡纳滨对虾中的特定腐败菌是腐败希瓦氏菌(S.putrefaciens)、P.fluorescens和气单胞菌属(Aeromonassp.),它们都是革兰氏阴性嗜冷菌。
本试验主要研究在4 ℃冷藏条件下,P.fluorescens、嗜水气单胞菌(Aeromonashydrophila,A.hydrophila)和温和气单胞菌(Aeromonassobria,A.sobria)的胞外产物提取液对S.putrefaciens的生长、生物膜的形成、胞外蛋白酶的合成以及致腐能力的影响,以便为开发新型凡纳滨对虾等水产品的保鲜技术提供研究基础。
1 材料和方法
1.1 材料与试剂
1.1.1 供试菌株
P.fluorescens、A.hydrophila、A.sobria、S.putrefaciens:本课题组前期筛选鉴定所得,菌种于灭菌甘油中-80 ℃ 保藏。
1.1.2 试剂
铁琼脂培养基、脑心浸肉汤(Brain Heart Infusion,BHI)、胰蛋白胨大豆肉汤培养基(TSB):青岛海博生物技术有限公司;
轻质氧化镁、硼酸、盐酸、柠檬酸钠、高氯酸、氢氧化钠、碳酸氢钠、丹酰氯、浓氨水、乙腈等:国药集团化学试剂有限公司。
1.2 仪器与设备
低速离心机:TDL-5-型,上海隆拓仪器设备有限公司;
灭菌锅:HVE-50型,日本Hi-rayama公司;
超净工作台:VS-1300L-U型,上海康福特环境科技有限公司;
恒温培养摇床:THZ-100型,上海圣科仪器设备有限公司;
低温培养箱:DHP-9162型,日本三洋电器集团有限公司;
凯氏定氮仪:Kjeltec2300型,丹麦Foss公司;
氨基酸分析仪:835型,日本日立公司;
高效液相色谱系统:Waters 2695型,Waters 2996 二极管阵列检测器及Empower 色谱管理软件,美国Waters公司。
1.3 菌株的活化和培养
P.fluorescens活化和培养参照Parlapani等[11]的方法略有修改:取1 mL冻存的P.fluorescens菌液于灭菌的9 mL 脑心浸肉汤中活化,30 ℃培养24 h左右使菌液浓度达1.0×108CFU/mL后,用于提取无菌上清液。A.hydrophila和A.sobria菌悬液的制备方法同P.fluorescens。
1.4 无菌上清液的提取
将P.fluorescens、A.hydrophila和A.sobria的菌液培养至菌浓度达到108~109CFU/mL后,取培养液在4 ℃、10 000×g离心15 min,取上清液,再用0.22 μm的醋酸纤维过滤膜过滤,得到的溶液即为无菌上清液(CFS)[12]。
1.5 接种与培养
1.5.1 空白对照组(CK组) 取100 μL的S.putrefaciens接种至100 mL的无菌BHI培养基中,置于4 ℃低温恒温箱中培养[13]。
1.5.2 试验组
(1) SP组:取100 μL的S.putrefaciens接种至100 mL 含有50 mL/100 mLP.fluorescensCFS的BHI培养基中,置于4 ℃恒温箱中培养[13]。
(2) SH组:取100 μL的S.putrefaciens接种至100 mL 含有50 mL/100 mLA.hydrophilaCFS的BHI培养基中,置于4 ℃恒温箱中培养[13]。
(3) SW组:取100 μL的S.putrefaciens接种至100 mL 含有50 mL/100 mLA.sobriaCFS的BHI培养基中,置于4 ℃恒温箱中培养[13]。
1.6 CFS对S. putrefaciens生长情况的影响
1.6.1 微生物指标的测定 参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》中的平板计数法测定,修改如下:先制成1∶10的样品稀释液,并梯度稀释到适当浓度,取2~3个适宜稀释度的样品菌液1 mL,与15~20 mL已灭菌的铁琼脂培养基混匀。待培养基凝固后置于30 ℃培养48~72 h,计黑色菌落总数,每个样品做3次重复。
1.6.2 胞外蛋白酶的测定 参照Zhu等[8]的方法,修改如下:将培养液在4 ℃、10 000×g离心5 min,采用BCA法测定上清液中胞外蛋白酶的浓度;将离心后的上清液与偶氮酪蛋白底物等体积混合于30 ℃反应30 min;再加入等体积的0.5 mol/L三氯乙酸室温下反应30 min;反应液在10 000 ×g离心5 min后,与1.0 mol/L的NaOH等体积混合在366 nm 处测吸光度。
U=(a-b)÷0.01,
(1)
式中:
U——蛋白酶活力,U/mL;
a——样品吸光度;
b——空白组吸光度。
1.6.3 生物膜的测定 将TSB中过夜培养(160 r/min,30 ℃)的S.putrefaciens用无菌的TSB稀释(1∶1 000),将稀释后的液体放入48孔板中,试验组分为3组,分别加入50 mL/100 mL 的P.fluorescens、A.hydrophila和A.sobriaCFS,置于4 ℃下培养,每隔24 h用结晶紫结合法进行测定。首先吸去平板孔中的培养物,并用无菌蛋白胨水(8.5 g/L NaCl,1 g/L蛋白胨)洗涤除去松散贴壁的细胞。干燥后,用0.1 g/L结晶紫对表面附着的生物膜染色15 min。用无菌蒸馏水洗涤孔板,然后加入95%乙醇重新溶解结晶紫染色的生物膜。使用酶标仪在600 nm处测吸光度[8]。
1.6.4 挥发性盐基氮(TVB-N)的测定 参照Dabad等[14]的方法,修改如下:取3.00 mL培养液,加入少量的蒸馏水,用凯氏定氮仪测定培养液中挥发性盐基氮。每组样品做2个平行。
1.6.5 总氨基酸的测定 按GB 5009.124—2016《食品安全标准 食品中氨基酸的测定》执行。
1.6.6 腐胺的测定S.putrefaciens培养液中腐胺的提取参照Ikonic等[15]的方法,然后参照Fan等[16]的方法使用HPLC进行鉴定和定量分析腐胺,每组样品做3次平行。
1.7 数据处理
利用Origin 8.6绘制曲线;采用SPSS 19进行显著性分析。数据结果均采用平均值±标准差表示。
2 结果与分析
2.1 菌落总数变化
图1为4 ℃条件下,分别添加50 mL/100 mLP.fluorescens、A.hydrophila和A.sobria无菌培养液对S.putrefaciens生长的影响。初始接菌量大约在5.20 lg(CFU/mL)。从图1中可以看出,4 ℃贮藏4 d之前,添加50 mL/100 mLP.fluorescens、A.hydrophila和A.sobria无菌培养液对S.putrefaciens的生长几乎没有影响;但是贮藏8 d后达到菌落生长稳定期时,添加50 mL/100 mLA.sobria无菌培养液组的S.putrefaciens菌落总数明显低于空白组,而添加50 mL/100 mLP.fluorescens或A.hydrophila无菌培养液的S.putrefaciens菌落总数与空白组没有显著性差异;贮藏10 d后各组中S.putrefaciens菌落数基本一致;到达贮藏终点时,添加了50 mL/100 mLA.sobria无菌培养液组中S.putrefaciens的菌落数明显呈下降趋势。研究结果表明添加50 mL/100 mL 的P.fluorescens或A.hydrophila无菌上清液对S.putrefaciens的生长几乎没有影响,而且添加50 mL/100mLA.sobria无菌培养液对S.putrefaciens的生长延滞期和对数期几乎没有影响,但是从稳定期初期开始就会抑制S.putrefaciens的生长,与Zhu等[13]研究的P.fluorescens只在稳定期抑制S.baltica生长和Wang等[17]研究发现的铜绿假单胞菌(Pseudomonasaeruginosa)的无菌上清液在稳定期提高了肠沙门氏菌(Salmonellaenterica)死亡率的结果一致。S.putrefaciens是具有群体感应机制的细菌,它可以通过感知环境中的信号分子来调控菌体密度,并在信号分子达到阈值时启动相关基因表达,从而调控细菌的生理行为,以适应环境的变化,可能是S.putrefaciens可以感知A.sobria无菌上清液中的群体感应信号分子去调控自身的微环境、物质代谢和必要的细胞分裂[12]。

图1 BHI培养液中添加无菌上清液对S.putrefaciens在4 ℃ 贮藏中菌落总数变化的影响
Figure 1 Effect of CFS on the growth ofS.putrefacienscultured in BHI broth at 4 ℃
2.2 胞外蛋白酶变化
细菌可以通过无菌上清液中的群体感应信号分子去调控菌体之间的群体行为,特别是对胞外产物的分泌,例如毒力因子、胞外蛋白酶和生物膜基质[18-19]。图2为在4 ℃贮藏下,分别添加50 mL/100 mLP.fluorescens、A.hydrophila和A.sobria无菌上清液对S.putrefaciens形成胞外蛋白酶活性和浓度的影响。从图2可以看出,不同的贮藏时间段,各试验组的胞外蛋白酶活性和浓度变化趋势并不完全相同,是因为S.putrefaciens的胞外蛋白酶活性与浓度之间没有密切的关系,但总体趋势可以看出贮藏8 d 后各组的胞外蛋白酶活性和浓度显著提高,但贮藏12 d后,胞外蛋白酶活性和浓度明显降低。与对照组相比,贮藏8 d 后的P.fluorescens、A.hydrophila和A.sobria的无菌上清液明显降低了S.putrefaciens胞外蛋白酶的形成,而且SP组、SH组和SW组中S.putrefaciens胞外蛋白酶活性分别为8.8,9.8,8.1 U/mL,比对照组活性分别低21.42%,12.50%,27.68%,说明A.sobria的无菌上清液对S.putrefaciens胞外蛋白酶形成的抑制作用最强,从图2(b)中可以看出,贮藏8 d后,与空白组相比,添加3种无菌上清液对胞外蛋白酶的浓度都有抑制作用,而且添加A.sobria的无菌上清液组(SW组)抑制作用最强,贮藏12 d后,添加A.hydrophila无菌上清液组(SH组)对胞外蛋白酶的浓度几乎没有抑制作用,添加P.fluorescens和A.sobria的无菌上清液组对胞外蛋白酶的浓度都有抑制作用,而且SW组的抑制作用最强。这与Zhu等[8]研究添加不同的外源AHLs会抑制S.baltica胞外蛋白酶活力以及Liu等[20]研究发现P.fluorescens的蛋白酶基因活性受到以AHLs为基础的群体感应系统调控的结果一致。
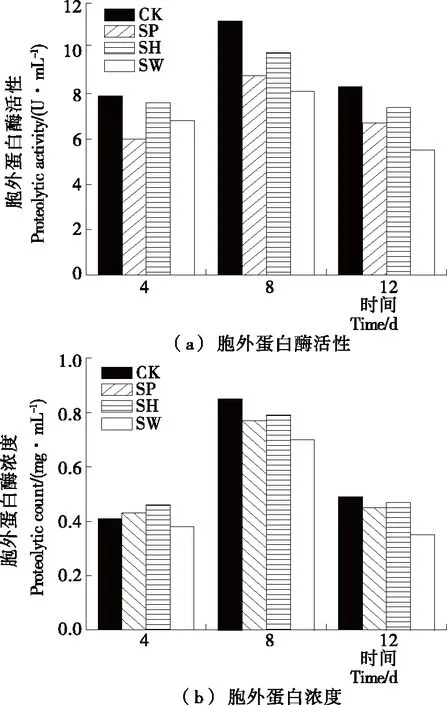
图2 BHI培养液中添加无菌上清液对S.putrefaciens在4 ℃ 贮藏中胞外蛋白酶活性和浓度的影响
Figure 2 Effect of CFS on extracellular proteolytic acti-vity and protein content ofS.putrefacienscultured in BHI broth at 4 ℃
2.3 生物膜变化
S.putrefaciens具有形成生物膜的能力,并能依靠生物膜附着在容器表面,增加清洁难度并易导致交叉污染。外界营养条件不会影响其在食品加工中形成生物膜的能力,但是外源菌会影响S.putrefaciens形成生物膜的能力和黏附力[21]。图3为在4 ℃贮藏下,分别添加50 mL/100 mLP.fluorescens、A.hydrophila和A.sobria无菌上清液对S.putrefaciens生物膜形成的影响。贮藏8 d后S.putrefaciens形成生物膜的能力增强,但随着贮藏时间的延长到达12 d后,S.putrefaciens形成生物膜的能力显著降低(P<0.05)。与对照组相比,P.fluorescens和A.hydrophila都提高了S.putrefaciens形成生物膜的能力,分别比对照组提高23.33%和56.66%,而A.sobria无菌上清液抑制了S.putrefaciens形成生物膜的能力,抑制率约为18.88%。Wang等[17]研究发现P.aeruginosa的无菌上清液也会抑制S.enterica形成生物膜的能力;Chorianopoulos等[22]发现哈夫尼亚菌(Hafniaalvei)的无菌上清液也能降低S.enterica形成生物膜的能力;Zhang等[23]研究发现通过添加外源群体感应信号分子AHL会抑制P.aeruginosa形成生物膜的能力,而且许多AHL调控的基因会在细菌生长的对数期后期和稳定期前期表达[24],所以出现上述现象是因为在S.putrefaciens中控制形成生物膜的基因受到了外源无菌上清液中群体感应信号分子的调控,例如控制胞外物质形成和膜流动性的基因。
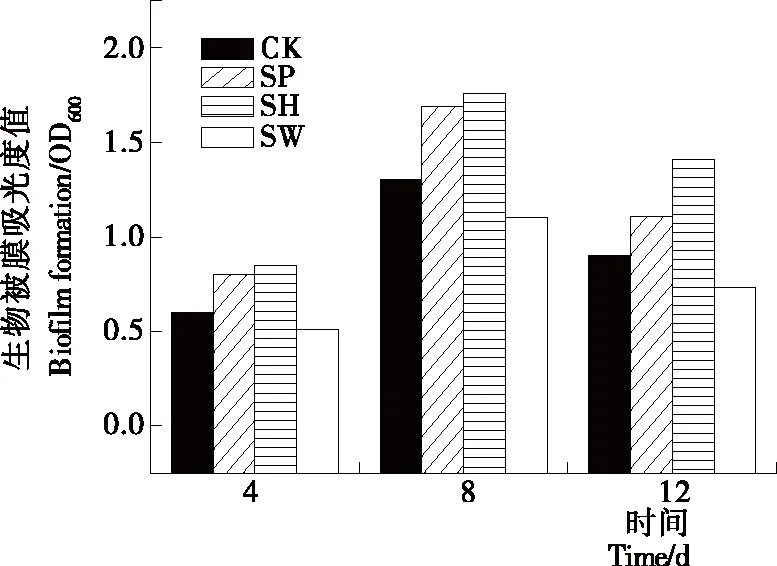
图3 BHI培养液中添加无菌上清液对S.putrefaciens在4 ℃ 贮藏中生物膜形成的影响
Figure 3 Effect of CFS on biofilm development ofS.putrefacienscultured in BHI broth at 4 ℃
2.4 TVB-N值变化
图4为在4 ℃贮藏下,分别添加50 mL/100 mLP.fluorescens、A.hydrophila和A.sobria无菌上清液对S.putrefaciens形成TVB-N能力的影响。从图4中可以看出,第0~6天各组的TVB-N值显著上升,当贮藏6 d之后,各个试验组TVB-N值上升缓慢,与菌落总数研究结果一致,说明当贮藏到细菌生长的稳定期初期时,S.putrefaciens产TVB-N的能力受到各组外源细菌无菌上清液的影响而下降。与对照组相比,P.fluorescens和A.hydrophila的无菌上清液对S.putrefaciens形成TVB-N 能力没有显著性的影响,A.sobria无菌上清液显著降低了S.putrefaciens产TVB-N的能力,说明A.sobria无菌上清液降低了S.putrefaciens产生代谢产物的能力。很多腐败菌的腐败过程都会受到无菌上清液中群体感应信号分子的调控,例如蛋白酶、脂肪酶、纤维素和果胶酶的分泌[25]。Zhang等[23]研究发现含有AHLs的培养液会降低P.aeruginosa的脂肪酶活性,提高蛋白酶活性,从而影响P.aeruginosa产生腐败产物的量。所以A.sobria无菌上清液显著降低了S.putrefaciens产TVB-N的能力可能是A.sobria无菌上清液中的AHLs化合物抑制了与S.putrefaciens产TVB-N相关的蛋白酶的分泌。
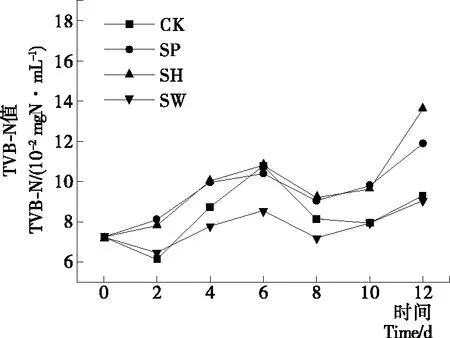
图4 BHI培养液中添加无菌上清液对S.putrefaciens在4 ℃ 贮藏中TVB-N形成的影响
Figure 4 Effect of CFS on total volatile basic nitrogen contents ofS.putrefacienscultured in BHI broth at 4 ℃
2.5 总氨基酸变化
表1列出了在4 ℃贮藏下,分别添加50 mL/100 mL的P.fluorescens、A.hydrophila和A.sobria无菌上清液对S.putrefaciens氨基酸的影响。有机体蛋白质组织的基本成分是氨基酸,其在生物体的生命活动中发挥着非常重要的作用[26]。结果表明,SP组、SH组和SW组中Lys含量由初始值的342.88,290.14,344.71 μg/mL分别降低到243.47,260.09,285.43 μg/mL,降低率分别为28.99%,10.36%,17.20%,Glu由初始值的777.70,650.47,786.67 μg/mL分别降低到528.53,567.44,626.02 μg/mL,降低率分别为32.04%,12.76%,20.42%。氨基酸为腐败菌的生长提供碳源和氮源,同时也是腐败产物生物胺的前提物质。对比SP组、SH组和SW组贮藏终点时氨基酸含量变化发现,SH组和SW组中氨基酸总量、Glu、Gly、Ala、Lys和Leu的降低率都低于CK组和SP组。从表1中还可以看出,与0 d相比,贮藏12 d后CK组、SP组、SH组和SW组中总氨基酸的含量分别降低了17.76%,28.41%,13.55%,14.84%。贮藏12 d后,与对照组相比,A.hydrophila和A.sobria的无菌上清液均能抑制S.putrefaciens对氨基酸的降解能力,而P.fluorescens无菌上清液则起促进作用。
2.6 腐胺变化
S.putrefaciens可以使高蛋白的水产品中鸟氨酸、赖氨酸和组氨酸发生脱羧作用生成腐胺、尸胺和少量组胺[13,27],随着贮藏时间的延长,微生物产生的腐胺含量增加,产生有害物质导致水产品腐败。在低温贮藏下,腐胺是S.putrefaciens代谢产生的最主要的生物胺[28]。图5是在4 ℃贮藏下,分别添加50 mL/100 mLP.fluorescens、A.hydrophila和A.sobria无菌上清液对S.putrefaciens产生腐胺能力的影响。从图5可以看出,随着贮藏时间的延长,腐胺含量在逐渐上升,贮藏4 d后各组无菌上清液对S.putrefaciens产生腐胺的抑制率较低。但与对照组相比,贮藏8 d后,P.fluorescens和A.sobria无菌上清液对S.putrefaciens产生腐胺的抑制率分别为7.54%,33.96%,贮藏12 d后,P.fluorescens和A.sobria无菌上清液对S.putrefaciens产生腐胺的抑制率分别为2.66%,29.33%。表明当S.putrefaciens生长至稳定期后,A.sobria无菌上清液对腐胺产生的抑制率最高,可能是A.sobria无菌上清液可以抑制S.putrefaciens代谢产生脱羧酶,抑制其生成腐胺。

表1 BHI培养液中添加无菌上清液对S. putrefaciens在4 ℃贮藏中氨基酸的影响†Table 1 Effect of CFS on total amino acid contents of S. putrefaciens cultured in BHI broth at 4 ℃ (n=3) μg/mL
† Cys、Pro、Asn、Gln和Trp在样品处理时被破坏。
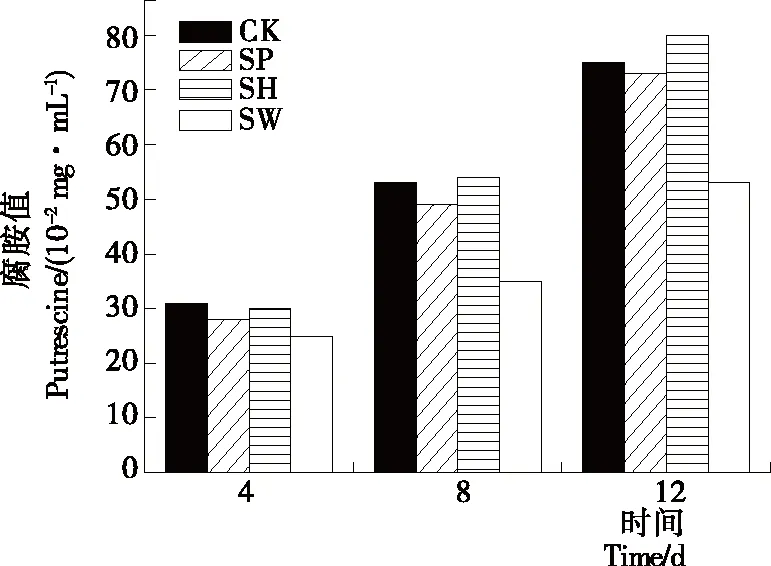
图5 BHI培养液中添加无菌上清液对S.putrefaciens在4 ℃ 贮藏中腐胺形成的影响
Figure 5 Effect of CFS on putrescine content ofS.putrefacienscultured in BHI broth at 4 ℃
3 结论
本试验主要研究了P.fluorescens、A.hydrophila和A.sobria的胞外产物在4 ℃下对S.putrefaciens的生长和致腐败能力的影响。通过菌落总数、胞外蛋白酶和生物膜的分析发现只有A.sobria的无菌上清液对S.putrefaciens的生长有抑制作用。通过分析S.putrefaciens的腐败产物,发现P.fluorescens、A.hydrophila的无菌上清液对S.putrefaciens的抑制作用较小,A.sobria能显著抑制S.putrefaciens的致腐败能力,说明A.sobria的胞外产物中含有抑制S.putrefaciens生长的群体感应信号分子,但是具体起作用的化合物是哪些仍需要进一步研究确认。
