HPTLC-DPPH法定性定量分析保健品中芦丁
2019-03-30王天楠陈益胜徐学明黄彩虹
王天楠 张 煌 陈益胜,2 徐学明,2 黄彩虹
(1. 江南大学食品学院食品科学国家重点实验室,江苏 无锡 214122;2. 江南大学食品学院,江苏 无锡 214122;3. 河南牧业经济学院食品与生物工程学院,河南 郑州 450045)
芦丁(Rutin)又称维生素P、芸香甙等,广泛存在于天然提取物中。芦丁(图1)的化学本质是黄酮醇槲皮素与二糖芸香二糖[α-L-鼠李吡喃糖基-(1→6)-β-D-葡萄吡喃糖]之间形成的糖苷化合物。其黄酮部分的酚羟基可以提供电子与活性氧发生氧化还原反应,在清除自由基方面具有较强的活性。因此芦丁是一种强效的天然抗氧化剂,可以替代食品中人工合成抗氧化剂,且无毒副作用,因此在食品添加剂工业中具有良好的应用前景[1]。此外,针对芦丁疏水性差的特点,Viskupicova等[2]使用4~8个碳链长度的脂肪酸对芦丁母体分子进行酰基化,增强其油溶性,成功地将芦丁的抗氧化活性应用到油脂保藏领域。
除了抗氧化,大量研究表明,芦丁还具有很多独特的保健功效。例如,Cosco等[3]证明使用壳聚糖包埋的芦丁表现出良好的抗炎能力;Ghorbani[4]系统地研究了芦丁对血糖的控制能力和作用机理。此外,芦丁有降低毛细血管通透性和脆性的作用,保持及恢复毛细血管的正常弹性,可以用于防治高血压脑溢血[5]。特别地,芦丁所具有的潜在抗肿瘤功能也吸引了众多的关注。Alonso-Castro等[6]研究证明芦丁是决定天然萃取物抗癌作用最主要的功效因子之一。目前,芦丁已经成为很多保健食品的主要功效成分之一。
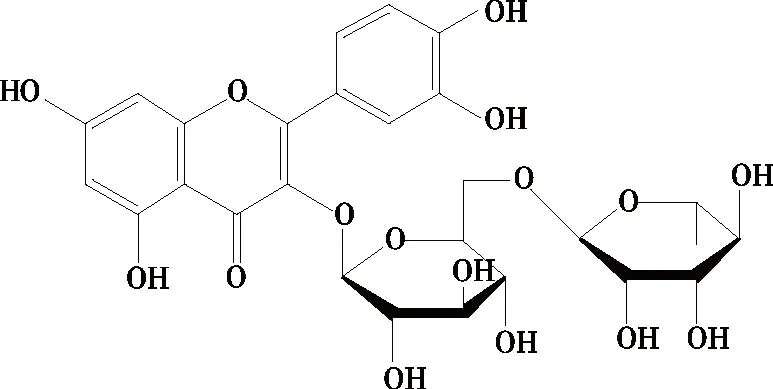
图1 芦丁的分子结构Figure 1 The molecular structure of rutin
目前,保健品中芦丁的测定主要采用基于分光光度计的比色法[7]。这是基于芦丁分子在320~400 nm的紫外区具有较强的特征吸收。比色法操作简单,对样品清理几乎没有要求。但是考虑到天然产物含有丰富的黄酮类物质,这些物质在这一波段的紫外吸收会对检测结果产生严重的干扰,因此比色法的可靠性难以保证。基于高效液相色谱的分析方法被誉为混合物分析的“金方法”,用其作为天然产物中芦丁的分析方法具有特异性好,灵敏度高的优点[8-9]。但是必须注意的是高效液相色谱也表现出通量低和基质耐受性差等固有的缺点。单次分析只能针对一个样品,而且对样品的清理要求较高,否则很容易出现色谱柱堵塞。难以满足高效快速分析的原则。
平面色谱是最早发明的色谱技术之一,并且至今仍是现代实验室不可或缺的分析手段。然而,传统手工方式操作的平面色谱技术无论在分离能力还是检测手段方面都已经远远落后于柱色谱技术。不过,高效薄层色谱(High performance thin layer chromatography,HPTLC)技术的出现和进步改变了这些劣势,并且代表了平面色谱技术发展的新方向。除了继承传统手动平面色谱技术的固有优点(分析过程简便且高通量,分析结果图像化),HPTLC在仪器化和自动化等方面有了长足的进步,在分析能力和检测精度方面已经达到或者超过了传统的液相色谱。除此之外,HPTLC作为一个开放的色谱系统,在生物传感联用检测应用领域有着无与伦比的优势。当色谱过程结束后,HPTLC的分离结果以离散斑点的形式固定在色谱板上,而不是像柱色谱那样流入废液瓶中。经过短暂的烘干,色谱板上残留的有毒有机溶剂被挥发,使得分离结果可以通过喷洒或者浸渍的方式非常方便地与各种生物试剂、酶或者细胞生物传感检测相结合[10]。换而言之,在HPTLC分析中,色谱板不仅扮演了色谱固定相的角色,更重要的是为生物传感的过程提供了一个理想的平台。
Agatonovic-Kustrin等[11]的研究建立了一种HPTLC-DPPH联用定量评估葡萄酒中主要多酚类物质清除自由基的方法,同时创新建立了两步梯度洗脱法,使得在无需对样品进行纯化处理的情况下,在同一块板上分析多种样品成为可能;Perwez等[12]的研究利用了DPPH还原反应和RP-HPTLC法,评估了沙特阿拉伯生长的4种金合欢树种的乙醇提取物的抗氧化潜力,包括RP-HPTLC量化抗氧化生物标志物芦丁,通过光密度扫描得到的峰面积值评估金合欢树种样品的抗氧化能力。本研究拟吸取前人经验,将1,1-二苯基-2-三硝基苯肼(DPPH)还原变色的反应与高效薄层色谱分离相结合,以硅胶薄层板为载体,建立HPTLC-DPPH联用测定保健品中芦丁的方法,考察DPPH显色反应时间、流动相配比、光密度扫描参数对色谱分离、扫描效果的影响,建立薄层板上芦丁与DPPH变色反应的浓度—信号关系标准曲线以期实现保健品(槐米)中芦丁的快速、高效、可靠定量分析。
1 材料与方法
1.1 试剂与材料
芦丁:分析纯,美国Aladdin公司;
硅胶高效薄层板:分析型,规格10 cm× 20 cm,德国Merck公司;
3种保健品样品(槐米提取物粉末):市售;
电子天平:MB104E型,瑞士Mettler-Toledo公司;
半自动薄层点样仪:Linomat 5型,瑞士CAMAG公司;
全自动薄层展开仪:ADC-2型,瑞士CAMAG公司;
光密度扫描仪:Scanner 3型,瑞士CAMAG公司;
薄层成像仪:DD70型,德国Biostep公司;
质谱仪:Synapt Q-TOF MS型,美国Waters公司。
1.2 方法
1.2.1 标准溶液制备 精确称取(10.0±0.1) mg芦丁标准品,溶于10 mL甲醇中。制得1 mg/mL标准储备液,置于棕色容量瓶中,在4 ℃冰箱中恒温避光保藏,保质期1周。准确吸取芦丁标准储备液0.5 mL,与9.5 mL甲醇混合稀释,使该标准工作溶液浓度为0.05 mg/mL。芦丁标准工作液测试当天新鲜配置。
1.2.2 样品制备 精确称取保健品(槐米提取物粉末)样品50.0 mg,分别与10 mL甲醇混合。将混合物在涡旋混匀器上震荡1 min,然后置于超声水浴30 min。于3 000 r/min 离心10 min,取2 mL上清液,用注射器过0.45 μm 纤维素滤膜去除其中的固体微粒。过滤后,用0.05 mg/mL 芦丁标准工作液作为参比,用双波长紫外—可见光分光光度计测定滤液在360 nm波长的吸光度,以此为指导,用甲醇对滤液进行逐步稀释,使其吸光度在0.8~1.0。稀释后的滤液直接用于薄层点样分析,分别记为保健品1、保健品2、保健品3。
1.2.3 HPTLC色谱条件 为了获得定量且可控的点样结果,样品溶液和标准溶液都通过半自动薄层点样仪在0.5 MPa 氮气载气的协助下以条带状吹扫到薄层板上。具体参数为:条带宽度6 mm,距离薄层板底边8 mm,进样速度100 μL/s,预排体积0.2 μL。第1个条带中心距离薄层板左边缘15 mm,所有条带间距通过软件自动计算得出。点样结束后,将原点区域用50 ℃干燥1 min以除去溶剂残留。点有样品的薄层板在全自动薄层展开仪中进行色谱分离。流动相配比乙酸乙酯/甲酸/乙酸/水(10/1.1/1.1/2,体积比),展开距离为60 mm。色谱分离条件:相对湿度控制3 min(饱和氯化镁溶液鼓泡调节相对水活度至35%左右),薄层板预平衡10 min,整个展开过程耗时约30 min。待流动相前沿到达预定高度,展开过程自动停止。此后,将薄层板取出,放在薄层加热器上60 ℃烘烤3 min,使得残留在硅胶薄层上的流动相溶剂挥发。
1.2.4 原位衍生反应和成像 将完成色谱分离后的薄层板通过自动浸渍装置浸入DPPH衍生液中,移动速度1 mm/s,停留时间1 s。然后将蘸有DPPH衍生液的薄层板置于避光处反应20 min。当薄层板的红棕色背景出现明显的浅黄色抗氧化斑点后,用薄层成像仪对衍生结果进行拍照成像,相机参数设定为:底部透射光源,自动对焦和校正。
1.2.5 光密度扫描定量 拍照成像后,薄层板上的衍生反应结果通过光密度扫描定量分析。具体参数为:反射—荧光模式,D2&W灯,激发光波长530 nm,无滤光片,狭缝尺寸3.00 mm×0.30 mm (Micro),扫描速度100 mm/s,数据分辨率100 μm/step。检测到的色谱信号通过Wincat软件进行峰定义、基线校正和峰面积积分计算。
1.2.6 质谱定性 参照DPPH显色反应的结果,在一块没有衍生的薄层板上确定目标物的停留位置,用铅笔做好记号。用剪刀在记号处剪下一个3 mm× 8 mm矩形薄层小片,剪切过程中要特别注意不要造成硅胶层的崩离。剪下的小片放置到盛有0.5 mL甲醇的离心管中震荡萃取1 min。萃取液经过0.45 μm尼龙滤膜过滤后使用Waters Synapt Q-TOF系统进行分析(不接色谱柱,样品直接进入离子源)。质谱检测条件:电喷雾离子源(electrospray ionization,ESI),阴离子检测模式,毛细管电压3.0 kV,锥孔电压30 V,离子源温度100 ℃,脱溶剂气体温度400 ℃。锥孔和脱溶剂气体的气流速度分别为50,500 L/h。质核比扫描范围m/z50~800,碰撞能量6 eV。
2 结果与讨论
2.1 DPPH反应条件优化
芦丁与DPPH作用显色是一个随时间变化的过程。因此,为了确定薄层板上DPPH显色反应的最佳反应时间,对浸渍衍生后的薄层板上目标物斑点的信号强度进行了监测(每张照片时间间隔为5 min)。如图2所示,在浸渍后的前15 min内,芦丁形成的抗氧化斑点信号强度均快速上升并达到最高值,此后呈缓慢下降趋势。因此可以确定薄层板上DPPH显色反应的最佳反应时间为15 min。
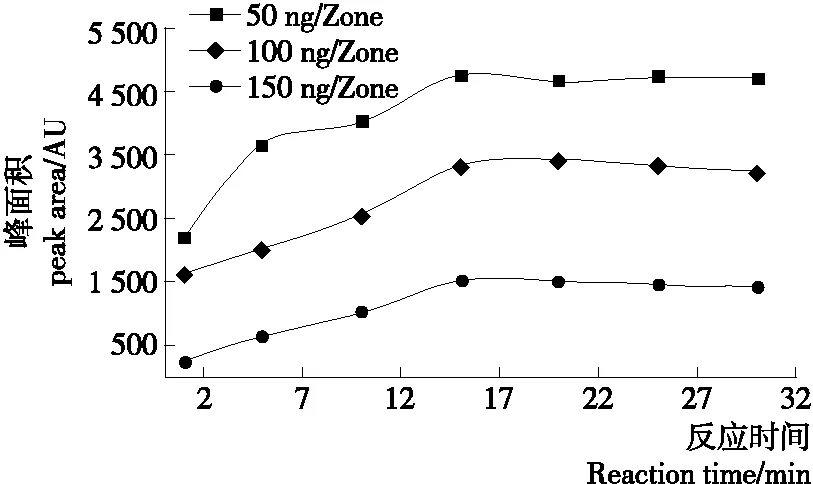
图2 薄层板上芦丁抗氧化斑点信号强度随时间变化规律Figure 2 Intensity variation of rutin bands after immersion
2.2 色谱分离优化
在HPTLC分析中,对硅胶板进行目测检视是最有效的、最直观的评估方法。目测检视可以明确显示色谱分离效果以及目标检测物质的大致浓度范围。相较于目测检视,仪器化的光密度扫描图能够获得更加精确的色谱定量结果。由于保健品样品成分复杂,除芦丁外,还含有槲皮素等其他能与DPPH反应变色的组分。为提高结果准确度与重现性,同一种芦丁标准品在同一硅胶板上进行3次平行试验(同一种标准品进行3次平行点样)。3种保健品在同一硅胶板上分别进行1次点样。DPPH经浸渍后均匀分布于整块板上,含有芦丁的区域(图3中上方的3个变色区域)和含有槲皮素的区域(图3中下方的6个变色区域)由深紫色变为浅黄色,而其他区域保持淡紫色不变。在此基础上,使用不同流动相进行色谱条件优化。本研究采用CAMAG ADC-2进行色谱展开,全自动化的预饱和硅胶板平衡有效避免了“边际效应”问题。由图3、4可知,在乙酸乙酯/甲酸/乙酸/水体积比为10/1.1/1.1/2时,芦丁的比移值Rf为0.45,槲皮素的比移值Rf为0.65,同一轨道上的目标物质与干扰杂质能够实现良好的分离。因此,乙酸乙酯/甲酸/乙酸/水体积比为10/1.1/1.1/2是最佳流动相。同时,由图5可知,目标物质与杂质展开距离的显著差异能使芦丁在光密度扫描中具有良好的分辨率。

1~3. 芦丁标准品100 ng/Zone(即轨道上每个斑点含有100 ng芦丁标准品) 4~6. 槐米样品1~3
图3 白光可视透射模式下的色谱结果图
Figure 3 Chromatographic results visualized under white light in transmission mode
2.3 光密度扫描参数优化
由图4可知,硅胶板上芦丁的最大吸收在530 nm。最初光密度扫描是采用吸收模式,扫描结果为反向吸收峰,数据无法分析,之后改用无滤光片的荧光模式重新扫描。在这一条件下,由于激发光被背景中没有消耗反应的DPPH分子吸收,形成低强度基线信号,而含有芦丁的目标物区域大部分DPPH被反应还原,能够反射大部分入射光,不使用滤光片就能避免反射光被截住而得不到检测信号。除了扫描模式,光源也是影响光密度扫描结果的重要因素。一般情况下,荧光模式下会选用扫描结果具有高信噪比的汞灯作为光源。但是本研究中使用汞灯无法得到色谱峰信号,所以改用D2&W灯作为激发光源,以得到具有良好信噪比的色谱峰信号。狭缝尺寸、扫描速度和数据分辨率非关键参数,依照常规经验进行设置。因此,最终确定的光密度扫描定量分析的具体参数为:反射—荧光模式,D2&W灯,激发光波长530 nm,无滤光片,狭缝尺寸3.00 mm× 0.30 mm (Micro),扫描速度100 mm/s,数据分辨率100 μm/step。

波长分别为510,520,530,540,550 nm图4 图3中轨道5在不同波长下的光密度扫描图
Figure 4 Corresponding densitogram of track 5 in figure 3 at 510, 520, 530, 540, 550 nm wavelength

1~3. 芦丁标准品100 ng/Zone(即轨道上每个斑点含有100 ng芦丁标准品) 4~6. 槐米样品1~3 a. 芦丁的信号 b. 槲皮素的信号
图5 波长530 nm下图3中轨道1~6的光密度扫描图
Figure 5 Corresponding densitogram of track 1~6 in Figure 3 at 530 nm wavelength
2.4 定量方法验证
2.4.1 方法检测限和线性 根据《食品检验工作规范》要求,需要建立具有良好线性的检测方法;而在实际应用中,LOD/LOQ和其选择性则至关重要。基于经典五点法,在50~500 ng/Zone 的范围内对芦丁进行线性曲线的测定。如图6所示,对衍生结果的光密度扫描检测给出了良好的线性结果,R2=0.997 4。随后通过公式LOD=3×SD/b和LOQ=10×SD/b计算得到方法检测的检测限和定量限,其中SD代表检测信号的标准差(standard derivation),b代表标准曲线的斜率。计算结果为LOD=12 ng/Zone,LOQ=39 ng/Zone。

图6 薄层板上芦丁与DPPH变色反应的浓度—信号关系曲线
Figure 6 Concentration-signal relationship curve of rutin and DPPH color change reaction on the silica gel plate
2.4.2 方法精密度和准确性 通过测定目标物芦丁的添加回收率(分别进行了3个添加水平试验,50,100,150 mg/g,每个添加水平重复3次)对本法的精确度和准确度进行验证。如表1所示,3种保健品样品中的添加回收率为82%~97%,精密度RSD<10%,表明方法具有良好的准确度和精密度。
2.5 原位质谱指纹图谱鉴定
准确定量及定性是检测方法的基本要求。尽管光密度扫描能够提供定量数据,但是目测检视和光密度扫描都无法从分子水平区分目标斑点间的差别。利用MS图谱的这一特质,可以从分子水平证明本方法利用HPTLC分离得到的目标条带确实含有芦丁,而不是产生了假阳性,证明了本方法的可靠性。利用原位质谱指纹图谱对展开后硅胶板的条带进行质谱分析,记录洗脱分子离子及其碎片荷质比(m/z)特征,由于从硅胶板上洗脱的条带夹杂了来自硅胶板的杂质,因而图上存在一些噪音,但是硅胶板上洗脱的最强信号为609.3,与芦丁分子结构相吻合。图7进一步比较了标准品和混合样品的MS图谱,可以看出不同轨道的MS图谱之间的最强信号具有高度相似性,证明了此方法的准确性。
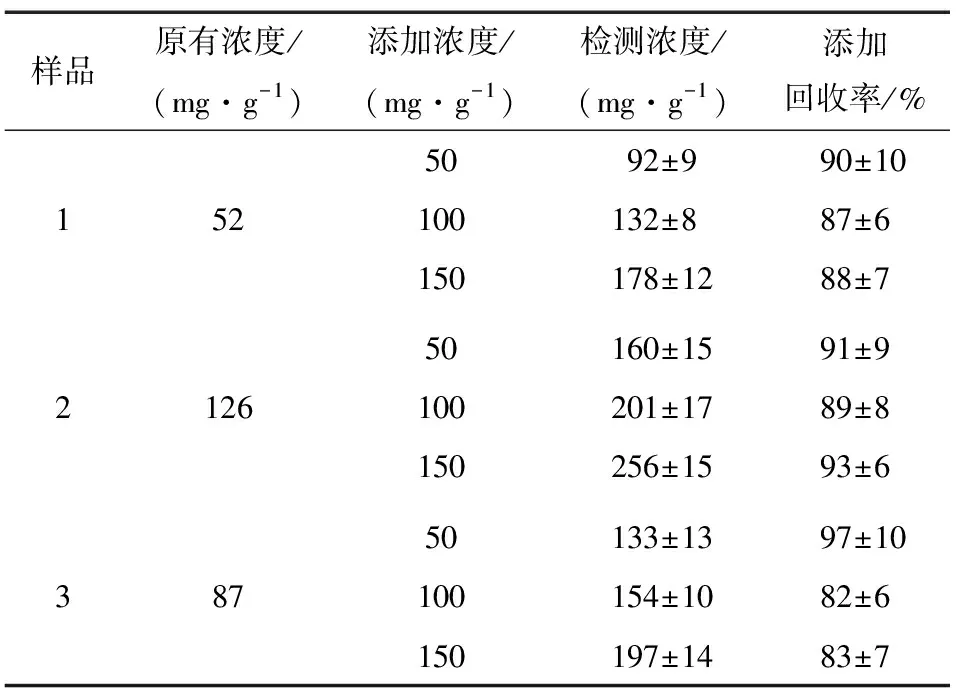
表1 检测方法的精度和准确度验证Table 1 Validation of the method precision and accuracy (n=9)

图7 芦丁标准品和硅胶板添加芦丁的槐米提取物样品条带出洗脱的物质的原位指纹图谱
Figure 7 The mass signals of analytes measured by HPTLC-ESI/MS of pure standards of rutin and rutin spiked into glutinous rice extract sample
3 结论
本法的创新之处在于建立了薄层板上芦丁与DPPH变色反应的浓度—信号关系标准曲线,结合硅胶板经光密度扫描、计算后得到的峰面积值,达到可快速测定保健品中芦丁的含量的目的。结果显示,DPPH在硅胶板上对芦丁的最优显色时间为15 min;通过使用乙酸乙酯/甲酸/乙酸/水(10/1.1/1.1/2,体积比)的混合物为流动相,在标准条件下(35%湿度控制,10 min预平衡)可以实现目标物与干扰基质的完全分离;随后使用光密度扫描仪(反射—荧光模式,D2&W灯,530 nm激发波长,无滤光片)对色谱显色结果进行精确检测,检测限和定量限分别为12,39 ng/Zone可以在50~500 ng/Zone范围内获得R2=0.997 4的方法线性,82%~97%的标准添加回收率和RSD<10%的精密度。此外,将色谱展开结果与电喷雾质谱检测联用从分子水平证明本方法利用HPTLC分离得到的目标条带含有芦丁而并非假阳性结果,证明本方法的可靠性。但本研究依然存在不足,DPPH乙醇溶液需要现配现用,其保存情况的好坏会影响显影结果,并且DPPH显影法的结果易受到不同因素的影响如温度、光照、样品pH等,而导致试验误差,因此DPPH显影法的具体反应条件有待于进一步确定;在用电喷雾质谱检测法证明方法可靠性时,从硅胶板上洗脱样品时也会夹杂硅胶板的杂质,对结果图谱的分析带来干扰,在未来试验中可以考虑尝试滤膜过滤洗脱液等方法来去除杂质。
