A2O-MBR工艺中生物泡沫现象原因及其影响研究
2019-03-29于真真胡以松王晓昌
于真真,胡以松,王晓昌
A2O-MBR工艺中生物泡沫现象原因及其影响研究
于真真,胡以松*,王晓昌**
(西安建筑科技大学陕西省环境工程重点实验室,西安建筑科技大学西北水资源与环境生态教育部重点实验室,陕西 西安 710055)
以实际规模A2O-MBR污水厂为研究对象,主要考察好氧池生物泡沫现象及其基本特征(质/量特征和生物特征),探究引发生物泡沫的潜在原因,并分析生物泡沫对污染物去除效果及膜污染的影响.结果表明试验期间,好氧池生物泡沫现象日趋严重,泡沫质/量特征值(泡沫量-Scum index,SI*和泡沫潜能/稳定性-Foam power,FP)随运行时间延长呈上升趋势,且SI*和FP与总胞外聚合物(extracellular polymeric substance,EPS)和结合型EPS浓度显著相关.生物泡沫中丝状菌丰度、微生物活性均高于污泥混合液.经分析生物泡沫的产生及稳定可能是由EPS作用和丝状菌(主要是微丝菌和0092型菌)作用引起的.生物泡沫持续存在期间,A2O-MBR系统对污染物去除效果(COD、NH4+-N、TN、TP和浊度)稳定,并未受到负面影响.泡沫对膜污染具有一定的影响.
A2O-MBR;生物泡沫;胞外聚合物(EPS);丝状菌;污水处理
膜生物反应器(Membrane bioreactor,MBR)具有许多传统活性污泥法(Conventional Activated Sludge, CAS)无可比拟的优点[1-2],近年来在污水处理及再生水回用领域得到广泛应用.然而,生物泡沫是实际MBR工程中常见的问题,具有发生率较高、普遍性和处理难度高等特点[3].
生物泡沫多是由于丝状菌过度增殖造成的.对于MBR泡沫丝状菌的研究比CAS要晚,少数研究表明诺卡氏菌、微丝菌、0092型菌、1851型菌、0041型菌、等是MBR泡沫现象中报道较多的几类丝状菌[4-7].丝状菌的生长增殖主要受到水质特征(例如,营养元素、可溶性易代谢有机物、溶解性硫化物、脂质、颗粒基质等的含量及种类)、工艺运行参数(例如,SRT、HRT、F/M等)和环境操作条件(例如,pH值、温度、溶解氧等的波动)三大因素影响[8].事实上,目前针对MBR丝状菌菌种及其对泡沫的真正作用和影响因素的研究还远远不够,所用数据多数仍是CAS工艺中得到的.
目前,国外Di Bella的研究团队对中试及小试MBR泡沫问题进行了较为详细的研究,阐明了除丝状菌作用外,胞外聚合物(extracellular polymeric substance,EPS)的浓度、成分等对生物泡沫形成及其特征的作用,并揭示了泡沫对工艺过滤性能及膜污染的影响[4,6,9-11].另外,少数研究报道了MBR发生泡沫问题后可采取的补救措施[12].上述研究多是在小试/中试MBR中进行,研究结论是否适合实际规模MBR中泡沫问题有待考证.另一方面,国内针对MBR泡沫的研究报道较少.本文主要目的是考察实际规模MBR污水处理厂中生物泡沫现象及其特性(质/量和生物特征),探讨生物泡沫产生的潜在原因,同时分析生物泡沫对A2O-MBR工艺性能的影响.以期对实际规模MBR污水处理厂中出现的生物泡沫问题提供运行管理的有效参考.
1 材料与方法
1.1 污水厂概况及运行条件
A2O-MBR工艺位于西安某校园污水处理厂,主要目的是实现同步污水处理与回用,其设计进水流量2000m3/d,总有效容积1200m3,工艺流程图参考文献[13].生物处理单元由厌氧池、缺氧池、好氧池和膜池四部分组成.原水先后经过粗格栅(5mm)、调节池、细格栅(1mm)进入到生物处理单元,水质如表1所示.膜组件为PVDF中空纤维柱式微滤膜,孔径0.1μm,共216支,膜总面积5400m2.系统采用恒通量过滤模式,由自吸泵间歇抽吸出水,抽停时间比9min/1min,膜通量保持在16L/(m2·h).总水力停留时间13h,污泥停留时间20~40d.好氧池污泥浓度(MLSS) 5000~8000mg/L.该工艺设置3个混合液回流:膜池污泥回流至好氧池,好氧池回流至缺氧池,缺氧池回流至厌氧池,回流比分别为2.5:2:1.好氧池溶解氧(DO)维持在2~4mg/L.系统配置了可编程逻辑控制器,可自动控制进水、曝气、污泥回流和出水等.跨膜压差(TMP)由在线真空压力表监测.为有效控制膜污染,每1~2周进行一次维护性清洗(EFM),药剂为次氯酸钠(3000mg/L),清洗持续时间2h;根据运行情况6~12个月进行一次在线化学清洗(CIP),药剂为次氯酸钠(3000mg/L)和柠檬酸(10000mg/L),清洗持续时间10~12h.
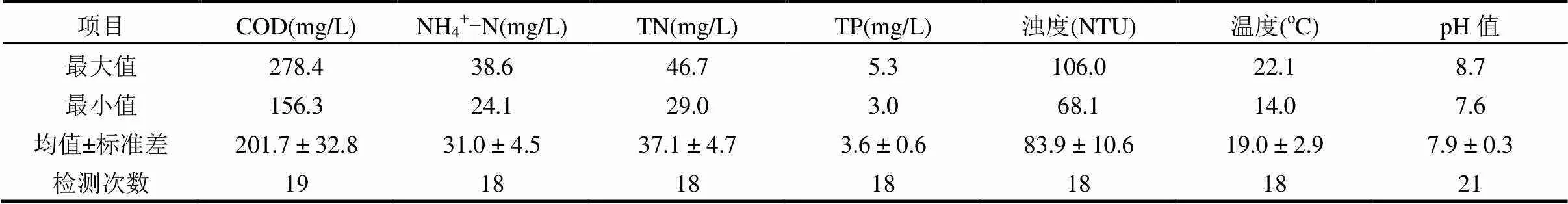
表1 原水水质 Table 1 Influent quality
1.2 EPS提取与测定
采用热处理法进行活性污泥EPS提取,详细提取步骤参考文献[13].提取出的EPS由溶解型EPS (SEPS)和结合型EPS(BEPS)两部分构成,再分别对其进行蛋白质和多糖含量分析.多糖的测定采用硫酸-苯酚分光光度计法[14],蛋白质的测定采用改进的Lowry法[15].故总EPS含量(EPStot)可用式(1)计算:

式中:下标"p"和"c"分别表示蛋白质和多糖.
1.3 泡沫质/量测试方法
1.3.1 泡沫量的测试 为了控制传统活性污泥法中的泡沫,Pretorius等[16]提出了选择性浮选原则(selective flotation principle),即通过在特定尺寸的圆柱形浮选装置(高50cm,内径8cm)中对2L污泥混合液进行特定强度的曝气(10Lair/(L·h)持续15min)来实现"浮选"和"纯化或稀释"泡沫两个步骤,从而定量地表征活性污泥转化生成泡沫的量.泡沫量可用"Scum Index"(SI)表示,计算公式如下:

稀释分离出的泡沫样品可能会对分析EPS浓度对泡沫的原始作用产生负面影响,故本研究中对原始方法进行了些微改动,即仅进行"浮选"步骤,省略后续的"纯化或稀释"步骤(得到的泡沫量用SI*表示,计算公式同上).详细步骤参考文献[10].
1.3.2 泡沫质的测试 发泡能力(Foam Power,FP)可用来评价泡沫潜能/稳定性[17].测试步骤如下:将100mL污泥混合液样品倒入特制的透明亚克力圆柱形量筒(高100cm,内径3cm,横截面积约7cm2)内,在量筒底部进行曝气,曝气量设为5L/min,曝气时长30s.曝气前后形成的液面差定义为0,FP可通过下式计算:

式中:FP为每升曝气量所消耗的用以产生泡沫的污泥混合液体积,mL/L;为量筒横截面积,cm2;为曝气量,L/min;为曝气时长,min.
1.4 Biolog分析
Biolog方法通过测试不同微生物对单一碳源底物利用程度的差异来反映微生物群落结构和功能多样性[18].本研究采用96孔Biolog ECO微平板(BIOLOGTM Inc.,Hayward,CA,USA),每32孔为1组平行,含31种碳源和1个水空白对照,共计三组平行.31种碳源可划分为六类:聚合物类、糖类、羧酸类、氨基酸类、胺类和酚类[19].实验操作步骤参考文献[18],但培养时间延长至240h.本研究采用OD590减去OD750得到的吸光度值进行后续的孔平均颜色变化率(AWCD)、6类碳源各自的标准化吸光度比率(F)的计算,计算公式[19]分别如下:
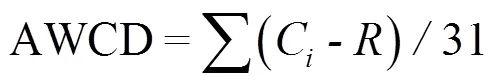


式中:AWCD可用来表征微生物活性;C是各碳源孔的吸光度值;是对照孔的吸光度值;R是类碳源中碳源的吸光度值;f是类碳源的平均吸光度值;F是类碳源的标准化吸光度比率;n是类碳源所包含的碳源个数.
1.5 其他分析
NH4+-N、TN、TP、COD、MLSS采用标准方法测定[20].pH采用PHS-3C型pH计测定.温度和DO由便携式水质分析仪(WTW Multi3410,德国)测定.浊度采用浊度计(WGZ-1A,上海)测定.泡沫照片由数码相机(佳能SX260HS,日本)拍摄记录.参照文献[8]进行革兰氏染色和奈瑟氏染色,采用光学显微镜(Nikon 90i,日本)进行丝状菌鉴定,并依据丝状菌丰度主观评分标准(Subjective Scoring of Filament Abundance)[8]进行简单计数,即0=none;1=few,只有少量菌丝被偶然观察到;2=some,菌丝时常被观察到,但不存在于所有絮体上;3=common,每个絮体上均有1~5条菌丝;4=very common,每个絮体上均有5~20条菌丝;5=abundant,每个絮体上菌丝>20条; 6=excessive,菌丝数超过絮体数.
2 结果与讨论
2.1 生物泡沫现象及特征
该污水厂生物泡沫现象2014年以前就发生,持续时间较长.由图1a可见,好氧池上方漂浮着褐色的浮渣和黄色的泡沫,在曝气较弱区域聚集尤为明显.携带生物泡沫的污泥混合液从好氧池进入到膜池,导致膜池上方也漂浮黄色且较密集的泡沫(图1b).

图1 生物泡沫现象 Fig.1 Photos showing biological foaming phenomenon
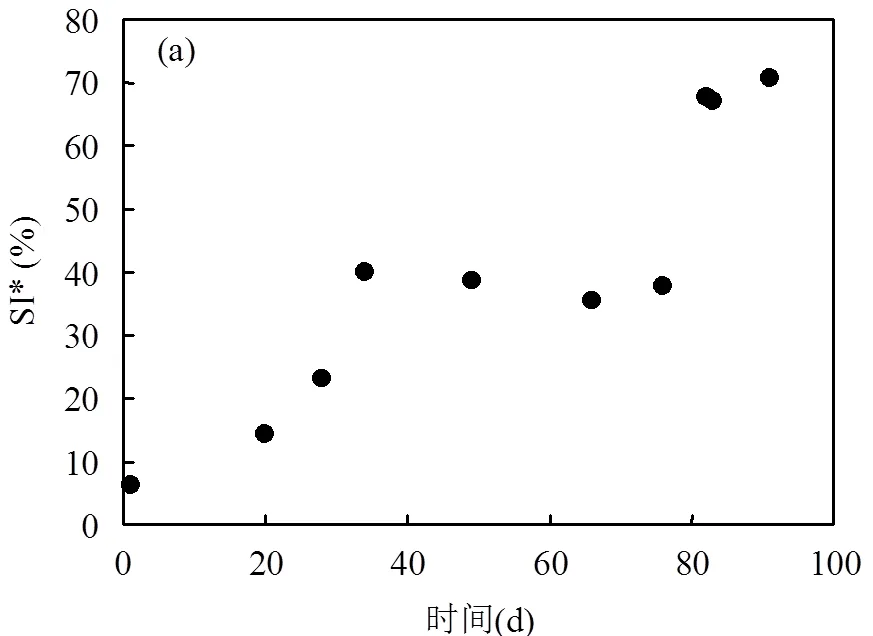
2.1.1 泡沫质/量特征 好氧池泡沫的质/量特征 (SI*和FP)见图2.如图2a所示,根据Di Bella等[9]提出的SI*划分定义,试验初期泡沫处于"moderate"阶段(SI*=6.43%,5%~10%),约20d后发展到"serious"阶段(SI*=14.31%,10%~15%),之后进入"disastrous"阶段(SI*>15%).本研究中SI*max达到了70%以上,而Di Bella等[9]的中试MBR泡沫研究中SI*max约16%,Cosenza等[10]的SI*max低于35%.这些差别可能是由于污水厂规模、构造、操作条件或活性污泥特性等方面的差异造成的.泡沫潜能/稳定性见图2b.试验期间FP整体上呈现上升趋势,由试验初期的14.1mL/L最终增至36.7mL/L,表明FP随运行时间的延长不断强化.Di Bella等[9]和Cosenza等[10]的中试MBR泡沫研究中FP分别达到60~90mL/L和5~50mL/L,相比之下略高于本研究的值,这可能是由于活性污泥的特性差异造成的.
2.1.2 泡沫生物特征 Jenkins等[8]提出用丰度(Abundance,Ab)来表征丝状菌数量,虽然该标准具有一定的主观性,但其重复性可保持在±1的可接受范围内.镜检结果显示好氧池污泥混合液中的丝状菌丰度(Ab)从试验初期的1(few)逐渐增至3(common),表明活性污泥中的泡沫丝状菌含量较低.同一时期泡沫的Ab值往往高于污泥混合液.例如图3所示,当污泥混合液Ab为2时(图3a),泡沫Ab值达到4 (图3b).根据染色结果和形态学特征初步判定泡沫中的优势丝状菌主要是微丝菌(),其次是0092型菌(图3c和d).泡沫中出现丝状菌富集的原因可能是由于好氧池的曝气浮选作用将污泥混合液中部分丝状菌转移至泡沫中或者可能是泡沫为丝状菌提供了更适合生长的微环境,有助于其增殖[16,21].

图3 污泥混合液和生物泡沫的镜检照片 Fig.3 Microscope observation of mixed liquor and biological foam(a)混合液;(b)泡沫;(c)泡沫革兰氏染色;(d)泡沫奈瑟氏染色.G+:革兰氏阳性;G-:革兰氏阴性;N+:奈瑟氏阳性;N-:奈瑟氏阴性
图4a表示AWCD随培养时间的变化曲线,其可表征微生物活性.整个培养周期内好氧池泡沫的AWCD值明显高于污泥混合液,表明泡沫中微生物活性大于污泥混合液.游佳等[22]通过测定脱氮除磷氧化沟系统中生物泡沫的耗氧速率同样发现泡沫具有良好的生物活性.图4b表示培养96h时污泥混合液和泡沫对6类碳源的平均吸光度比率.两者对6类碳源均可代谢利用但程度有所不同,表明两者的微生物群落结构和功能多样性有所差异.具体而言,二者均包含6类代谢群,其中污泥混合液中微生物以糖类代谢群为优势类群,羧酸类代谢群也较突出,而泡沫中糖类和羧酸类优势类群明显下降,胺类代谢群相较污泥混合液反而上升.

2.2 生物泡沫产生的潜在原因分析
2.2.1 EPS作用分析 好氧池污泥混合液中EPS浓度变化如图5所示.EPStot浓度逐渐累积,最后高达85mg/g SS以上.其中BEPS浓度远高于SEPS浓度,最终高达80mg/gSS左右,且蛋白质浓度(BEPSp)高于多糖浓度(BEPSc).造成系统中EPS累积可能有以下几个原因:(1)系统采用的浸没式膜组件及后期膜表面形成的滤饼层可以不断截留大量EPS;(2)为了冲刷膜表面减少膜污染,膜池中的曝气强度往往较大[经计算约为7.7m3/(m2·h)],导致其剪切力较大,进而增加EPS的释放量[23];(3)试验从秋季进行到冬季,进水水温从初期22℃逐渐降至14℃,低温条件可促进EPS释放到污泥混合液[24].

图5 污泥中EPS含量随运行时间的变化趋势 Fig.5 Evolution of EPS concentration in the mixed liquor with running time
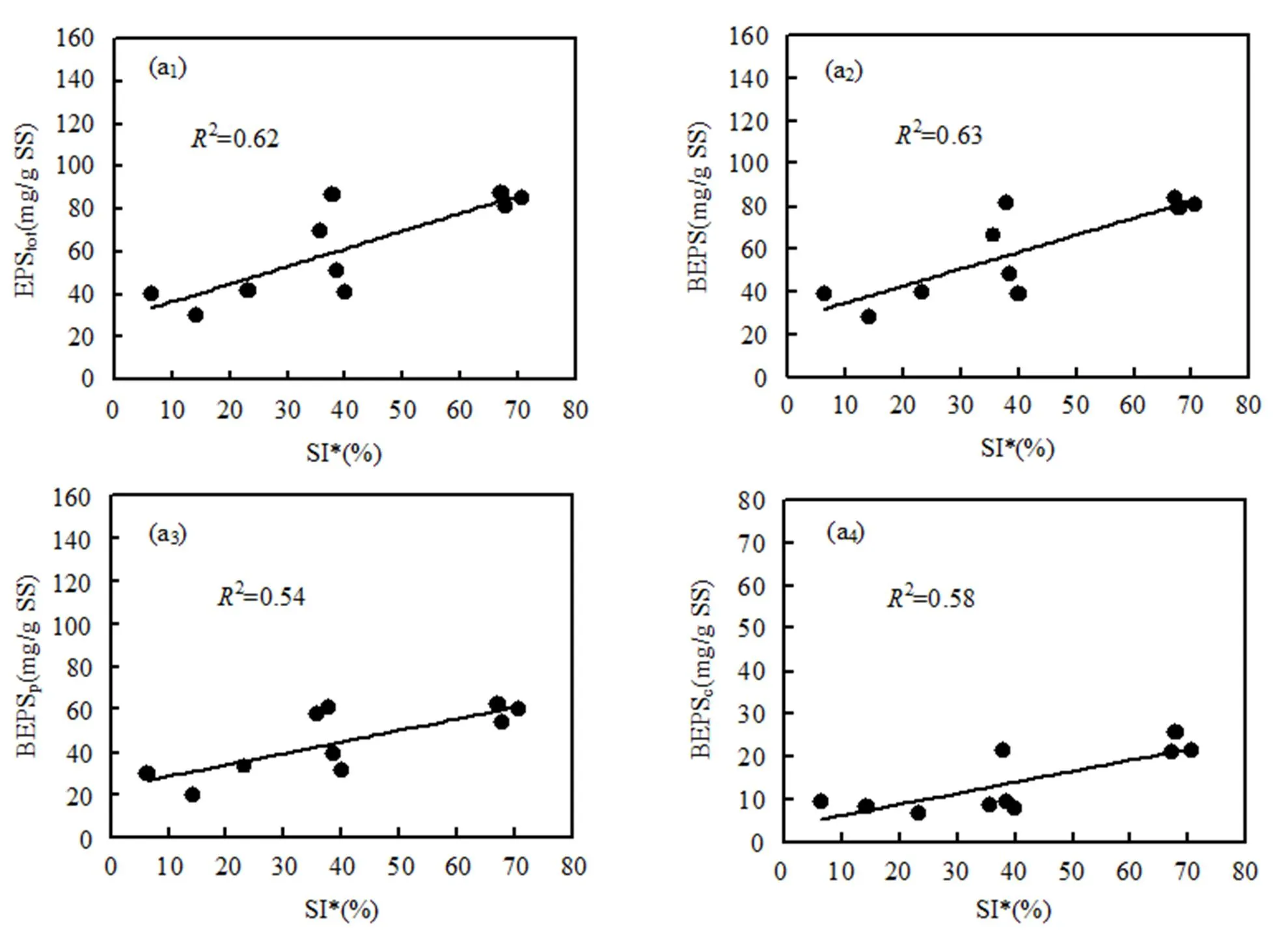
图6表示SI*和FP与EPS浓度(EPStot、BEPS、BEPSp和BEPSc)的相关性.因SEPS与SI*和FP无显著相关性,故此均在图中省略.由图6a1、b1可见,SI*和FP与EPStot均具有良好的正相关性.图6a2、b2可见,SI*和FP与BEPS的相关系数2分别为0.63和0.83,表明该污水厂泡沫SI*和FP受BEPS影响显著.这与中试MBR泡沫研究的结果一致[9-10].进一步从蛋白质和多糖两种不同EPS成分角度考虑,SI*与BEPSc(2=0.58)和BEPSp(2=0.54)的2差异不大,故认为SI*受BEPSc和BEPSp的影响相当.而FP与BEPSp正相关性(2=0.75)明显大于BEPSc(2=0.62),表明FP受BEPS中蛋白质成分的影响较显著.早前多数中试MBR泡沫研究也都表明了这一点[9-10,17].
污泥絮体中的EPS 通常含有大量的荷电基团和非极性基团(例如,蛋白质成分中的芳烃基团和脂肪族基团及多糖成分中的疏水部位),它们对活性污泥的亲疏水性起着重要作用[25].不少研究表明活性污泥多呈疏水性,这主要与EPS中蛋白质成分有关[26-27].污泥疏水性是造成起泡的重要因素之一[28].在曝气池曝气作用下产生的气泡可作为动力,将极具疏水性的污泥颗粒,尤其是形小、质轻的小颗粒物质浮选至曝气池表面,逐渐形成泡沫层或浮渣层.另一方面,EPS主要是由微生物(细菌为主)分泌产生的复杂聚合物,具有生物表面活性剂特性,对于维持污泥絮体结构具有重要作用.然而过量的具有生物表面活性剂性质的EPS会对泡沫产生负面影响.因为原本气-水两相的气泡在表面活性剂的作用下,稳定性增强,更加不易破碎,易形成持久性泡沫[8].
2.2.2 丝状菌作用分析 镜检结果发现微丝菌相对于其他丝状菌丰度最高.这类丝状菌丝体长度50~200μm,丝体高度弯曲,有时扭曲、缠绕或穿越絮体,其脂类含量达细胞干重的35%,使得其比重比水轻,因此易漂浮到水面[29].镜检发现泡沫中微丝菌丰度也确实高于污泥混合液.相比微丝菌,0092型菌丝体短,长度10~80μm,直径0.8~1μm,丝体笔直或弯曲,常见于絮体内部及周围.目前关于0092型菌的生理特征尚不清楚.不过已有研究表明,低污泥负荷条件(F/M约0.15~0.05kgBOD5/(kgMLSS·d))有利于0092型菌生长增殖,相似的,微丝菌适宜在0.20~ 0.05kgBOD5/(kgMLSS·d)负荷范围内增殖[8].经计算该污水厂好氧曝气池的F/M约为0.16~0.10kgCOD/ (kgMLSS·d),负荷较低,为微丝菌和0092型菌的增殖创造了一定条件.
这些检测到的丝状菌其丝状结构对泡沫产生或稳定可能会有一定影响.因为丝状结构易形成网,能捕扫污泥微粒和曝气产生的气泡,并上浮到水面.被丝网包围的气泡,增加了其表面张力,使气泡不易破碎,更加稳定.Campo等[11]曾报道丝状菌对泡沫具有一定的稳定效果,可导致FP值上升.本试验亦观察到FP呈上升趋势,进一步印证Campo等的结论.另外多数丝状菌可以合成表面活性剂物质,例如包含脂肪、脂肽、蛋白质、多糖等胞外聚合物,使污泥中EPS浓度增加,可能进一步恶化泡沫问题[7].
2.3 生物泡沫对工艺性能的影响

2.3.1 对污染物去除效果的影响 试验从2014年9月下旬持续至12月底,共约100d.期间,生物泡沫持续存在,各种污染物去除效果见图7. A2O-MBR工艺对COD、NH4+-N、TN和浊度的去除效果良好,去除率分别可达88.1%±5.1%、99.1%±0.3%、64.0%±4.5%和99.5%±0.2%,出水平均值分别稳定在25、1、15mg/L和1NTU以下.另外,系统虽然对TP的去除率比较稳定(70.8%±4.3%),但出水浓度仍然偏高,稳定在1mg/L左右,这可能由于系统SRT较长,富磷污泥无法及时排出导致的.参照城市回用水质标准[30-31],该污水厂出水完全满足冲厕和绿化回用水质要求.除了TP外,其他出水指标还可满足景观回用水水质要求.综上分析可知,生物泡沫未造成出水水质明显波动或恶化.Di Bella等[9]报道其中试MBR装置在经历生物泡沫期间,COD平均去除率为95%,平均硝化和反硝化效率分别为99%和85%,总氮去除率为85%~90%.You等[7]的小试MBR在经历泡沫事件前后,也始终保持良好的污染物(COD、BOD和SS)去除效果.以上报道进一步证实MBR系统中生物泡沫未对污染物去除产生负面影响.
甚至有试验表明生物泡沫可能对污染物去除产生有利作用.例如,游佳等[22]通过测定脱氮除磷氧化沟系统中生物泡沫的耗氧速率、硝化速率和反硝化速率,除了发现泡沫具有良好的生物活性,还发现泡沫层中除丝状菌外,还存活着大量硝化菌和反硝化菌,在一定条件下可能有助于反硝化和硝化作用.本研究通过Biolog方法分析泡沫中微生物群落对各类碳源的利用情况,同样证实泡沫具有良好的微生物活性(图4a),且泡沫中微生物对聚合物类、糖类、羧酸类、氨基酸类、胺类和酚类碳源物质均可代谢利用,其中对胺类这种相对难降解物质的代谢利用度甚至高于污泥混合液(图4b).鉴于以上分析可知,泡沫对于污水中复杂成分的去除可能会有效果.如何有效利用泡沫,而不是简单地将其清除,对于提高污水厂运行效果具有一定的研究价值.
2.3.2 对膜污染的影响 试验期间,系统进行了5次EFM清洗,未进行CIP清洗.在恒通量运行模式下,TMP可以反映膜污染状况,其变化如图8.TMP在12.7至32.9kPa范围内变化,低于进行CIP 清洗的设定值(55kPa).周期性的EFM清洗在一定程度上可以缓解膜污染,但随着运行时间的延长,TMP整体上呈上升趋势,表明膜污染逐渐加重.
Cosenza等[10]研究了中试MBR系统中EPS对泡沫和膜污染的影响,进一步分析了泡沫和膜污染的关系,认为当MBR系统中发生泡沫时,膜污染速率反而降低,这是因为BEPS被"束缚"在漂浮着的泡沫层中.与此相反,Campo等[11]在研究间歇式曝气膜生物反应器中的泡沫事件时,揭示出泡沫与膜污染现象不是相互独立的,而是通过BEPS相互联系,SI*和FP的强化会导致膜污染加重.Yue等[7]在小试MBR中研究膜的亲疏水性对膜污染的影响时发现,在发生泡沫的条件下,疏水性膜受到的膜污染比亲水性膜更为严重.也就是说泡沫对膜污染的影响与膜本身性质有关.本试验结果基本符合Campo等[11]的结论,但仍需更深入的研究来论证泡沫和膜污染的关系.因为Campo等[11]曾指出生物反应器的几何特征会影响泡沫特性.本研究中A2O-MBR规模远大于前两者的反应器规模,几何特性亦不同于前两者,且膜的亲疏水性对泡沫与膜污染之间的关系亦会产生影响,故在今后的工作中还需进一步研究.
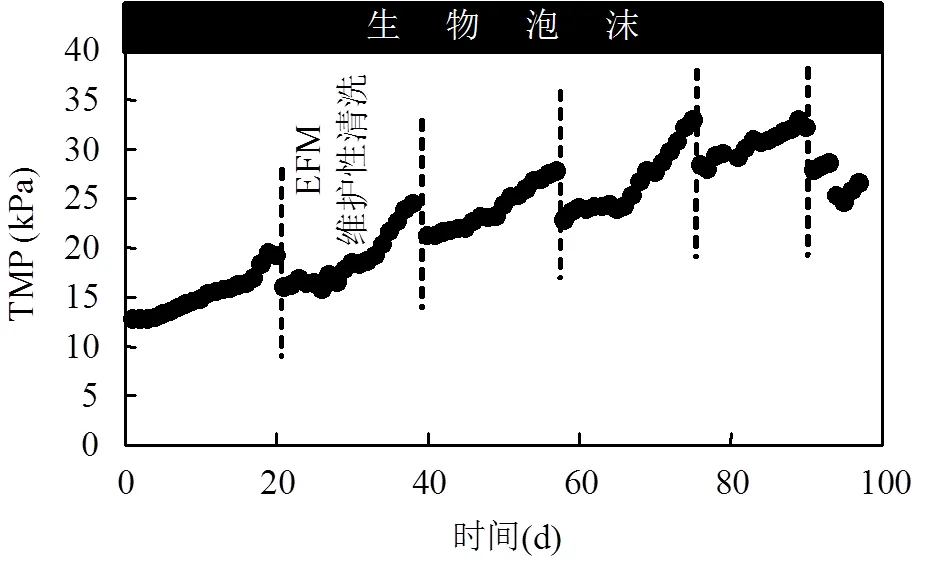
图8 TMP随运行时间的变化 Fig. 8 Variation of TMP with running time
3 结论
3.1 泡沫中丝状菌丰度、微生物活性均高于污泥混合液,且泡沫中微生物对聚合物类、糖类、羧酸类、氨基酸类、胺类和酚类碳源物质均可代谢利用,其中对胺类这种相对难降解物质的代谢利用度高于污泥混合液.
3.2 初步判定泡沫的产生主要由EPS和丝状菌引起. SI*与EPStot、BEPS浓度相关,相关系数2分别为0.62、0.63,FP亦与二者显著相关,2分别为0.83和0.83.泡沫中优势丝状菌主要是微丝菌和0092型菌.
3.3 泡沫期间,A2O-MBR工艺对COD、NH4+-N、TN、TP和浊度的去除率分别达88.1%±5.1%、99.1%±0.3%、64.0%±4.5%、70.8%±4.3%和99.5%±0.2%,出水完全满足冲厕和绿化回用水质要求.除了TP外,其他出水指标还可满足景观回用水水质要求.另外,甚至有可能利用泡沫中微生物去除污水中的一些复杂有机物,具体利用方法有待进一步研究.
3.4 泡沫对膜污染产生一定的影响.
[1] 王 芳,李之鹏,徐 仲,等.AF-MBR处理海水养殖废水性能及膜污染特性 [J]. 中国环境科学, 2018,38(5):1760-1766.Wang F, Li Z P, Xu Z, et al. Studies on the nitrogen removal performance and membrane fouling characteristics of AF-MBR for mariculture wastewater treatment [J]. China Environmental Science, 2018,38(5):1760-1766.
[2] 余智勇,文湘华.厌氧膜生物反应器中亲疏水性有机物的膜污染特征 [J]. 中国环境科学, 2018,38(7):2471-2476.Yu Z Y, Wen X H. Fouling of microfiltration membranes by hydrophilic and hydrophobic organic fractions in Anaerobic membrane bioreactors [J]. China Environmental Science, 2018,38(7):2471-2476.
[3] 李宗仁,张新颖,林琳琳,等.污泥膨胀和生物泡沫的形成机理和控制方法 [J]. 净水技术, 2018,37(4):28-33.Li Z R, Zhang X Y, Lin L L, et al. Mechanism and control solutions for formation of sludge bulking and biological foaming [J]. Water Purification Technology, 2018,37(4):28-33.
[4] Capodici M, Di Bella G, Nicosia S, et al. Effect of chemical and biological surfactants on activated sludge of MBR system: Microscopic analysis and foam test [J]. Bioresource Technology, 2015, 177:80-86.
[5] Maza-Marquez P, Vílchez-Vargas R, Boon N, et al. The ratio of metabolically active versus total Mycolata populations trigger foaming in a membrane bioreactor [J]. Water Research, 2016,92:208-217.
[6] Di Bella G, Torregrossa M. Foaming in membrane bioreactors: identification of the causes [J]. Journal of Environmental Management, 2013,128(20):453-461.
[7] You S J, Sue W M. Filamentous bacteria in a foaming membrane bioreactor [J]. Journal of Membrane Science, 2009,342(1):42-49.
[8] Jenkins D, Richard M G, Daigger G T. Manual on the causes and control of activated sludge bulking, foaming, and other solids separation problems, 3rd ed [M]. IWA Publishing, London, UK, 2004.
[9] Di Bella G, Torregrossa M, Viviani G. The role of EPS concentration in MBR foaming: Analysis of a submerged pilot plant [J]. Bioresource Technology, 2011,102(2):1628-1635.
[10] Cosenza A, Di Bella G, Mannina G, et al. The role of EPS in fouling and foaming phenomena for a membrane bioreactor [J]. Bioresource Technology, 2013,147(7):184-192.
[11] Campo R, Capodici M, Di Bella G, et al. The role of EPS in the foaming and fouling for a MBR operated in intermittent aeration conditions [J]. Biochemical Engineering Journal, 2017,118:41-52.
[12] Kale M M, Singh K S. Foaming in sludge-bed anaerobic membrane bioreactor [J]. Journal of Environmental Engineering, 2016,142(4):1-3.
[13] Hu Y, Wang X C, Zhang Y, et al. Characteristics of an A2O-MBR system for reclaimed water production under constant flux at low TMP [J]. Journal of Membrane Science, 2013,431:156-162.
[14] Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry, 1956,28(3):350-356.
[15] Hartree E F. Determination of protein: a modification of the Lowry method that gives a linear photometric response [J]. Analytical Biochemistry, 1972,48(2):422-427.
[16] Pretorius W A, Laubscher C J P. Control of biological scum in activated sludge plants by means of selective flotation [J]. Water Science and Technology, 1987,19:1003-1011.
[17] Nakajima J, Mishima I. Measurement of foam quality of activated sludge in MBR process [J]. Acta Hydrochimca et Hydrobiologica, 2005,33(3):232-239.
[18] Yang C, Zhang W, Liu R, et al. Phylogenetic diversity and metabolic potential of activated sludge microbial communities in full-scale wastewater treatment plants [J]. Environmental Science and Technology, 2011,45(17):7408-7415.
[19] Zhang T Y, Wu Y H, Zhuang L L, et al. Screening heterotrophic microalgal strains by using the Biolog method for biofuel production from organic wastewater [J]. Algal Research, 2014,6:175-179.
[20] 国家环境保护总局. 水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002.Chinese, N.E.P.A. Water and Wastewater Monitoring Methods [M]. Beijing: Chinese Environmental Science Publishing House, 2002.
[21] Dunkel T, Gallegos E L D L, Bock C, et al. Illumina sequencing for the identification of filamentous bulking and foaming bacteria in industrial activated sludge plants [J]. International Journal of Environmental Science & Technology, 2017,15(5):1-20.
[22] 游 佳,张向阳,郑兴灿,等.氧化沟系统的生物泡沫现象及生物性能初步研究 [J]. 中国给水排水, 2013,29(21):93-96.You J, Zhang X Y, Zheng X C, et al. Study on biological foams and their performance in oxidation ditch [J]. China Water & Wastewater, 2013,29(21):93-96.
[23] Wang Z, Wu Z, Tang S. Extracellular polymeric substances (EPS) properties and their effects on membrane fouling in a submerged membrane bioreactor [J]. Water Research, 2009,43(9):2504-2512.
[24] Jiang T, Kennedy M D, Guinzbourg B F, et al. Optimising the operation of a MBR pilot plant by quantitative analysis of the membrane fouling mechanism [J]. Water Science and Technology, 2004,51(6/7):19-25.
[25] Lin H, Zhang M, Wang F, et al. A critical review of extracellular polymeric substances (EPSs) in membrane bioreactors: Characteristics, roles in membrane fouling and control strategies [J]. Journal of Membrane Science, 2014,460(9):110-125.
[26] Jorand F, Bouge-Bigne F, Block J C, et al. Hydrophobic/hydrophilic properties of activated sludge exopolymeric substances [J]. Water Science and Technology, 1998,37(4/5):307-315.
[27] Hong H, Peng W, Zhang M, et al. Thermodynamic analysis of membrane fouling in a submerged membrane bioreactor and its implications [J]. Bioresource Technology, 2013,146(10):7-14.
[28] Petrovski S, Dyson Z A, Quill E S, et al. An examination of the mechanisms for stable foam formation in activated sludge systems [J]. Water Research, 2011,45(5):2146-2154.
[29] Slijkhuis H, van Groenestijn J W, Kylstra D J. Microthrix parvicella, a filamentous bacterium from activated sludge: growth on Tween 80as carbon and energy source [J]. Journal of General Microbiology, 1984,130(8):2035-2042.
[30] GB/T18920-2002 城市污水再生利用城市杂用水水质 [S].GB/T18920-2002The reuse of urban recycling water--Water quality standard for urban miscellaneous water consumption [S].
[31] GB/T 18921-2002 城市污水再生利用景观环境用水水质 [S].GB/T18921-2002The reuse of urban recycling water--Water quality standard for scenic environment use [S].
Origin and influence of biological foaming phenomenon in an A2O-MBR process for wastewater treatment.
YU Zhen-zhen, HU Yi-song*, WANG Xiao-chang**
(Shaanxi Key Laboratory of Environmental Engineering, Key Laboratory of Northwest Water Resource, Environment and Ecology, Ministry of Education, Xi’an University of Architecture and Technology, Xi’an 710055, China)., 2019,39(3):1034~1042
A full-scale A2O-MBR wastewater treatment plant was investigated to analyze the phenomenon and characteristics of foam (quality/quantity and biological feature) in the oxic tank. Furthermore, the possible causes of foaming, as well as the effects of foaming on the pollutants removal and membrane fouling were elucidated. The results showed a significant progression of the foaming phenomenon, whereby the foam quality/quantity parameters (foam quantity-Scum index, SI*and foam potential/stability- Foam power, FP) increased considerably with running time. Also, the foam SI* and FP values were significantly correlated with the concentrations of total EPS and bound EPS. In addition, the abundance of filamentous bacteria and microbial activity in the foam were notably higher than that in the mixed liquor. Analytically, the formation and stability of foam might be caused by EPS and filamentous bacteria (mainlyand Eikelboom 0092type). Nonetheless, the efficiencies of pollutants removal (COD、NH4+-N、TN、TP and turbidity) were found to be free from the negative effects of biological foam. In contrast, membrane fouling was influenced by biological foam to some extent.
A2O-MBR;biological foam;extracellular polymeric substance (EPS);filamentous bacteria;wastewater treatment
X703
A
1000-6923(2019)03-1034-09
于真真(1988-),女,河南济源人,西安建筑科技大学博士研究生,主要从事膜法污水处理与回用技术.发表论文9篇.
2018-07-25
国家自然科学基金资助项目(51778522,51508450);国家水体污染控制与治理科技重大专项(2013ZX07310-001)
*责任作者, 副教授, yshu86@163.com;**教授, xcwang@xauat.edu.cn
