不同来源托鲁巴姆种子的发芽特性研究
2019-03-29丁小雪汪炳良胡雨晴米月华叶红霞
丁小雪,汪炳良,2,海 睿,胡雨晴,米月华,叶红霞,*
(1.浙江大学 蔬菜研究所,浙江 杭州 310058;2. 浙江大学湖州市南太湖现代农业科技推广中心,浙江 湖州 313000)
茄子是一种重要蔬菜,被FAO列为全世界第四大蔬菜作物[1]。我国是全球最大茄子生产国,据FAO数据,2012年我国茄子总产量占世界茄子总产量的58%。无论平原还是山地,均可栽培茄子。在茄子生产中遇到的最严重问题之一就是黄萎病危害严重,在黄萎病发生区域,一般导致减产20%以上,严重的减产50%以上,甚至绝收。目前,利用抗病砧木进行茄子嫁接栽培是克服黄萎病最有效的措施[2-4]。其中,野生茄子托鲁巴姆是当前在茄子嫁接育苗中应用最为广泛的砧木品种[5-7],该砧木品种具有抗病、与多数茄子品种嫁接亲和、嫁接对果实产量和品质无不良影响等特点。然而由于托鲁巴姆种子细小、发芽困难、幼苗生长缓慢,因而影响了茄子嫁接育苗过程中播种期与播种量的确定。利用外源物质促进托鲁巴姆种子发芽已有不少研究报道[8-13],但前人一般使用单一来源的托鲁巴姆作为材料进行研究,而目前市场上供应的托鲁巴姆来源多样,种子价格、种子发芽率差异极大。因此,本研究以不同来源的托鲁巴姆种子为材料,通过GA3浓度及浸种时间处理,研究其对种子发芽的影响,以及不同来源托鲁巴姆种子的发芽特性,为茄子嫁接育苗中托鲁巴姆种源的选取提供依据。
1 材料与方法
1.1 试验材料
供试材料为10份不同来源的托鲁巴姆和1份栽培茄子品种,10份托鲁巴姆种子(编号A1、A2、A3、……A8、A9、A10)购自山地、辽宁、北京、天津等地,其中A1、A3源自日本(均购自国内),栽培茄子品种杭茄2010(A11)由杭州市农业科学研究院蔬菜所提供。试验所用赤霉素(gibberellic acid mix)、无水乙醇,购自上海生工。
1.2 试验方法
试验于2017年12月至2018年2月在浙江大学紫金港校区实验室进行。将10个不同来源的托鲁巴姆和杭茄2010种子利用清水进行发芽,同时全部材料在0 mg·L-1(清水,B1)、50 mg·L-1(B2)、100 mg·L-1(B3)、200 mg·L-1(B4)、400 mg·L-1(B5)GA3溶液中浸种12 h(C1)、24 h(C2)、36 h(C3)、48 h(C4)、60 h(C5)。试验设置3次重复,每重复50粒。浸种温度(20±1)℃,浸种后用蒸馏水清洗干净,在变温培养箱发芽,发芽床采用铺设2层滤纸的玻璃培养皿,温度设置(30±1)℃(18 h)、(20±1)℃(6 h)。发芽期间保持滤纸湿润,每天记录种子发芽数,直至连续3 d种子发芽数不再增加。
1.3 数据处理
根据逐日发芽种子数记录结果,计算发芽势、发芽率及发芽指数[10]。按三因素随机区组试验设计,利用SPSS 11.5进行统计,利用Excel 10.0作图。
2 结果与分析
2.1 不同来源托鲁巴姆种子的发芽势与发芽率
试验结果表明,在未经GA3处理的条件下,不同来源的托鲁巴姆种子发芽势、发芽率存在显著差异(图1),其中A3种子发芽势最高,显著高于其余9份种子,但显著低于杭茄2010(A11),A10种子发芽势除低于A3、A11外,高于其余8份种子,且显著高于A1、A9之外的6份,A2、A5、A8发芽势均为0。从图1可以看出,10份托鲁巴姆种子发芽率也存在显著差异,其中A3和A7的发芽率最高(分别达到90.67%和98%),并显著高于其余8份,A10的发芽率显著高于其余7份种子,A2、A6和A8的发芽率最低(均低于50%),显著低于另外7份。此外,除了A7的发芽率高于种子包装袋标识的发芽率指标外,其他9份托鲁巴姆的发芽率均低于种子包装袋标识。
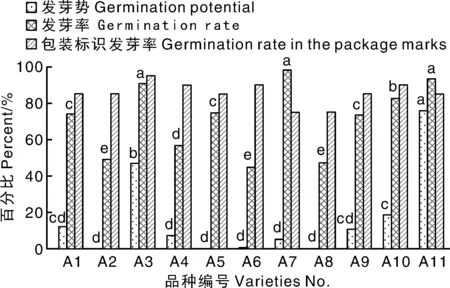
同一指标不同品种间没有相同小写字母表示差异显著(P<0.05)。The bars of the same index with different lowercase letters showed significant difference (P<0.05).图1 不同来源托鲁巴姆种子的发芽势与发芽率Fig.1 Seed germination potential and germination rate of different Solanum torvum seeds
2.2 GA3对托鲁巴姆种子发芽进程的影响
测定结果发现,不同来源的托鲁巴姆种子发芽进程不同,而且,托鲁巴姆种子的发芽进程因不同GA3处理(包括处理浓度及浸种时间)而异。但总的趋势是GA3处理可以在一定程度上提高种子发芽率,并且GA3处理可以加快种子发芽、缩短种子发芽所需时间。如托鲁巴姆A1和A7在50、100、200、400 mg·L-1的GA3浓度下浸种12、24、36、48、60 h条件下种子发芽进程如图2、图3所示,其中0 h表示未进行GA3处理。
2.3 GA3对种子发芽率的影响
方差分析结果发现,种子来源、GA3浓度、种子来源×GA3浓度一级互作对种子发芽率有极显著影响,GA3浓度×GA3浸种时间一级互作以及种子来源×GA3浓度×GA3浸种时间二级互作对种子发芽率有显著影响。GA3浸种时间、种子来源×GA3浸种时间互作对种子发芽率无显著影响(表1)。
2.3.1 种子来源和GA3浓度对托鲁巴姆种子发芽率的影响效应
显著性测定结果发现,10份来源不同的托鲁巴姆种子发芽率存在极显著差异,其中A7种子发芽率最高,A6种子发芽率最低,除了A1、A5、A10彼此间无显著差异外,其余不同来源的种子发芽率彼此间均存在极显著差异(表2)。GA3浓度对托鲁巴姆种子发芽率有显著影响,50~400 mg·L-1的GA3处理均可以极显著提高种子发芽率,其中100 mg·L-1GA3处理的发芽率显著低于200 mg·L-1和400 mg·L-1GA3处理(表3)。在GA3浸种12~60 h处理下,GA3浸种时间对托鲁巴姆种子发芽率无显著影响(表3)。
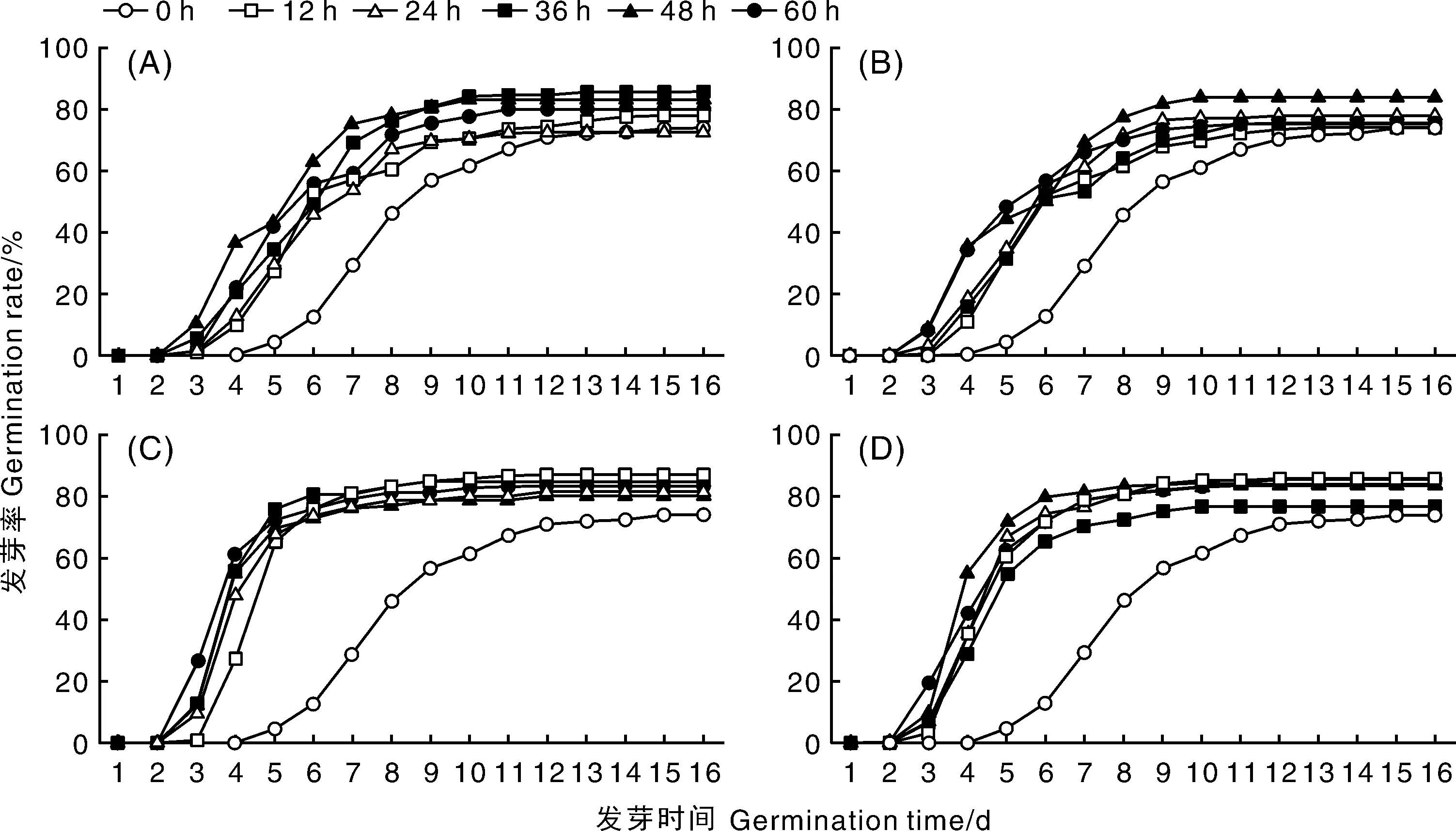
A、B、C、D分别表示种子经50、100、200、400 mg·L-1 GA3处理12、24、36、48、60 h,“0 h”表示未进行GA3处理。下同。A, B, C and D respresent the seeds treated by 50, 100, 200 and 400 mg·L-1 GA3 which soaked for 12, 24, 36, 48 and 60 h, respectively. 0 h respresents the seeds withou GA3 treatment. The same as below.图2 GA3处理对托鲁巴姆A1种子发芽进程的影响Fig.2 Effect of different GA3 concentrations on seed germination process of Solanum torvum A1
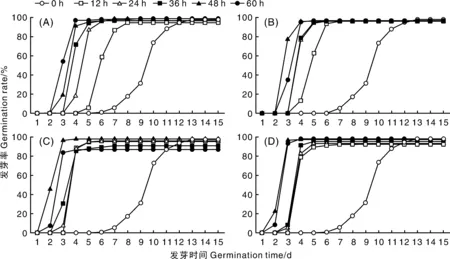
图3 GA3处理对托鲁巴姆A7种子发芽进程的影响Fig.3 Effect of different GA3 concentrations on seed germination process of Solanum torvum A7
表1托鲁巴姆种子发芽率与发芽指数方差分析
Table1Variance analysis of GR and GI inSolanumtorvum
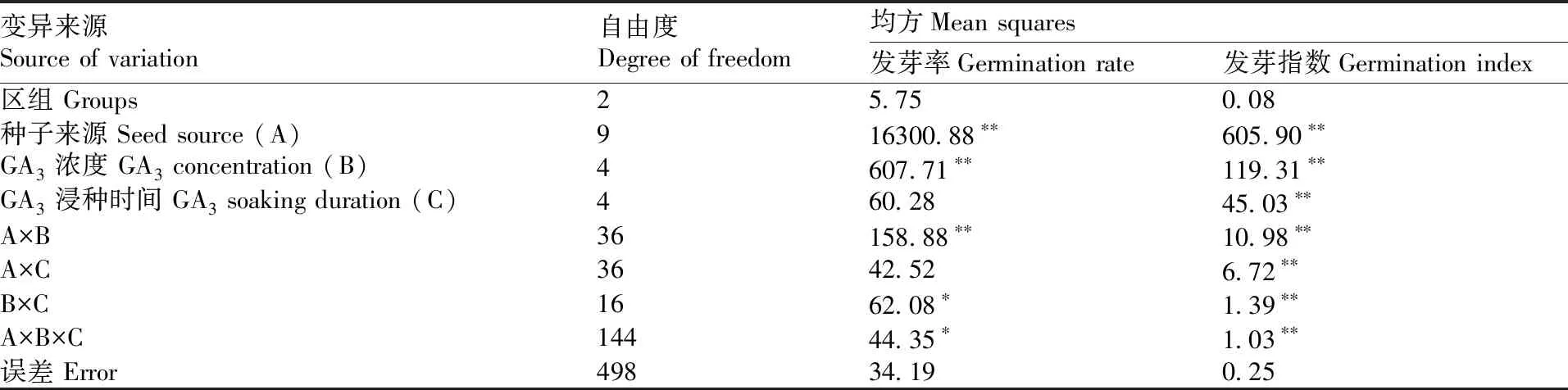
变异来源Source of variation自由度Degree of freedom均方Mean squares发芽率Germination rate发芽指数Germination index区组 Groups25.750.08种子来源 Seed source (A)916300.88∗∗605.90∗∗GA3浓度 GA3 concentration (B)4607.71∗∗119.31∗∗GA3浸种时间 GA3 soaking duration (C)460.2845.03∗∗A×B36158.88∗∗10.98∗∗A×C3642.526.72∗∗B×C1662.08∗1.39∗∗A×B×C14444.35∗1.03∗∗误差 Error49834.190.25
*和**分别表示F测验达显著(P<0.05)和极显著(P<0.01)水平。
* and ** indicated that the statistically significance was at 0.05 and 0.01 level byFtest, respectively.
2.3.2 种子来源、GA3处理浓度及GA3浸种时间对种子发芽率的互作效应
从表4可以看出,每一个GA3处理浓度(包括清水对照)下,不同来源的托鲁巴姆种子发芽率存在极显著差异,其中A7和A3发芽率最高,A6发芽率最低;随着GA3处理浓度的提高,种子发芽率总体呈上升态势,但只有A2、A8两份托鲁巴姆种子的发芽率在不同浓度GA3处理之间存在显著差异,其余8份托鲁巴姆种子发芽率并未因GA3处理而显著上升。
表2托鲁巴姆种子来源对种子发芽率和发芽指数的影响效应
Table2Seed GR and GI of different sources ofSolanumtorvumseeds
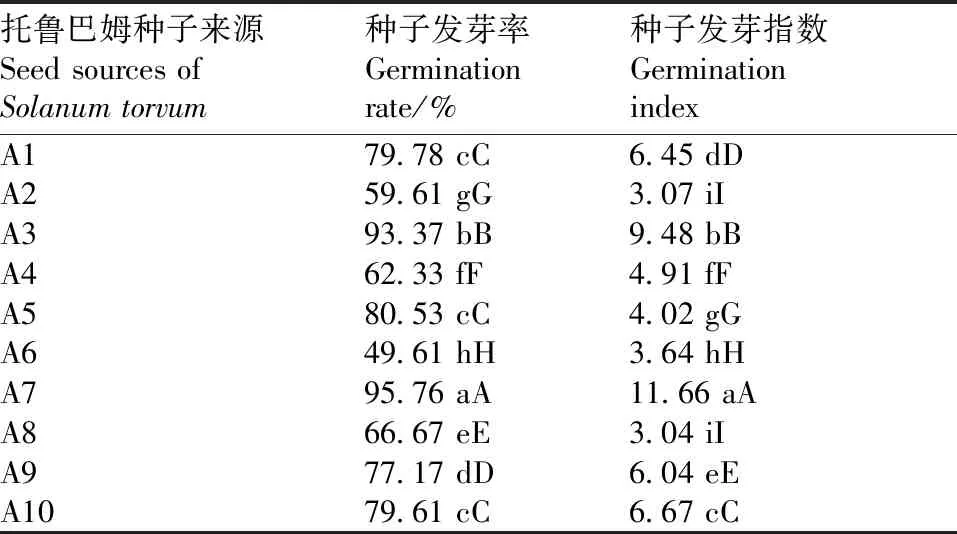
托鲁巴姆种子来源Seed sources ofSolanum torvum种子发芽率Germinationrate/%种子发芽指数GerminationindexA179.78 cC6.45 dDA259.61 gG3.07 iIA393.37 bB9.48 bBA462.33 fF4.91 fFA580.53 cC4.02 gGA649.61 hH3.64 hHA795.76 aA11.66 aAA866.67 eE3.04 iIA977.17 dD6.04 eEA1079.61 cC6.67 cC
同列数据后没有相同小写字母或大写字母分别表示差异达显著(P<0.05)或极显著(P<0.01)水平。下同。
The different lowercase and uppercase letters in the same column indicated the statistically significance was at 0.05 and 0.01 levels, respectively. The same as below.
表3GA3处理浓度和GA3处理时间对托鲁巴姆种子发芽率和发芽指数的影响效应
Table3Seed GR and GI as affected by GA3concentration and GA3soaking duration
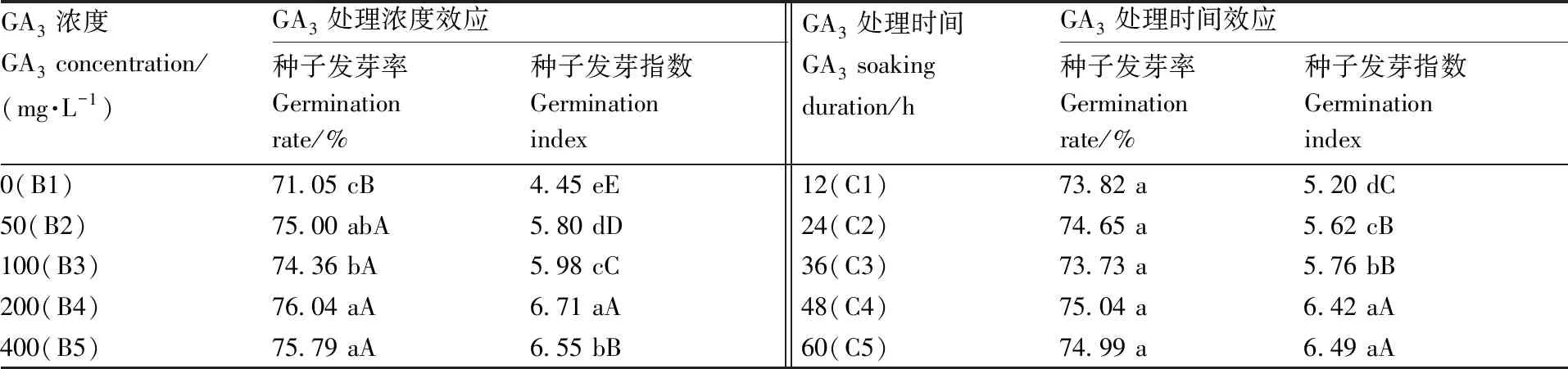
GA3浓度GA3 concentration/(mg·L-1)GA3处理浓度效应种子发芽率Germinationrate/%种子发芽指数GerminationindexGA3处理时间GA3 soakingduration/hGA3处理时间效应种子发芽率Germinationrate/%种子发芽指数Germinationindex0(B1)71.05 cB 4.45 eE12(C1)73.82 a5.20 dC50(B2)75.00 abA5.80 dD24(C2)74.65 a5.62 cB100(B3)74.36 bA 5.98 cC36(C3)73.73 a5.76 bB200(B4)76.04 aA 6.71 aA48(C4)75.04 a6.42 aA400(B5)75.79 aA 6.55 bB60(C5)74.99 a6.49 aA
另一方面,种子来源、GA3浓度与GA3浸种时间之间的二级互作显著(表1),表示每一个来源的托鲁巴姆种子均有最适宜的GA3处理浓度及GA3浸种时间。分析结果发现,A1、A2、A3、A4、A5、A6、A7、A8、A9、A10等10份托鲁巴姆种子最适宜的GA3处理浓度及GA3浸种时间依次为200 mg·L-112 h、400 mg·L-148 h、200 mg·L-136 h、50 mg·L-124 h(或200 mg·L-112 h)、200 mg·L-148 h、100 mg·L-124 h、50 mg·L-124 h、400 mg·L-124 h、200 mg·L-112 h和50 mg·L-148 h,对应的发芽率依次为87.33%、71.33%、97.33%、86.00%、59.00%、99.33%、77.33%、84.00%和87.33%。
2.4 GA3对种子发芽指数的影响
方差分析结果发现(表1),种子来源、GA3浓度、GA3浸种时间、种子来源×GA3浓度、种子来源×GA3浸种时间、GA3浓度×GA3浸种时间、种子来源×GA3浓度×GA3浸种时间对种子发芽指数均具有极显著的影响。
2.4.1 种子来源、GA3浓度及GA3浸种时间对托鲁巴姆发芽指数的影响效应
显著性测定结果发现,10份来源不同的托鲁巴姆种子的发芽指数存在极显著差异,其中A7种子发芽指数最大,A8种子发芽指数最小(表2)。GA3浓度对托鲁巴姆种子发芽指数有显著影响,GA3处理可以显著提高种子发芽指数,且随着GA3浓度的提高,种子发芽指数逐渐上升,并在200 mg·L-1时达到最高,之后显著下降(表3)。此外,随着GA3浸种时间的延长,种子发芽指数逐渐上升,但浸种48 h与浸种60 h之间无显著差异(表3)。
2.4.2 种子来源与GA3处理浓度对种子发芽指数的互作效应
从表5可以看出,每一个GA3处理浓度(包括清水对照)下,不同来源的托鲁巴姆种子的发芽指数存在极显著差异,在0~50 mg·L-1GA3处理浓度下,A3的发芽指数最高,A7其次;在100~400 mg·L-1的GA3处理时,A7的发芽指数最大,A3其次;在试验所及的GA3处理浓度范围内,A2和A8的发芽指数均处于最低水平。多数来源的托鲁巴姆种子的发芽指数随着GA3处理浓度的提高而呈上升趋势,处理浓度之间存在显著差异,而且种子发芽指数高的种子(如A3、A7)对GA3处理浓度较敏感,种子发芽指数较低的种子(如A2、A4、A5、A6、A8)对GA3处理浓度敏感性较低,其中A5的发芽指数在不同GA3处理浓度间均无显著差异。
表4种子来源与GA3处理浓度对托鲁巴姆种子发芽率的互作效应
Table4Interaction on seed GR between source ofSolanumtorvumseed and GA3concentration
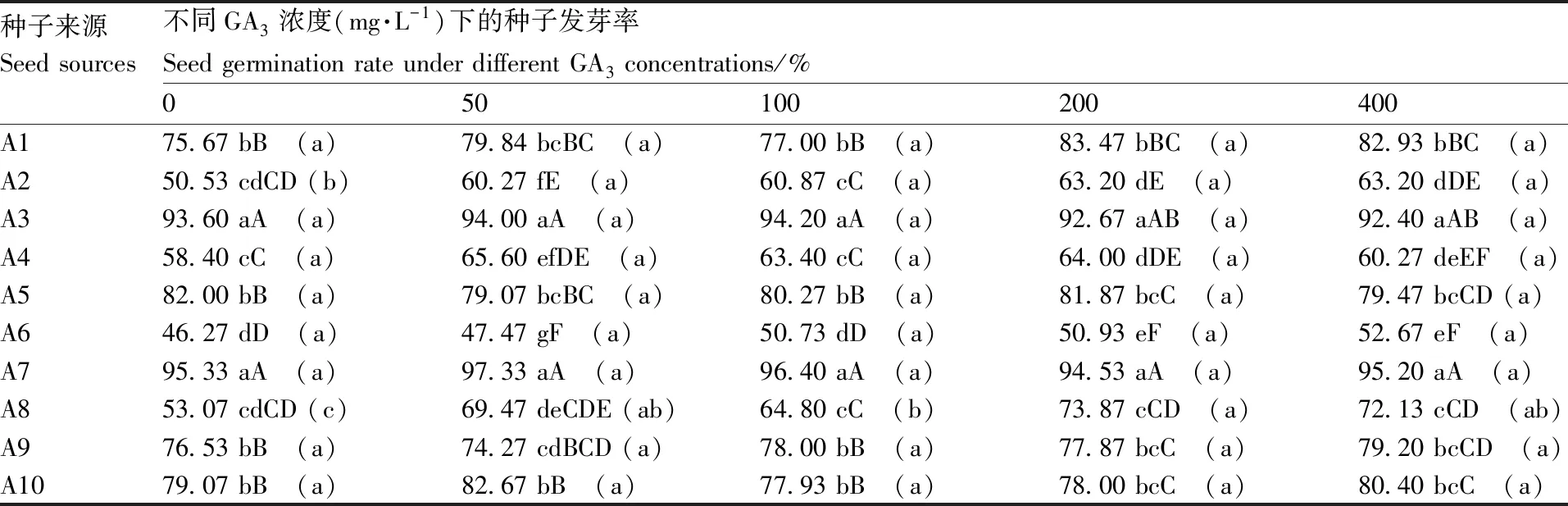
种子来源Seed sources不同GA3浓度(mg·L-1)下的种子发芽率Seed germination rate under different GA3 concentrations/%050100200400A175.67 bB (a)79.84 bcBC (a)77.00 bB (a)83.47 bBC (a)82.93 bBC (a)A250.53 cdCD (b)60.27 fE (a)60.87 cC (a)63.20 dE (a)63.20 dDE (a)A393.60 aA (a)94.00 aA (a)94.20 aA (a)92.67 aAB (a)92.40 aAB (a)A458.40 cC (a)65.60 efDE (a)63.40 cC (a)64.00 dDE (a)60.27 deEF (a)A582.00 bB (a)79.07 bcBC (a)80.27 bB (a)81.87 bcC (a)79.47 bcCD (a)A646.27 dD (a)47.47 gF (a)50.73 dD (a)50.93 eF (a)52.67 eF (a)A795.33 aA (a)97.33 aA (a)96.40 aA (a)94.53 aA (a)95.20 aA (a)A853.07 cdCD (c)69.47 deCDE (ab)64.80 cC (b)73.87 cCD (a)72.13 cCD (ab)A976.53 bB (a)74.27 cdBCD (a)78.00 bB (a)77.87 bcC (a)79.20 bcCD (a)A1079.07 bB (a)82.67 bB (a)77.93 bB (a)78.00 bcC (a)80.40 bcC (a)
括号内字母表示同一来源种子在不同GA3浓度间的差异显著性,具有相同字母表示差异未达到显著水平(P>0.05)。下同。
The different lowercase letters in brackets indicated the seed germination rate of the same seed source treated with various GA3concentrations were statistically significantly different at 0.05 levels. The same as below.
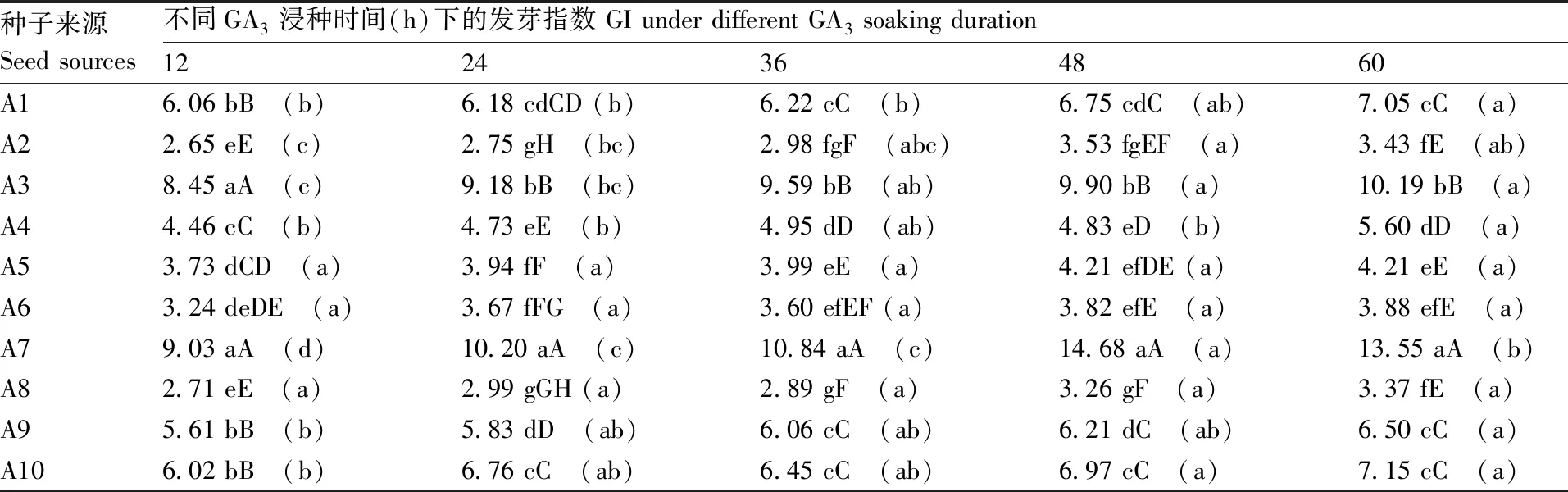
2.4.3 种子来源与GA3浸种时间对种子发芽指数的互作效应
多重比较显示(表6),在相同的GA3浸种时间条件下,不同来源的托鲁巴姆种子发芽指数存在极显著差异,其中A2、A8、A5发芽指数较低,而A3特别是A7发芽指数较高;就同一个来源的托鲁巴姆种子而言,随着GA3浸种时间的延长,种子发芽指数呈逐渐上升态势,但不同来源的托鲁巴姆种子对GA3浸种时间的响应不同,其中A3对GA3浸种时间的响应最为敏感,A5、A6、A8对GA3浸种时间的响应最不敏感。
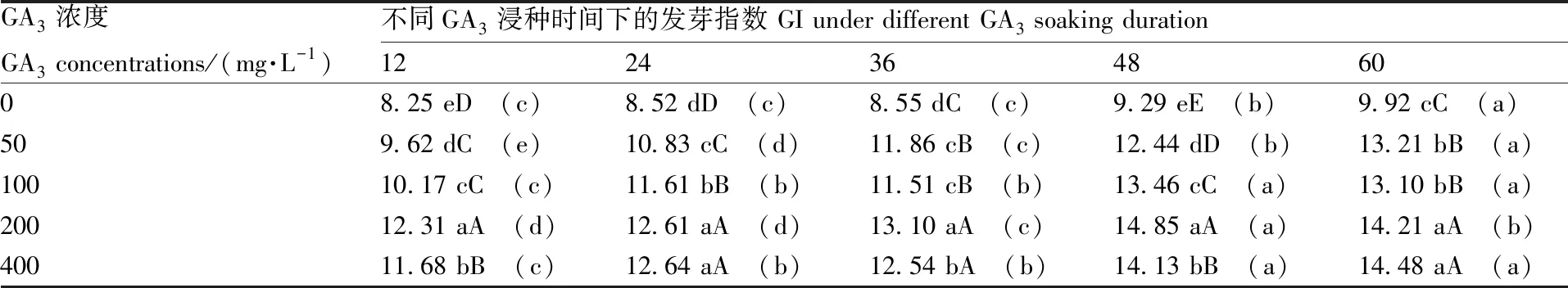
2.4.4 GA3浓度与GA3浸种时间对种子发芽指数的互作效应
多重比较结果发现,在相同GA3浸种时间下,不同GA3浓度对托鲁巴姆种子发芽指数有极显著的影响,且随着GA3浓度的提高,种子发芽指数基本呈上升趋势;在相同GA3浓度条件下,随着浸种时间的延长,种子发芽指数逐渐上升(表7)。
2.4.5 种子来源、GA3浓度及GA3浸种时间对种子发芽指数的二级互作效应
种子来源、GA3浓度与GA3浸种时间之间的二级互作达极显著水平(表1),表示在种子发芽指数方面,每一个来源的托鲁巴姆种子均有其最适宜的GA3处理浓度及GA3浸种时间。分析结果发现,A1、A2、A3、A4、A5、A6、A7、A8、A9、A10等10份托鲁巴姆最大种子发芽指数依次为8.39、4.01、11.36、6.10、4.73、4.78、20.22、3.98、7.22和8.45,其相应的GA3处理浓度及GA3浸种时间依次为200 mg·L-160 h、400 mg·L-148 h、100 mg·L-148 h、400 mg·L-160 h、200 mg·L-148 h、100 mg·L-148 h、200 mg·L-148 h、200 mg·L-160 h(或400 mg·L-160 h)、400 mg·L-136 h和200 mg·L-160 h。
表5种子来源与GA3处理浓度对托鲁巴姆种子发芽指数的互作效应
Table5Interaction on seed GI between source ofSolanumtorvumseed and GA3concentration
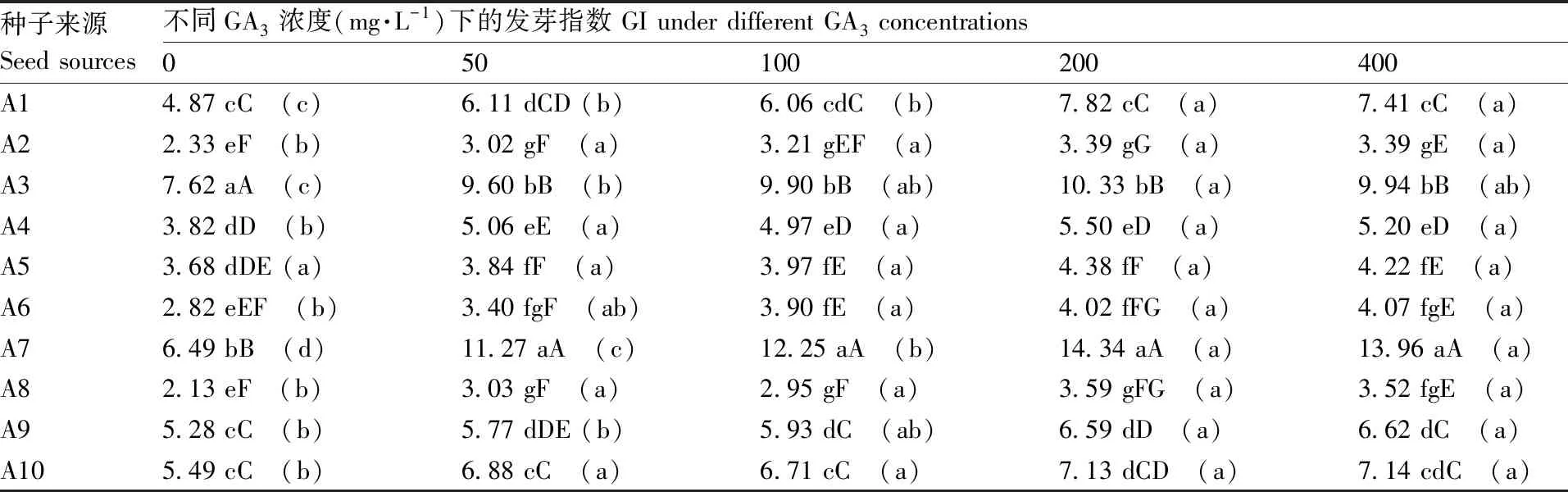
种子来源Seed sources不同GA3浓度(mg·L-1)下的发芽指数 GI under different GA3 concentrations050100200400A14.87 cC (c)6.11 dCD (b)6.06 cdC (b)7.82 cC (a)7.41 cC (a)A22.33 eF (b)3.02 gF (a)3.21 gEF (a)3.39 gG (a)3.39 gE (a)A37.62 aA (c)9.60 bB (b)9.90 bB (ab)10.33 bB (a)9.94 bB (ab)A43.82 dD (b)5.06 eE (a)4.97 eD (a)5.50 eD (a)5.20 eD (a)A53.68 dDE (a)3.84 fF (a)3.97 fE (a)4.38 fF (a)4.22 fE (a)A62.82 eEF (b)3.40 fgF (ab)3.90 fE (a)4.02 fFG (a)4.07 fgE (a)A76.49 bB (d)11.27 aA (c)12.25 aA (b)14.34 aA (a)13.96 aA (a)A82.13 eF (b)3.03 gF (a)2.95 gF (a)3.59 gFG (a)3.52 fgE (a)A95.28 cC (b)5.77 dDE (b)5.93 dC (ab)6.59 dD (a)6.62 dC (a)A105.49 cC (b)6.88 cC (a)6.71 cC (a)7.13 dCD (a)7.14 cdC (a)
表6种子来源与GA3浸种时间对托鲁巴姆种子发芽指数的互作效应
Table6Interaction on seed GI between source ofSolanumtorvumseed and GA3soaking duration
种子来源Seed sources不同GA3浸种时间(h)下的发芽指数 GI under different GA3 soaking duration1224364860A16.06 bB (b)6.18 cdCD (b)6.22 cC (b)6.75 cdC (ab)7.05 cC (a)A22.65 eE (c)2.75 gH (bc)2.98 fgF (abc)3.53 fgEF (a)3.43 fE (ab)A38.45 aA (c)9.18 bB (bc)9.59 bB (ab)9.90 bB (a)10.19 bB (a)A44.46 cC (b)4.73 eE (b)4.95 dD (ab)4.83 eD (b)5.60 dD (a)A53.73 dCD (a)3.94 fF (a)3.99 eE (a)4.21 efDE (a)4.21 eE (a)A63.24 deDE (a)3.67 fFG (a)3.60 efEF (a)3.82 efE (a)3.88 efE (a)A79.03 aA (d)10.20 aA (c)10.84 aA (c)14.68 aA (a)13.55 aA (b)A82.71 eE (a)2.99 gGH (a)2.89 gF (a)3.26 gF (a)3.37 fE (a)A95.61 bB (b)5.83 dD (ab)6.06 cC (ab)6.21 dC (ab)6.50 cC (a)A106.02 bB (b)6.76 cC (ab)6.45 cC (ab)6.97 cC (a)7.15 cC (a)
表7GA3浓度与GA3浸种时间对托鲁巴姆种子发芽指数的互作效应
Table7Interaction on seed GI between GA3concentration and GA3soaking duration
GA3浓度GA3 concentrations/(mg·L-1)不同GA3浸种时间下的发芽指数 GI under different GA3 soaking duration122436486008.25 eD (c)8.52 dD (c)8.55 dC (c)9.29 eE (b)9.92 cC (a)509.62 dC (e)10.83 cC (d)11.86 cB (c)12.44 dD (b)13.21 bB (a)10010.17 cC (c)11.61 bB (b)11.51 cB (b)13.46 cC (a)13.10 bB (a)20012.31 aA (d)12.61 aA (d)13.10 aA (c)14.85 aA (a)14.21 aA (b)40011.68 bB (c)12.64 aA (b)12.54 bA (b)14.13 bB (a)14.48 aA (a)
3 讨论
本试验结果表明,不同来源的托鲁巴姆种子发芽势和发芽率存在显著差异,在未经GA3处理条件下,A3和A7的发芽率达到90%以上(图1),说明并非所有的托鲁巴姆种子均需采用催芽措施。在50~400 mg·L-1,GA3处理对托鲁巴姆种子发芽有促进作用。但在促进种子发芽率方面,存在显著的种子来源与GA3处理浓度、GA3处理浓度与GA3浸种时间的一级互作效应以及种子来源、GA3浓度、GA3浸种时间的二级互作效应。在对种子发芽指数的影响上,不仅GA3浸种时间存在极显著差异,而且互作效应更为显著,包括种子来源与GA3浸种时间之间的互作。说明不同来源的托鲁巴姆种子宜采用不同的GA3浓度及浸种时间,以促进种子发芽。这或许就是许多报道结果不完全相同的原因[8,10-13,15]。
需要指出的是,种子发芽与温度关系非常密切,本试验以及相关文献的报道均是在较为适宜的温度条件下进行,这与茄子嫁接育苗过程中实际发芽温度存在一定差异。因此,适宜温度条件下的托鲁巴姆种子发芽率及发芽所需时间只能作为实际应用中的参考。同时,作者在试验中还发现不同来源的托鲁巴姆种子发芽后的幼苗生长速度存在差异,接种鉴定也发现不同来源的托鲁巴姆种子对黄萎病的抗性表现不同(数据待发表)。由此认为,在茄子嫁接育苗中需要筛选发芽率高、抗病性强的托鲁巴姆种源,而且对筛选的托鲁巴姆应该进行催芽试验及秧苗生长速度观察,从而确定适宜的砧木播种期、种子催芽条件(GA3处理浓度和浸种时间)。
