基于ASPEN PLUS的甲醇和苯烷基化反应热力学分析
2019-03-28冯志武郭旭青
冯志武, 胡 博, 郭旭青
(阳泉煤业化工集团有限责任公司,山西 太原 030021)
引 言
甲醇和苯是用途广泛的基础有机化工原料。近年来,随着煤化工的迅猛发展,我国甲醇和苯的产能迅速增加。到2017年,我国甲醇产能达到了7 855.5万t,但开工率在50%~60%,纯苯的产能达到了1 250万t/a,而总产量为510.41万t,甲醇和苯的产能严重过剩。因此,增加甲醇和苯下游衍生物的需求是化解产能过剩的有效途径。甲醇和苯烷基化反应得到的混合芳烃广泛应用于炼油、乙烯、对二甲苯(PX)、精对苯二甲酸(PTA)、聚酯(PET)、合成纤维、塑料加工等领域,是重要的化工原料,其下游产品广泛应用于高端合成材料、有机原料及各种中间体的制造[1],而我国的混合芳烃主要依赖进口,近年来进口量超过1 000万t。因此,甲醇与苯烷基化制备混合芳烃可以延长甲醇和苯的产业链,能有效地化解甲醇和苯的过剩产能[2-3]。
甲醇和苯烷基化反应可能的副反应很多,徐亚荣等[4]研究了甲醇和苯烷基化反应在标准压力下,不同反应温度时主副反应的反应焓、反应熵、反应吉布斯自由能变、平衡常数和各产物的平衡关系。甲醇和苯烷基化反应温度一般控制在633 K~773 K,本文在徐亚荣等的研究基础上,利用ASPEN PLUS软件计算了在713 K时不同反应压力下主副反应的反应焓、反应熵、反应吉布斯自由能变、平衡常数和各产物的平衡关系,为该反应提供了非标准压力下的热力学依据。
1 甲醇和苯烷基化反应及ASPEN PLUS热力学数据计算
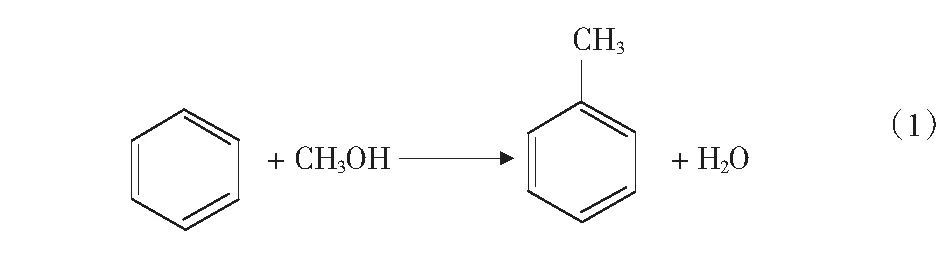
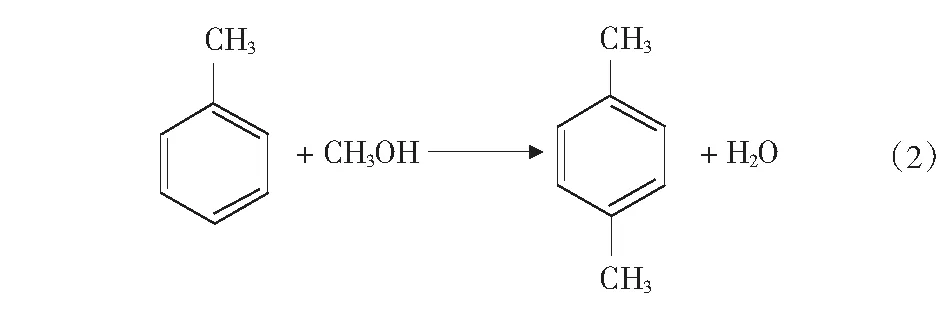
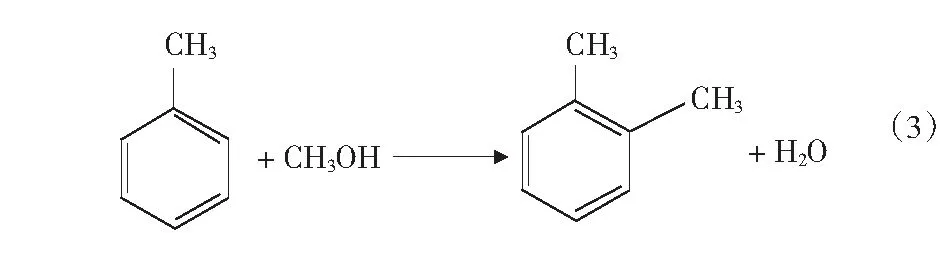
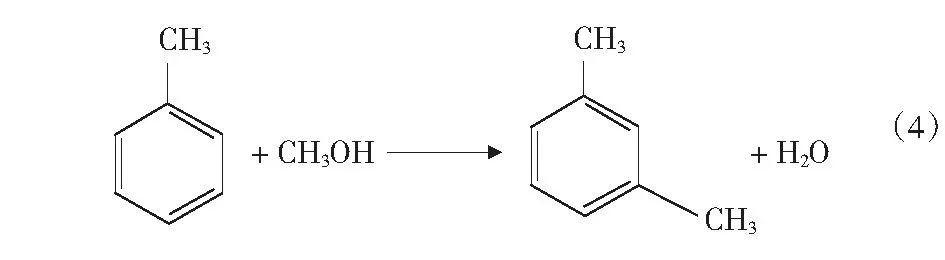
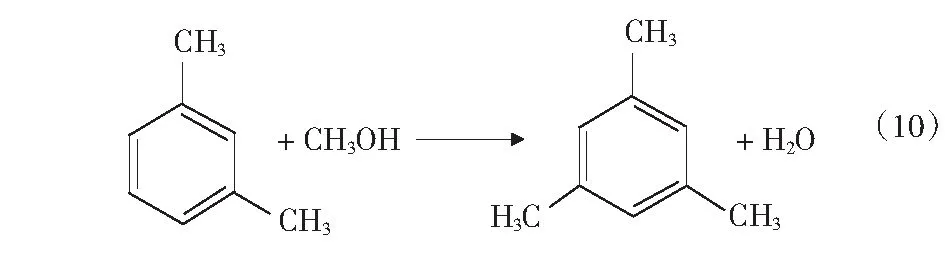
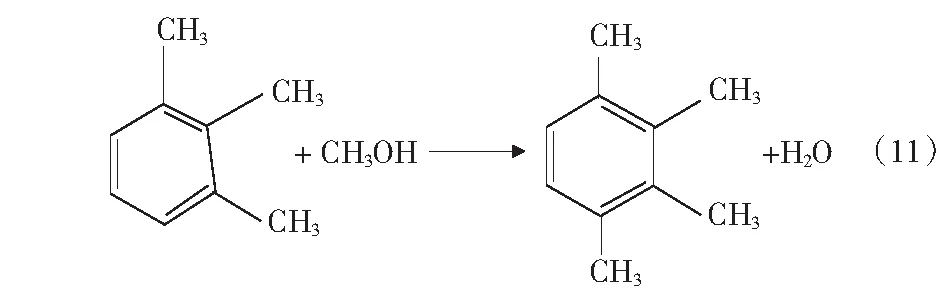
根据文献[4]中报道,甲醇和苯烷基化反应除了生成甲苯和二甲苯的主反应外,还可能存在分解反应、加氢反应、烷烃裂解反应等,整个反应过程中可能的主副反应如式(1)-式(4)及第17页式(5)-式(17)。
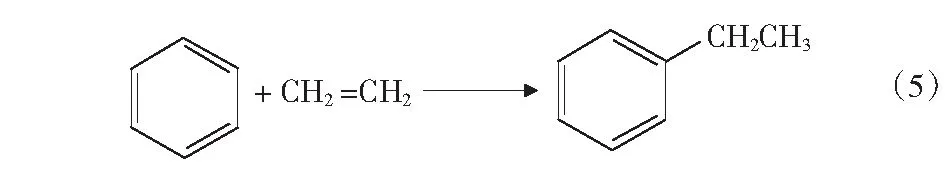

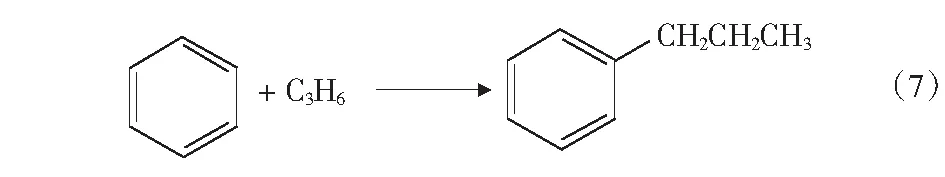
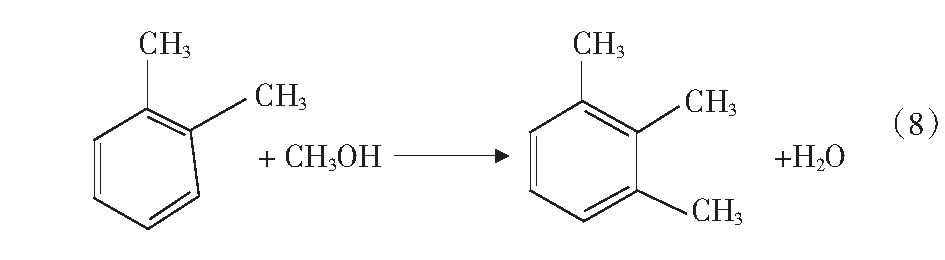
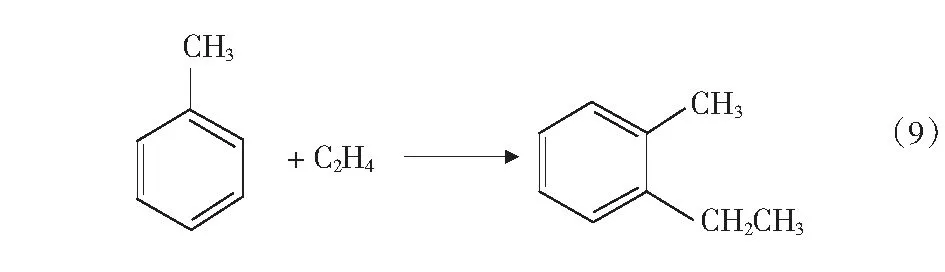
2CH3OHCH3OCH3+H2O
(12)

(13)

(14)

(15)

(16)

(17)
利用ASPEN PLUS软件对纯组分的物性分析功能,分别计算反应体系中各物质在713 K时不同压力下的摩尔生成焓、摩尔熵、摩尔吉布斯自由能。甲醇和苯烷基化的物系是弱极性非电解质体系,PR-BM方程适用于所有温度、压力下非极性或者极性较弱的体系,适合此物系。因此,选择PR-BM方程作为此次热力学计算的物性方法[5]。化学反应焓变、反应熵变、反应吉布斯自由能变、平衡常数由公式(1)-式(5)公式计算。
ΔrHm=∑BμBHm
(1)
ΔrSm=∑BμBSm
(2)
ΔrGm=∑BμBGm
(3)
Kp=exp(-ΔrGm/RT)
(4)
R=8.314 J/(mol·K)
(5)
式中:μB为物质组分B对应的化学计量数,产物为正数,反应物为负数。
利用ASPEN PLUS计算得到的该反应体系在713 K时不同压力下的热力学性质如表1及第18页表2-表3所示。

表1 713 K时不同压力下的摩尔生成焓
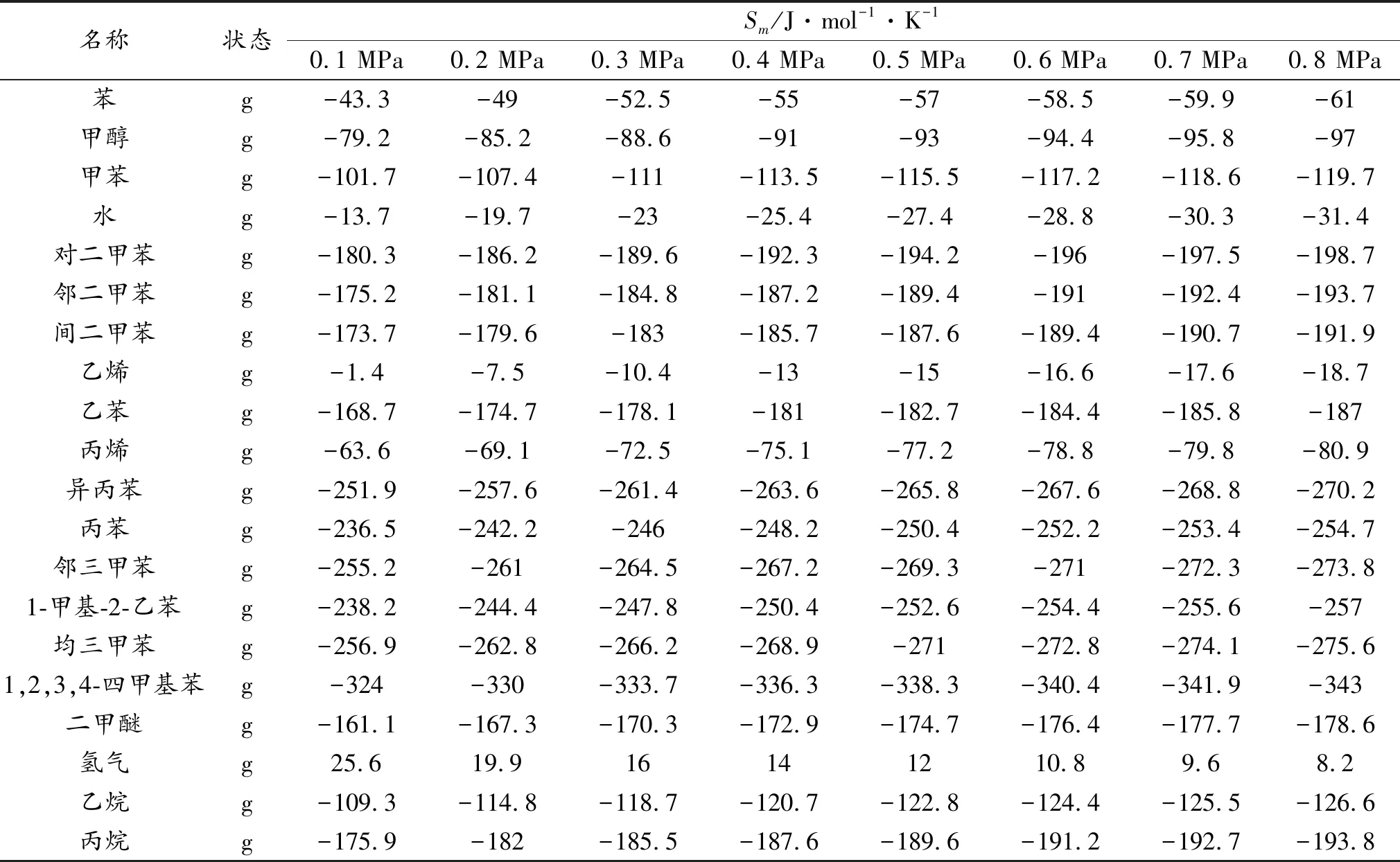
表2 713 K时不同压力下的摩尔熵
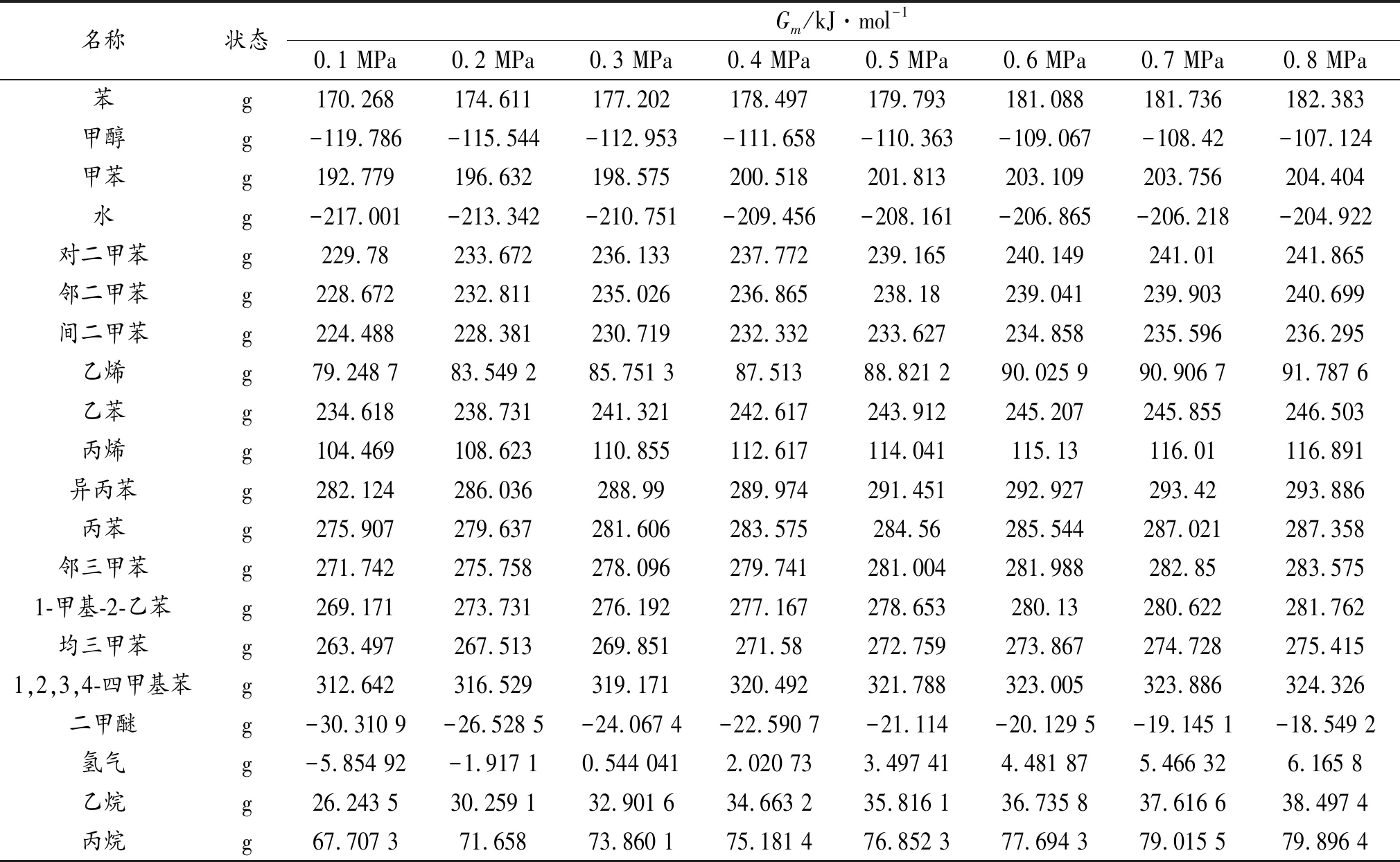
表3 713 K时不同压力下的摩尔吉布斯自由能
表1~表3中非标准状态下的热力学数据均由ASPEN PLUS软件使用针对真实气体的PR-BM方程直接计算得到,不仅可以使计算结果更接近实际反应状况,而且大大减少了人工计算量。
2 甲醇和苯烷基化反应焓变
利用公式(1)计算各个反应在713 K时,0.1 MPa~0.8 MPa的反应焓变,结果如表4所示。

表4 713 K时不同压力下的反应焓变
由表4可以看出,随着压力的变化,该体系各反应的焓变变化不大,当反应温度一定时,可以把该体系的反应焓变当作常数。该体系的主副反应均为放热反应,当反应启动后,可以依靠反应体系放出的热量维持反应的进行。
3 甲醇和苯烷基化反应熵变
利用公式(2)计算各个反应在713 K时,0.1 MPa~0.8 MPa的反应熵变,结果如表5所示。
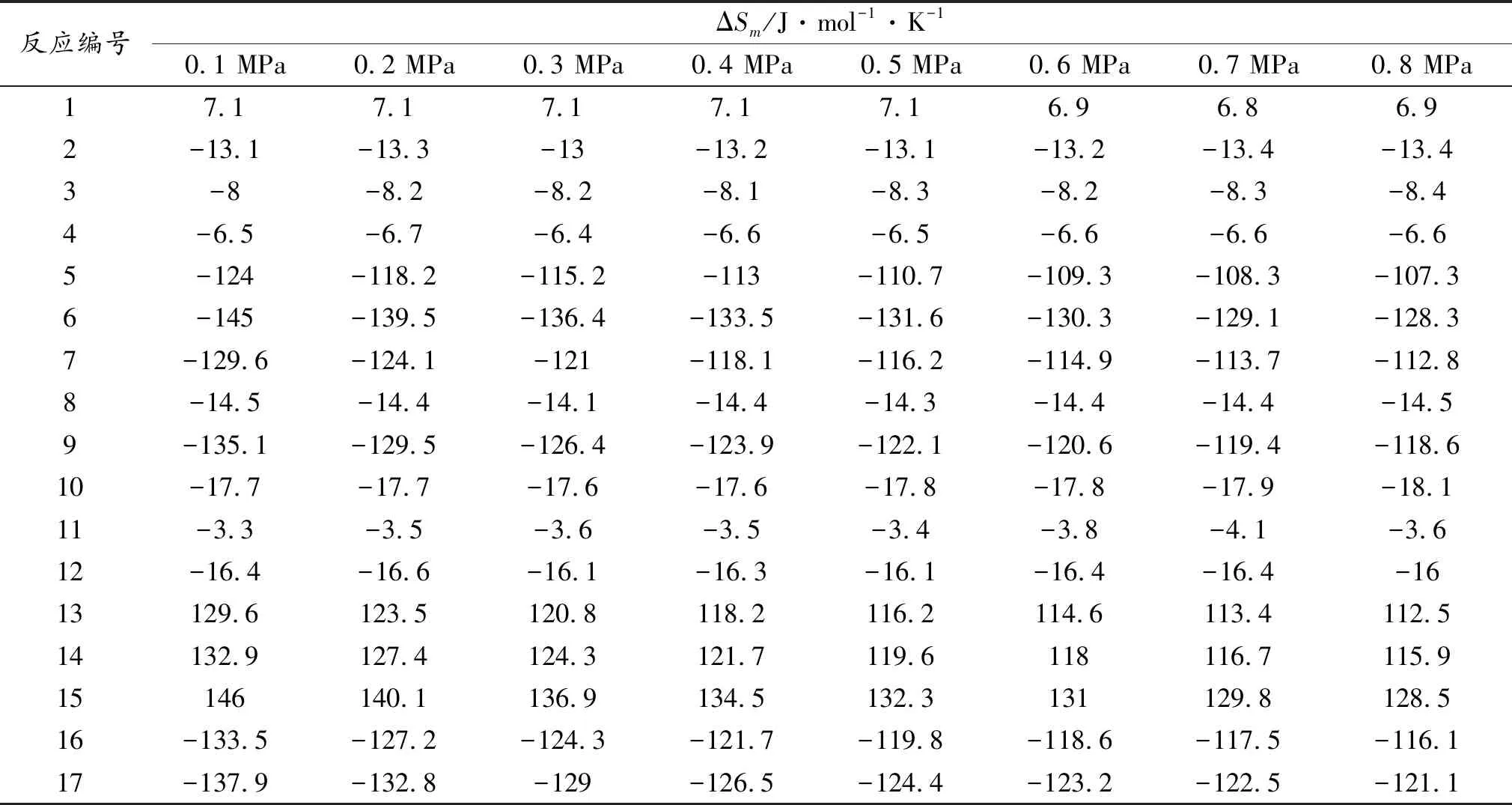
表5 713 K时不同压力下的反应熵变
由表5可以看出,该反应体系的反应熵受压力的影响不大,除反应(1)为熵增反应外,其余反应均为熵减反应。
4 甲醇和苯烷基化反应吉布斯自由能变
利用公式(3)计算各个反应在713 K时,0.1 MPa~0.8 MPa的反应吉布斯自由能变,结果如表6所示。
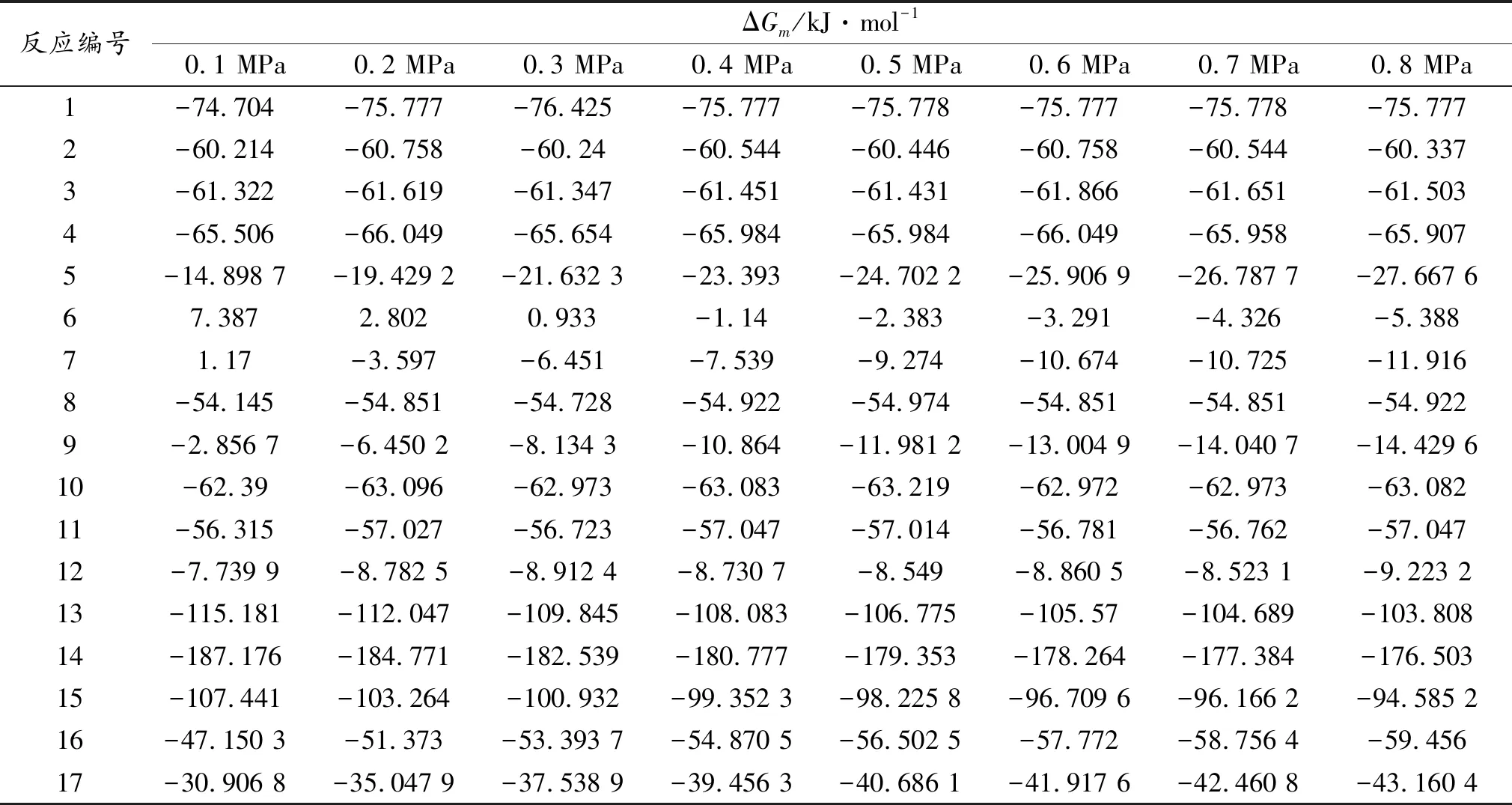
表6 713 K时不同压力下的反应吉布斯自用能变
由表6可以看出,主反应(1)~反应(4)的反应吉布斯自由能变随压力的变化不大,且均可自发进行。而生成乙苯、丙苯、异丙苯、1-甲基-2-乙苯及二甲醚的反应吉布斯自由能变大于-40 kJ·mol-1,说明反应进行得不完全[6],其中,反应6、反应7在压力较低时,反应吉布斯自由能变为正,说明此压力下反应不能进行。
5 甲醇和苯烷基化反应平衡常数
利用公式(4)计算各个反应在713 K时,0.1 MPa~0.8 MPa的反应平衡常数,结果如表7所示。
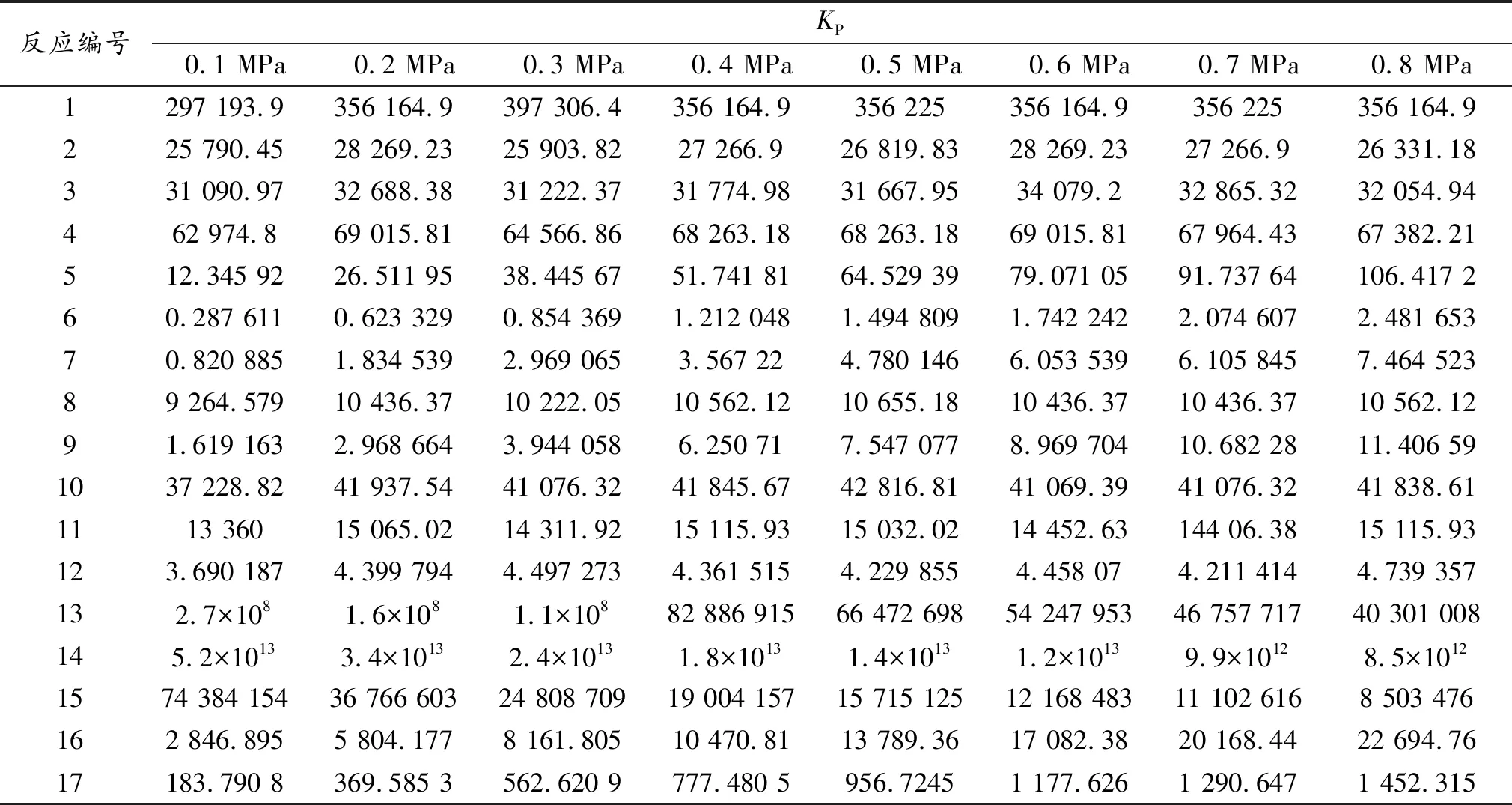
表7 713 K时不同压力下的反应平衡常数
根据文献[6]报道,当平衡常数KP<850时,反应不大可能进行,当KP<105时反应进行得不完全,为可逆反应。从表7可以看到,反应1的平衡常数KP>105,说明该反应进行得很彻底,为不可逆反应,而反应2~反应4的平衡常数KP<105,说明生成二甲苯的反应均为可逆反应。反应(5)~反应(7)、反应(9)、反应(12)的平衡常数KP均远小于850,因此,在该反应体系中这些反应很可能不存在,反应(15)是以二甲醚为原料,而反应体系中的二甲醚来源于反应(12),因此反应(15)也可能不存在。反应(13)和反应(14)的平衡常数KP远大于主反应(1)-(4),说明这2个反应的反应程度高于主反应(1)-(4),该体系中作为原料的甲醇并没有全部参与烷基化反应,而是一部分发生了自脱水反应生成了乙烯和丙烯。
6 结论
1) 利用ASPEN PLUS软件的纯组分物性分析计算非标准状态的热力学数据时可以大大减少人工计算量。
2) 甲醇和苯烷基化反应的反应焓变、反应熵变和反应吉布斯自由能变随压力变化不大,温度一定时,该体系中每个反应的热力学数据均可当作常数。
3) 该体系的主、副反应均为放热反应,启动反应后,可以依靠反应体系放出的热量维持反应进行。
4) 从平衡常数的角度看,该反应体系中生成乙苯、丙苯、异丙苯、二甲醚的反应很可能不会进行。甲醇作为原料并没有全部参与烷基化反应,而是一部分发生了脱水反应生成了乙烯和丙烯。
