红鳍东方鱼皮胶原低聚肽螯合钙工艺优化
2019-03-28刘英
, ,,,, ,刘英,*
(1.河北农业大学食品科技学院,河北保定 071000; 2.河北农业大学海洋学院,河北秦皇岛 066000)
红鳍东方鲀肉质鲜美,是典型的高蛋白低脂肪的鱼类,营养价值很高。近年来,随着人工繁殖河豚技术的发展和苗种的成功培育,我国的红鳍东方鲀达到了无毒级,红鳍东方鲀成为了我国最大的养殖河豚鱼种之一[1]。胶原蛋白肽具有抗氧化、促进伤口愈合、降血压以及美白补水等多种生理功效[2-5],有研究指出,河豚鱼皮中的胶原蛋白含量占总蛋白含量的90%左右[6],含量丰富,如果能充分利用其胶原蛋白含量高这一特性,对鱼皮进行深加工,不仅能提高其利用价值,获得良好的经济效益,还能减少浪费,避免环境污染。
钙主要是以磷酸钙的形式存在于人体的骨骼中,目前市场上的补钙产品主要有碳酸钙、乳酸钙、葡萄糖酸钙等,人体对这种电离钙的吸收率较低,且如果补充电离钙过度会影响人体健康,如出现便秘、胀气、腹胀的不良反应等[7]。胶原蛋白肽螯合钙有望能克服电离钙的缺点:低浓度水平下的低吸收率和生物利用率以及高浓度水平下的生物毒性[8]。研究表明,人体对钙的吸收是通过小肠刷状缘分泌的氨基酸和小肽与Ca2+螯合成氨基酸或肽螯合物被小肠吸收进入人体[9-11],胶原蛋白肽能刺激软骨细胞合成胶原蛋白并影响胶原在骨关节中的转化,因此胶原蛋白肽螯合钙不仅促进人体对钙的吸收,还能发挥出胶原蛋白肽的功效[12-13]。梁春辉等[14]比较了胶原多肽螯合钙、葡糖糖酸钙和碳酸钙对小鼠的壮骨作用,发现胶原蛋白肽螯合钙对小鼠壮骨作用最为显著。目前已经有从鳕鱼皮、白鲢鱼骨、牡蛎、罗非鱼皮、鱼鳞、猪皮、牛骨等中提取的胶原蛋白进行金属螯合的报道以及各种氨基酸螯合金属的研究[15-22]。从河豚鱼皮提取胶原寡肽的研究较少,目前没有关于河豚鱼皮胶原寡肽螯合钙的报道。
本研究以红鳍东方鲀鱼皮为原料,分析了反应pH、肽钙质量比、反应时间、反应温度及胶原蛋白小肽浓度这五个因素对螯合率的影响,选取对螯合率影响最显著的三个因素进行响应面优化,确定出最佳工艺条件,并通过红外光谱、紫外扫描对螯合物进行了结构分析。
1 材料与方法
1.1 材料与仪器
红鳍东方鲀鱼皮 秦皇岛;酸性蛋白酶 北京奥博星生物技术有限责任公司;氯化钙 天津市科密欧化学试剂有限公司;氢氧化钾、硫化钠 天津市欧博凯化工有限公司;柠檬酸钠 天津市凯通化学试剂有限公司;钙试剂 天津市致远化学试剂有限公司;分子量不同的胶原蛋白肽 实验室自制。
TGL-18M离心机 上海卢湘仪器有限公司;pH-3C pH计 上海精科有限公司;UV-1700PC紫外可见分光光度计 上海美析仪器有限公司;IRAffinity-1S傅里叶红外检测器 岛津有限公司。
1.2 实验方法
1.2.1 胶原蛋白肽的制备 绞碎后的鱼皮经过前处理,在60 ℃水浴中提取6 h,纱布过滤除去鱼皮,冷冻干燥得到胶原蛋白。在料液比1∶40 g/mL,加酶量5%,pH3的条件下利用酸性蛋白酶酶解3 h,100 ℃水浴灭酶活,7000 r/min离心得上清液,经超滤得到不同分子质量范围的胶原蛋白肽。
1.2.2 胶原低聚肽螯合钙制备方法 取适量胶原蛋白肽溶于水中,0.1 mol/L的盐酸和0.1 mol/L NaOH调pH,加入适量的氯化钙,控温螯合,9倍体积的无水乙醇沉淀,沉淀20 min,7000 r/min离心10 min,去上清液,乙醇反复多次冲洗沉淀,真空冷冻干燥。
1.2.3 螯合率的测定 参照GB/T 5009.92-2016中的EDTA滴定法测定胶原低聚肽螯合钙中的钙含量。
取2 mL反应液加入18 mL无水乙醇,取1 mL溶液测定其钙含量,离心后取1 mL上清液测其中的钙含量。按照下式计算螯合率。
螯合率(%)=(反应液中钙含量-上清液中钙含量)/反应液中钙含量×100
1.2.4 最适分子质量的胶原蛋白肽的筛选 Mr<1 kDa、1 kDa
1.2.5 单因素实验 实验考察了胶原低聚肽浓度、pH、反应时间、反应温度、肽钙质量比五个反应因素对该实验的影响。
1.2.5.1 胶原低聚肽浓度对螯合率的影响 在反应温度为50 ℃,反应时间50 min,肽钙质量比为5∶1,反应pH为7的条件下对胶原蛋白低聚肽浓度分别为10、20、30、40、50、60 mg/mL的条件下进行单因素实验,以螯合率为指标确定出最佳胶原蛋白肽浓度。
1.2.5.2 反应时间对螯合率的影响 设定反应温度为50 ℃,肽钙质量比为5∶1,胶原低聚肽浓度为40 mg/mL,分别控制反应时间为10、30、50、70、90 min,以螯合率为指标确定最佳反应时间。
1.2.5.3 反应温度对螯合率的影响 在反应时间50 min,肽钙质量比为5∶1,反应pH为9,胶原低聚肽浓度为40 mg/mL的条件下控制反应温度为35、40、45、50、55、60 ℃进行单因素实验,以螯合率为指标确定最佳反应温度。
1.2.5.4 pH对螯合率的影响 设定反应温度为50 ℃,反应时间50 min,肽钙质量比为5∶1,胶原低聚肽浓度为40 mg/mL,分别在pH为5、6、7、8、9、10、11进行实验,以螯合率为指标,确定出最佳pH。
1.2.5.5 肽钙质量比对螯合率的影响 设定反应温度为45 ℃,反应时间50 min,反应pH为9,胶原低聚肽浓度为40 mg/mL的条件下控制肽钙质量比分别为1∶3、1∶1、3∶1、5∶1、10∶1、15∶1、20∶1、25∶1、30∶1、35∶1进行单因素实验,以螯合率为指标确定最佳肽钙质量比反应条件。
1.2.6 响应面优化试验 在单因素实验的基础上按照Box-Behnken 中心组合设计原理对此工艺进一步优化,响应面编码设计见表1。
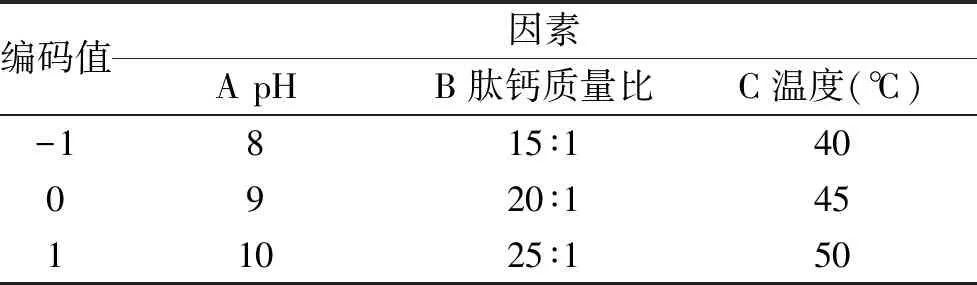
表1 中心组合实验因素水平表Table 1 Factors and levels table of Center combination of experiment
1.2.7 胶原低聚肽螯合钙的紫外检测分析 将胶原低聚肽和胶原低聚肽螯合钙分别配制成浓度为2 mg/mL的样品,用紫外分光光度计在波长为200~400 nm的范围内进行紫外扫描。
1.2.8 胶原低聚肽螯合钙的红外光谱分析 将胶原低聚肽和胶原蛋白低聚肽螯合钙分别于干燥的KBr按照一定的比例进行混合、研磨、压片,利用傅里叶红外光谱仪在4000~500 cm-1的范围内进行扫描得到红外光谱图。
1.3 数据分析
本试验应用excel软件绘制折线图,应用Design-expert. V8.0.6软件进行响应面设计和数据分析。
2 结果与分析
2.1 不同肽段螯合钙的螯合率
分子量较小的胶原蛋白肽能暴露出更多的基团与钙离子发生螯合反应,由图1可知,分子量小于1 kDa的肽与钙的螯合效果最好,螯合率达到50.52%,远远高于其他分子量的肽段,因此选择分子量小于1 kDa的胶原低聚肽进行螯合钙的试验。
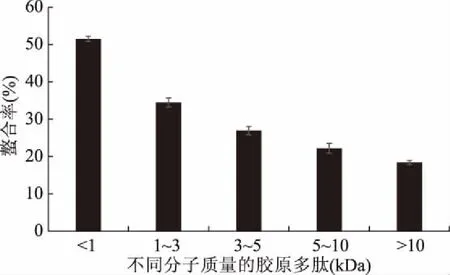
图1 不同分子量的胶原蛋白肽与钙的螯合情况Fig.1 Chelating rate of different molecular weight collagen peptides with calcium
2.2 胶原蛋白肽螯合钙单因素实验
2.2.1 胶原低聚肽浓度对螯合率的影响 由图2可知,随着胶原低聚肽浓度的升高,螯合率呈现先上升后下降的趋势,并在胶原低聚肽浓度为40 mg/mL时达到最大。当胶原低聚肽浓度较小时,溶液中的肽含量较少,不能与大量的钙离子充分结合,当胶原低聚肽浓度增加到一定值时,肽含量达到饱和,胶原低聚肽中的-NH+和-COO-与钙离子螯合时会产生竞争,使肽与钙离子的配位降低,螯合率下降。因此选择40 mg/mL的胶原低聚肽为最佳螯合浓度。
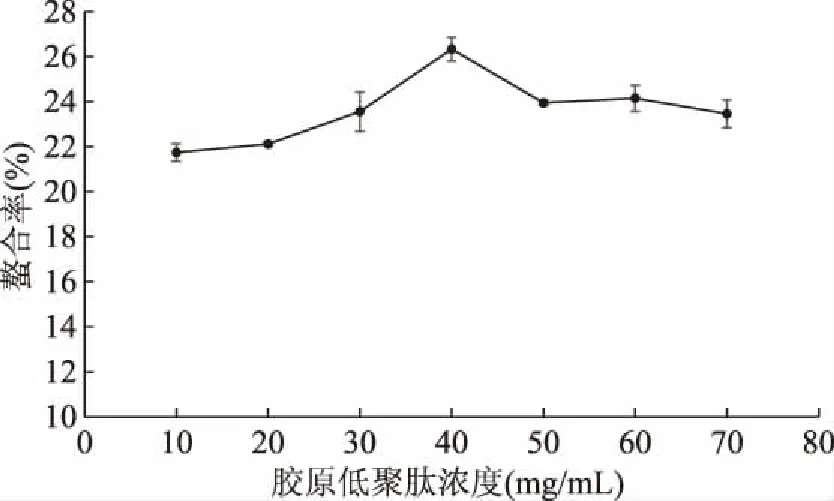
图2 胶原低聚肽浓度对螯合率的影响Fig.2 Effect of collagen peptide concentration on chelating rate
2.2.2 反应时间对螯合率的影响 由图3所知,在所选择的时间段内螯合率变化较小,可见时间对胶原低聚肽和钙离子的螯合效果影响较小。因此,响应面试验中不再研究时间对胶原低聚肽和钙离子螯合反应的影响。
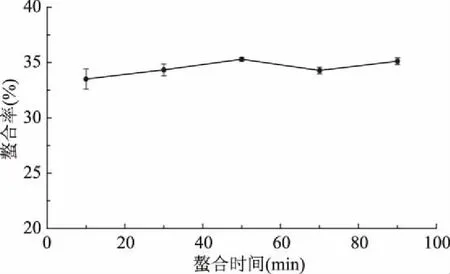
图3 时间对螯合率的影响Fig.3 Effect of time on chelating rate
2.2.3 反应温度对螯合率的影响 由图4可以看出,肽钙螯合率随着反应温度的变化呈现先上升后下降的趋势,在45 ℃达到最大值。随着反应温度的升高,分子间的运动加剧,碰撞几率增大有利于螯合反应的进行,而当温度继续升高,对多肽的性质有一定影响,并且温度较高,螯合物不稳定易分解,使螯合率降低[23]。因此最适反应温度为45 ℃。

图4 反应温度对螯合率的影响Fig.4 Effect of reaction temperature on chelating rate
2.2.4 pH对螯和率的影响 当pH较低时,溶液中的H+含量较高,会影响肽中的-COOH电离,同时较多的H+会和Ca2+争夺供电子基团-COO-,使螯合率降低。在pH到达9~10时,溶液处于偏碱状态,OH-较多,有利于-COOH的电离生成H+,以及-NH2和OH-发生反应生成-NH-,从而有利于和钙离子的螯合[24],当pH继续上升,溶液中的OH-会和低聚肽供电子集团争夺Ca2+,生成Ca(OH)2,不利用螯合反应。因此最适反应pH为10。
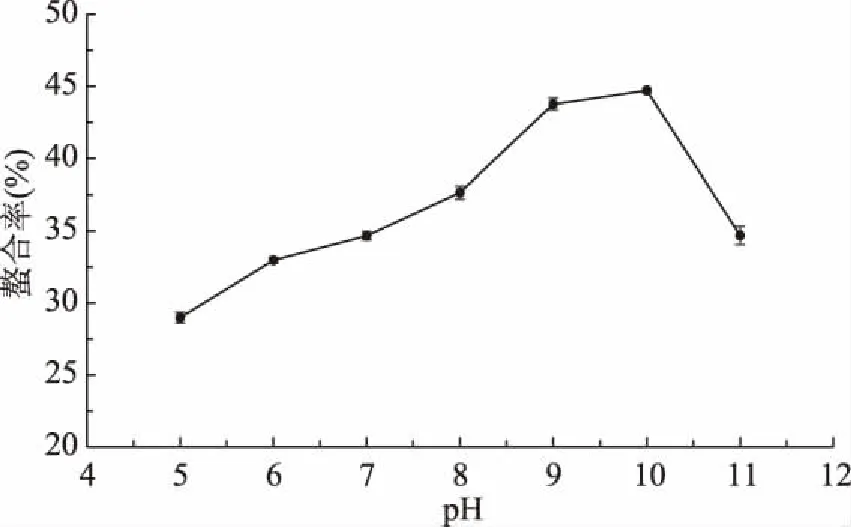
图5 pH对螯合率的影响Fig.5 Effect of pH on chelating rate
2.2.5 肽钙质量比对螯合率的影响 由图6可见,肽钙质量比是影响肽钙螯合率的一个重要因素,随着肽钙质量比的提高,螯合率也呈上升趋势,在质量比为25∶1之后,螯合率趋于平缓。若肽钙质量比过小,则氯化钙添加过量,没有足够的基团和钙离子络合,螯合率较低;若肽钙质量比过大,则氯化钙添加量小,螯合反应不完全,浪费胶原低聚肽。螯合率相似时,氯化钙添加量越少,胶原低聚肽螯合钙产物中钙含量越低,所以本试验选择15∶1、20∶1、25∶1三个水平的质量比进行响应面试验。

图6 肽钙质量比对螯合率的影响Fig.6 Effect of peptide-calcium mass ratio on chelation rate
2.2 响应面设计试验结果及分析
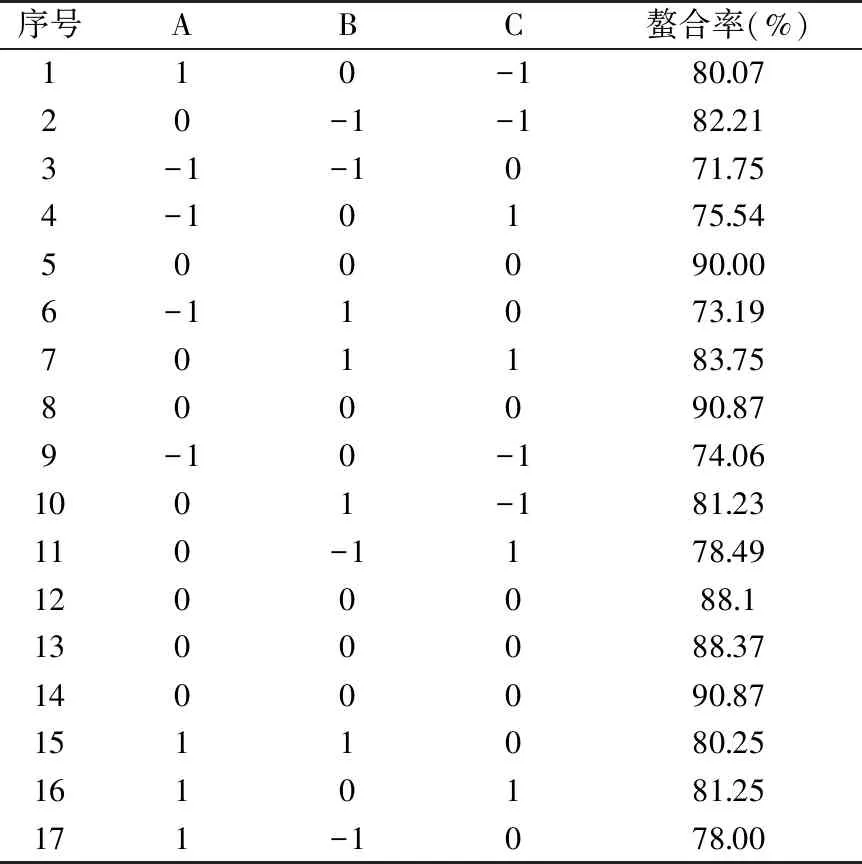
表2 响应面分析设计及结果Table 2 Design and results of response surface analysis
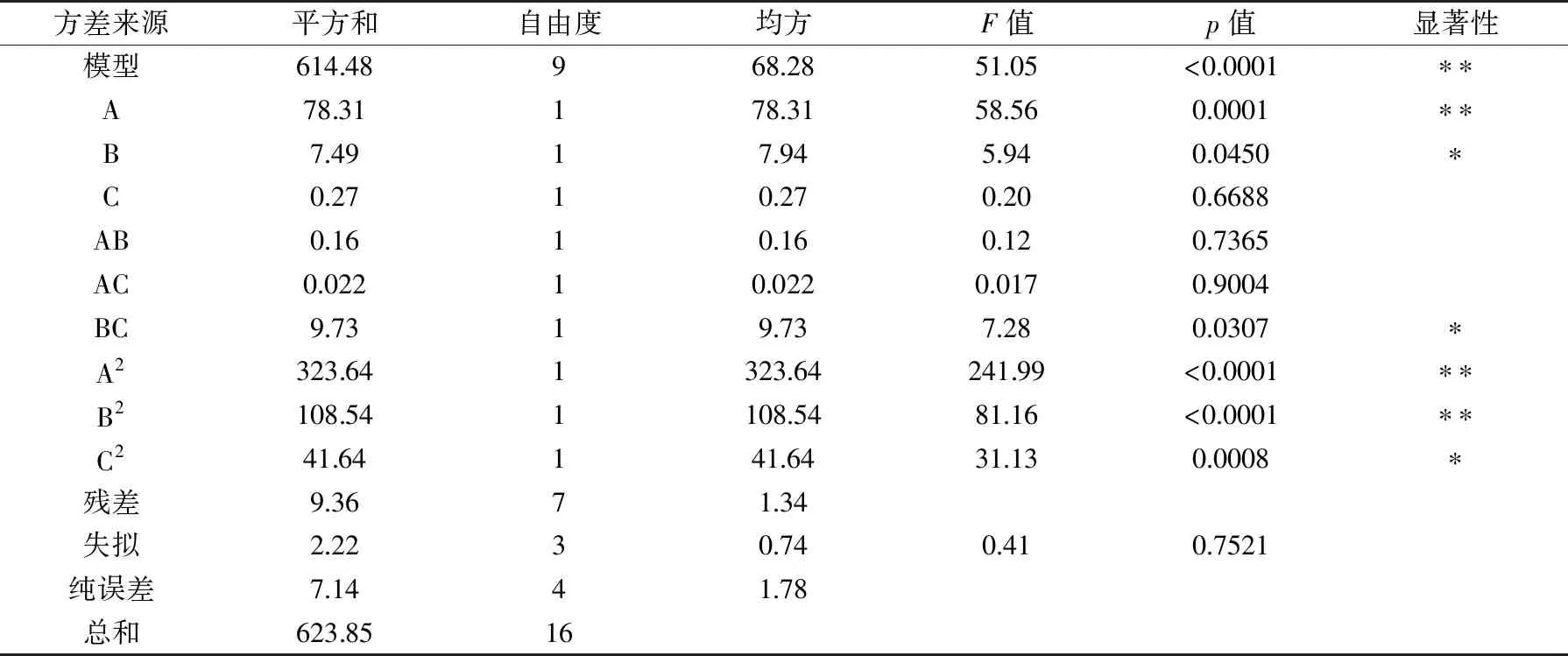
表3 方差分析结果Table 3 Results of variance analysis
等高线的形状可以反映两因素间交互作用的强弱,椭圆形表示两因素间交互作用较强,圆形则表示较弱[25]。同时,等高线越稠密,说明此因素对肽钙螯合率的影响较强,越稀疏,说明该因素对肽钙螯合率的影响越弱。图7可以得出,温度和肽钙质量比的等高线呈椭圆形,交互作用显著。
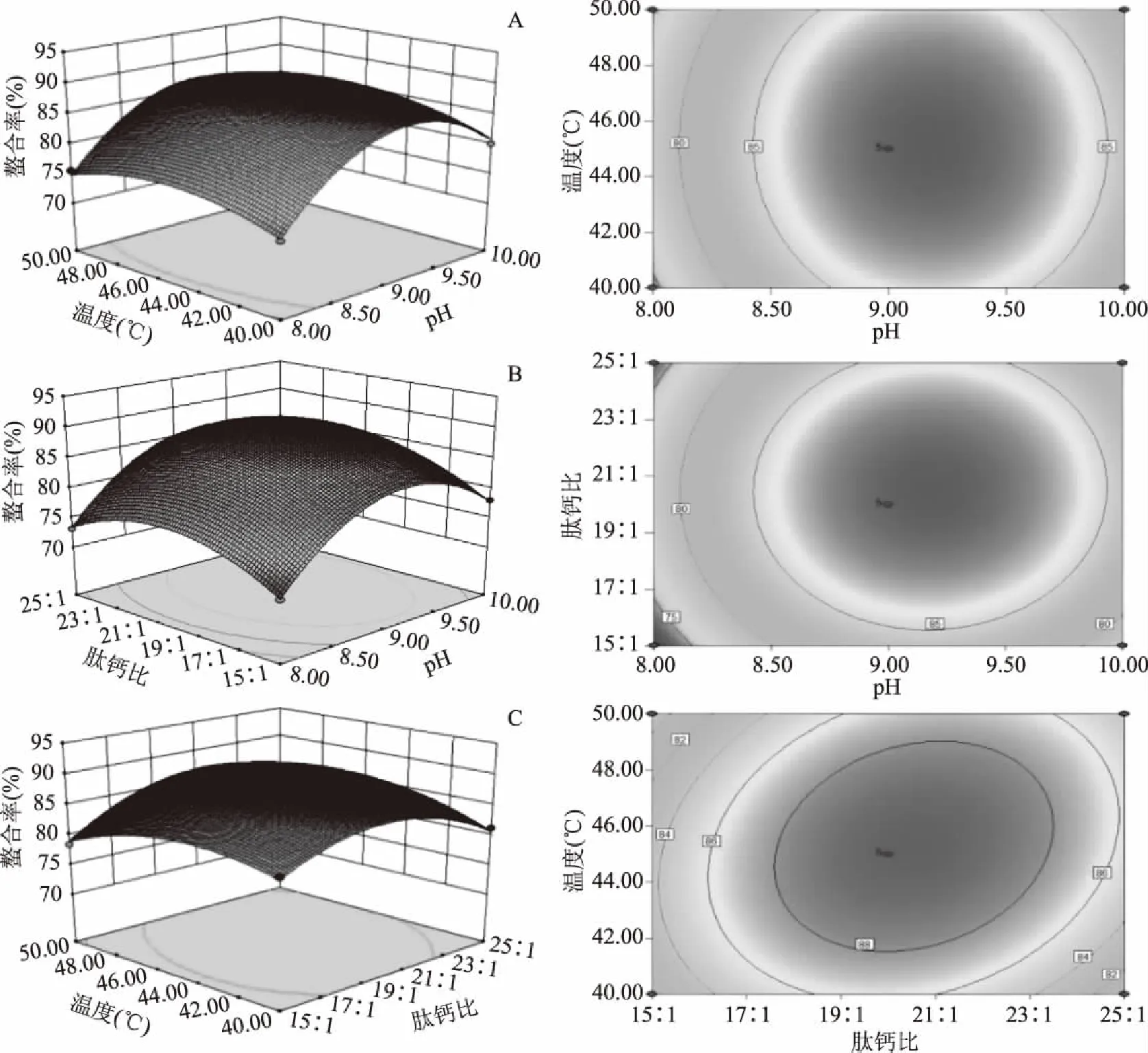
图7 各因素交互作用对螯合率影响的响应面图Fig.7 Response surface of interaction of various factors on chelation rate
由图7a可见,当pH固定时,螯合率呈现先上升后下降的趋势,在温度为45 ℃左右时达到最高;当温度固定时,螯合率在pH为9左右时达到最高;由图7b可见,当肽钙质量比固定时,螯合率在pH为9左右时达到最高,当pH固定时,螯合率在肽钙质量比为20∶1左右时达到最高;图7c反映了温度和肽钙比交互作用对螯合率的影响,从响应面图可以看出,当肽钙质量比固定时,螯合率在45 ℃时达到最高,当温度固定时,螯合率呈现先上升后下降的趋势,在肽钙质量比为20∶1时达到最高。
模型得到的最优螯合条件是pH为9.18,肽钙质量比为20.55∶1,反应温度为45.27 ℃,在此条件下预测螯合率为89.98%。考虑到实际条件将反应温度设定为45.3 ℃进行试验验证此模型,得到的结果是螯合率为91.04%,与预测值接近。
2.3 紫外光分析
胶原低聚肽及胶原低聚肽螯合物的紫外吸收波长如图8所示,胶原低聚肽在226 nm处有最大吸收波长,胶原低聚肽螯合钙最大波长迁移至208 nm处,最大吸收峰发生了明显的移位,而胶原蛋白肽在200~230 nm处的吸收峰是胶原多肽的羰基及肽键的特征吸收峰。胶原低聚肽与钙离子螯合后相应原子的价电子跃迁使其最大吸收波长发生了改变,说明了胶原低聚肽与钙离子发生了螯合反应。
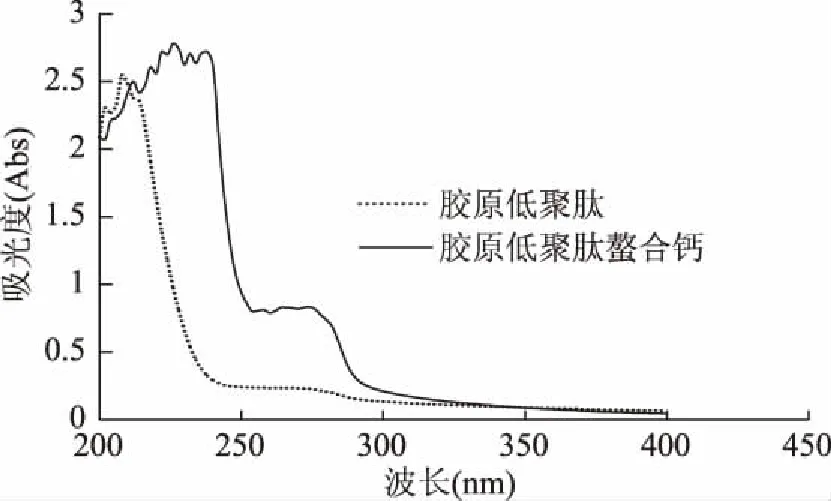
图8 胶原低聚肽与胶原低聚肽螯合钙紫外可见光波长扫描Fig.8 UV-visible wavelength scanning of collagen oligopeptide and collagen oligopeptide calcium-chelating calcium
2.4 红外光谱分析
胶原蛋白酶解物的红外光谱分析图中会出现-NH2和-COOH的吸收峰,当这些基团与钙离子螯合后,吸收峰会发生改变或偏移[26]。由图9可见,在酰胺A带胶原低聚肽红外光谱特征区,由于N-H伸缩振动,-NH2在3311.78cm-1处具有吸收峰,而在胶原低聚肽螯合钙中此吸收峰移至3315.63 cm-1;在酰胺Ⅰ带,因为COO-的震动收缩,C=O在1654.92 cm-1处具有吸收峰,而胶原低聚肽螯合钙的C=O吸收峰移至1660.71 cm-1[26]。酰胺A带和在酰胺Ⅰ带都向高波数方向移动,且两个区的吸收强度显著增强,说明氨基和羧基都与钙离子发生了螯合反应。
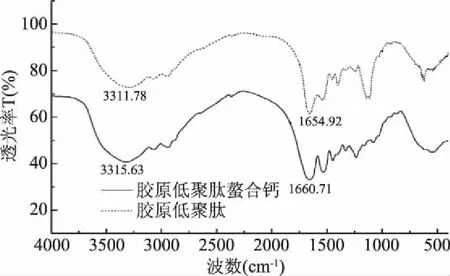
图9 胶原低聚肽和胶原低聚肽螯合钙的红外光谱图对比Fig.9 Comparison of the infrared spectra of collagen oligopeptide and collagen oligopeptide calcium-chelating calcium
3 结论
通过单因素实验分析了pH、温度、反应时间以及肽钙质量比对胶原低聚肽和钙离子螯合作用的影响,然后选定pH、温度、肽钙质量比进行响应面优化试验,得到的最优螯合条件是pH为9.18,肽钙质量比为20.55∶1,反应温度为45.3 ℃,在此条件下螯合率为91.04%,与预测值接近,响应面优化的最优工艺条件可靠,可以用于实践。对胶原寡肽螯合钙通过紫外吸收光谱和红外光谱分析,发现胶原低聚肽螯合钙的吸收峰发生了位移,胶原低聚肽的氨基和羧基与钙发生了螯合反应,证明胶原低聚肽与钙生成胶原低聚肽螯合钙。
