酿造酱制品微生物挑战性试验研究
2019-03-28,,,,
,, ,,
(1.北京林业大学经济管理学院,北京 100083; 2.中国检验检疫科学研究院,北京 100176; 3.烟台欣和味达美企业食品有限公司,山东烟台 264006)
豆酱是我国四大传统发酵豆制品之一,含有人体所需的多种营养成分,而且由于经过微生物的发酵,更容易被人体消化吸收,还具有众多生理调节功能,如抗癌、溶解血栓、降血压[1]、抗氧化等,此外豆酱还具有抑制胆固醇、防止胃溃疡的功效[2]。
现阶段我国在酱制品领域的研究主要集中在以下四方面:酿造酱副产物的研究,阎杰等[3]从酿造酱渣中提取了粗脂肪,刘朝阳[4]对酿造酱渣在水产饲料行业中的应用进行了综述;酿造酱本身的特性的研究,孙常雁等[5]研究了传统酿造酱及酱油中酶系的作用,朱天傲[6]对酱制品中生物胺及产胺芽孢杆菌进行了研究;对加工过程的研究,时威等[7]对黄豆酱杀菌工艺条件进行了研究,陈波等[8]研究了欧姆加热对大豆酱杀菌效果及营养成分的影响;检测方法的研究,张伟清等[9]研究了酱油及酱制品中三氯蔗糖的测定,杨宇民[10]研究了利用容量分析法测定酱制品中的乙醇含量。以上研究均集中于产品本身及加工、产品的检测方法及衍生物的研究,而没有对产品在使用过程中的微生物情况进行分析和研究,忽略了产品的外在使用特性,因此本文从该角度出发进行研究,对于酿造酱产品提出微生物挑战性实验方法并进行具体应用。
目前,国内外微生物挑战性试验方法主要应用于化妆品防腐效能评价,其基本原理是在化妆品中加入一定量的微生物,定期检测微生物生长情况,以此判断防腐剂的防腐效能。在酿造酱产品的微生物挑战性试验的研究甚少,因此本文采用化妆品微生物挑战的方法,研究酱制品的微生物安全性,以期解释酿造酱制品在正常储存条件下,对于其可能污染的致病性微生物具有抑制作用,同时为其他食品种类的微生物挑战性实验奠定理论基础。
1 材料与方法
1.1 材料与仪器
鲁氏接合酵母NRRL Y-229 本实验室分离保藏标准菌株;Gibco DMEM高糖培养基 上海慧颖生物科技有限公司;金黄色葡萄球菌CICC10384 中国工业微生物菌种保藏管理中心;7.5%氯化钠肉汤培养基、BP培养基 青岛高科园海博生物技术有限公司;DMEM高糖增菌液 上海远慕生物科技有限公司;800 g 6月香豆瓣酱 山东欣和食品工业有限公司;800 g黄豆酱 佛山市海天调味食品股份有限公司;240 g美味黄豆酱 李锦记(新会)食品有限公司;340 g原晒香黄豆酱 广东美味鲜调味食品有限公司;250 g六必居干酱 北京六必居食品有限公司;90 g田野泉大豆酱 吉林省田野泉酿造有限公司;300 g PP盒豆瓣酱 20160510、20160512、20160514、20160516 山东欣和食品工业有限公司。
CJ-2F超净工作台 苏州市金燕净化设备有限公司;DRP-9272型恒温培养箱 上海一恒有限公司;HL-200i型天平 梅特勒-托利多仪器(上海)有限公司:JYD-400型拍击式均质器 上海之信仪器有限公司;mLS-3750型灭菌锅 日本SANYO公司;LD型封口机 广州行远包装机械有限公司;GYW-FG水分活度仪 广州沪瑞明仪器有限公司;FE28台式pH计 梅特勒-托利多仪器(上海)有限公司;AZ86031盐度计 台湾衡欣科技股份有限公司。
1.2 实验方法
1.2.1 微生物挑战实验方法流程图 利用微生物在化妆品上的微生物挑战性实验方法[11],建立食品上的微生物挑战性方法。但是要明确食品微生物挑战性实验的特殊性,首先要识别出产品中存在的最难致死致病性的微生物,其次要确定该产品的细菌最大的污染程度或最差条件。因此,建立如下的微生物挑战性实验的方法见图1。
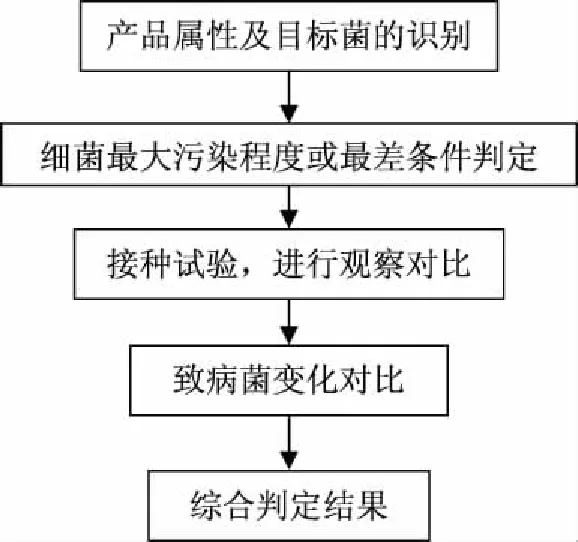
图1 微生物挑战性实验流程图Fig.1 Flow chart of microbial challenge method
1.2.2 酿造酱产品的属性 按照国际通用的美国产品大分类标准[12],常温密封包装产品分类通过水分活度和pH两个指标进行分类,见表1。

表1 酿造酱制品产品分类Table 1 Product category of brewed sauce products
根据上面的指标要求,对市面的酿造酱中的6个不同品牌的豆瓣酱产品各12个样本进行分析。利用pH计根据GB 5009.237-2016 的方法对上述产品的pH进行测定;利用水分活度以根据GB 5009.238-2016的方法对上述产品的水分活度进行测定;利用盐度计根据GB 5009.44-2016的方法对上述产品的盐度进行测定。最终pH、水分活度、盐度检测结果见表2。
通过表2的数据,对比表1的属性分类,发现目前市场上的发酵酱产品的水分活度均低于0.85,均属于普通类食品。

表2 酿造酱产品pH与水分活度检测结果Table 2 Test results of the brewed sauce pH value and AW
1.2.3 目标菌的分析 因为酿造酱产品属于普通类食品,因此在这种条件下,可能存活并繁殖的常见微生物只有部分嗜盐细菌(Halophilicbacteria)、耐高渗微生物(Extremely osmophilic microorganisms,主要为酵母菌)。其中可致酱腐败(胀气等)的微生物主要是耐盐性的酵母菌[13]。
据美国食品药品监督管理局(FDA)公布的资料[14],在所有的致病菌中只有金黄色葡萄球菌(Staphylococcusaureus)具有生长繁殖的风险(金黄色葡萄球菌生长的最低水分活度0.83,产生毒素的最低水分活度0.85)。另据韩景田等对食品对十三种细菌标准菌株最低抑菌浓度测定:金黄色葡萄球菌在高于16%的盐水中不能存活[15]。根据表2数据,酿造酱产品盐度低于16%。
通过以上分析,因此只需要对酵母菌和金黄色葡萄球菌进行微生物挑战性试验即可。
1.2.4 细菌最大污染程度或是最差条件判定 经过对5家酿造酱生产企业灌装车间及车间生产环境接触面的酵母菌及金黄色葡萄球菌污染情况进行连续30 d的监测,同时对烟台附近3个村镇24家农户厨房及餐桌已用黄豆酱的酵母菌及金黄色葡萄球菌污染情况进行连续10 d的监测。根据GB 4789.15-2016对酵母酵菌数量进行测定,根据GB 4789.10-2016金黄色葡萄球菌的数量进行测定。
从5家酿造生产企业连续监控的数据得出,其车间最大酵母污染程度为102CFU/g,最大金黄色葡萄球菌污染程度为104CFU/g。从24家农户连续监控数据得出,其最大酵母污染程度为104CFU/g,最大金黄色葡萄球菌污染程度为106CFU/g。因此接种试验时应该按照酵母104CFU/g、金黄色葡萄球菌106CFU/g来进行。
1.2.5 分别接种试验
1.2.5.1 酵母接种 本实验采用三个平行样进行对照分析。批次为20160510 PP盒豆瓣酱三个平行样品分别标注A1、A2、A3;批次为20160512 PP盒豆瓣酱三个平行样品分别标注B1、B2、B3,相关指标测定结果见表3。

表3 酿造酱产品相关指标信息Table 3 Information on indexes of brewed sauce products
豆瓣酱水分活度在0.850以下,所以酵母菌的增菌采用高糖增菌液进行(总糖含量为50%),以适应待接种产品的低水分活度。将酵母菌接种到高糖增菌液中,(28±1) ℃培养2~4 d增菌。
使用灭菌后的高糖增菌液调整酵母增菌液浓度为105CFU/mL,每份样品接种量为3.0 mL,接种后使用灭菌后的药勺搅拌将样品混合均匀,在无菌室内使用封口机封口,盒装酱使用电熨斗加热封口。样品封口后放置30 ℃保温库保存。
在实验进行过程中,需要进行阴性对照。在对照样品中加入不含菌的高糖培养液3.0 mL,使用灭菌后的药勺将样品搅拌混合均匀,在无菌室内使用封口机封口,盒装酱使用电熨斗加热封口。样品封口后放置30 ℃保温库保存[16]。
1.2.5.2 金黄色葡萄球菌接种 本实验采用三个平行样进行对照分析。批次为20160514三个平行样品分别标注C1、C2、C3;批次为20160516三个平行样品分别标注D1、D2、D3。本实验中,批次为20160514、20160516的300 g PP盒豆瓣酱的相关指标测定结果见表4。

表4 酿造酱产品相关指标信息Table 4 Information on indexes of brewed sauce products
豆瓣酱水分活度在0.850以下,所以保存金黄色葡萄球菌接种到7.5%氯化钠肉汤增菌,(36±1) ℃培养12~18 h增菌。
使用灭菌后的氯化钠肉汤调整金黄色葡萄球菌液增菌浓度为8~9 log/mL,每份样品接种量为3.0 mL,接种后使用灭菌后的药勺搅拌将样品混合均匀,在无菌室内使用封口机封口,盒装酱使用电熨斗加热封口。封口样品放置于36 ℃保温库保存。
在实验进行过程中,需要进行阴性对照。在对照样品中加入无菌的7.5%氯化钠肉汤培养液3.0 mL,使用灭菌后的药勺将样品搅拌混合均匀,在无菌室内使用封口机封口,盒装酱使用电熨斗加热封口。封口后放置于36 ℃保温库保存[17]。
1.2.6 豆瓣酱的检测频率 第一周每天进行一次酵母菌、金黄色葡萄球菌检测,然后每周进行一次检测,待一个月后,每月检测一次,共试验两个批次。同时进行水分活度(Aw)和pH的检测,检测频率为每三个月检测一次,每次检测三个批次。由于该产品的保质期为12个月,按照保质期延长实验的要求,因此检测时长设定为15个月,同时进行阴性对照。
2 结果与分析
2.1 盒装300 g豆瓣酱酵母菌挑战性实验
根据整个过程酵母菌数量的变化进行记录,并整理出最终结果见表5;根据整个过程中pH变化进行记录,并整理出最终结果见表6;根据整个过程中Aw变化进行记录,并整理出最终结果见表7。
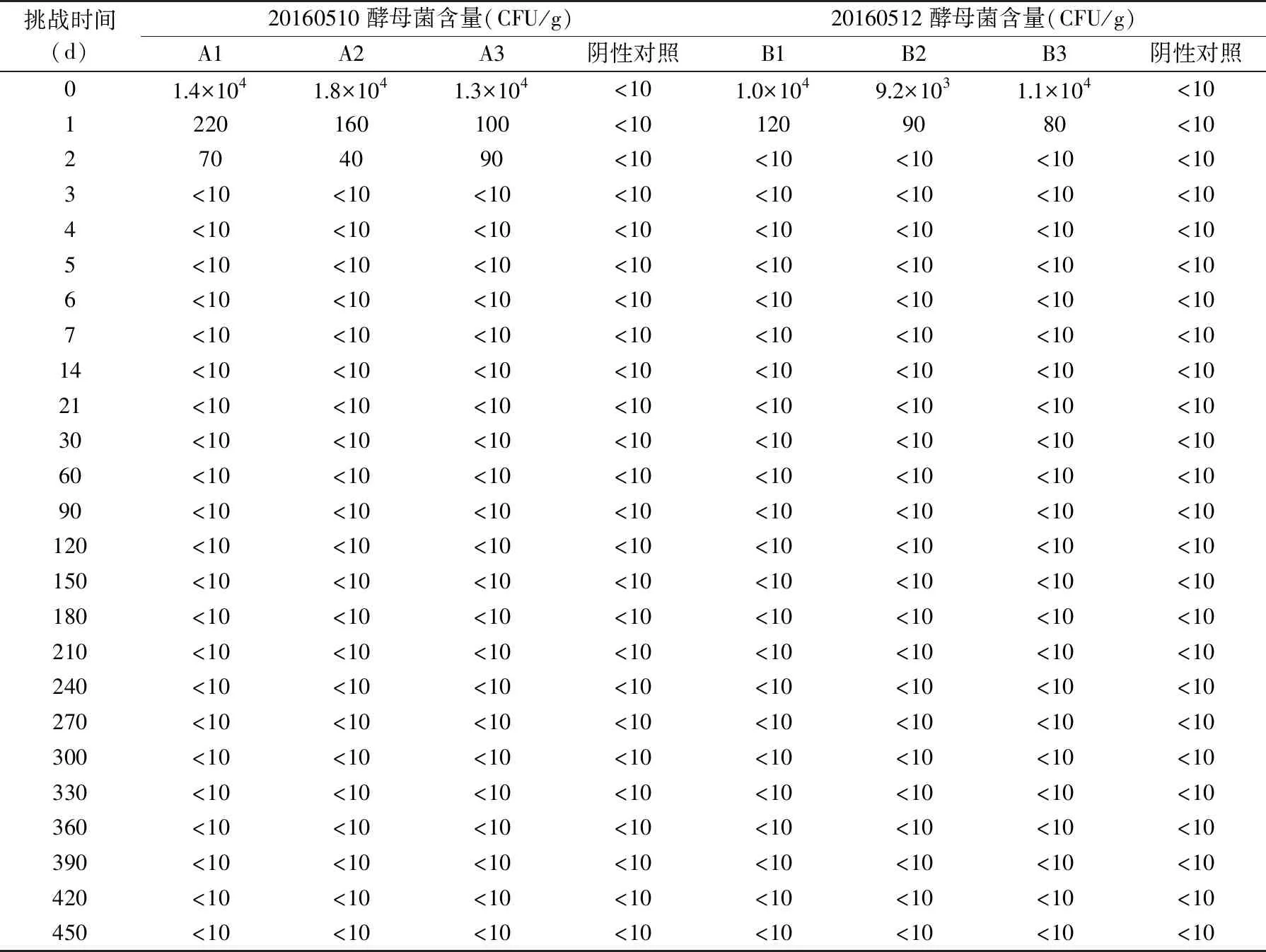
表5 豆瓣酱酵母菌挑战性实验结果Table 5 Challenging experimental results of yeast in soybean paste
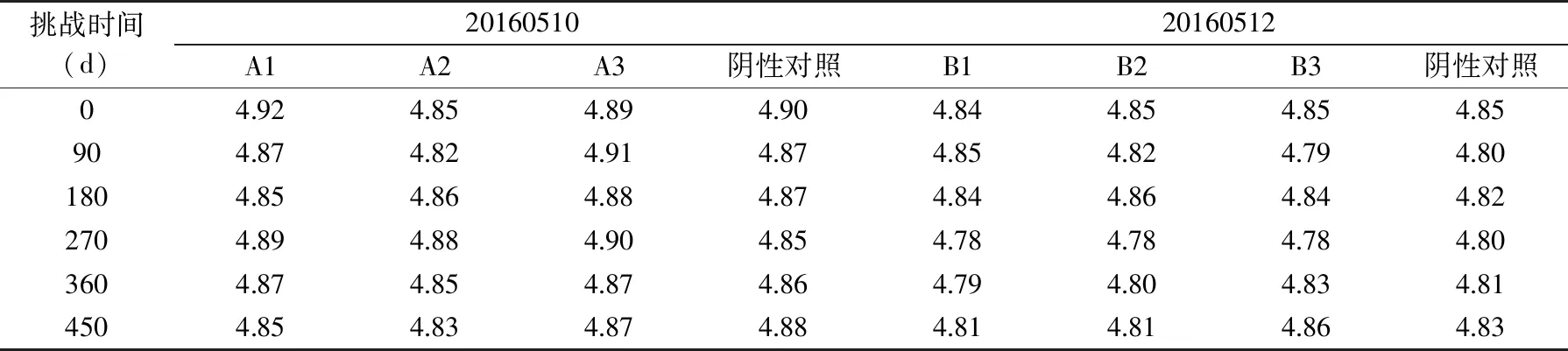
表6 豆瓣酱pH检测结果Table 6 Test results of pH in soybean paste
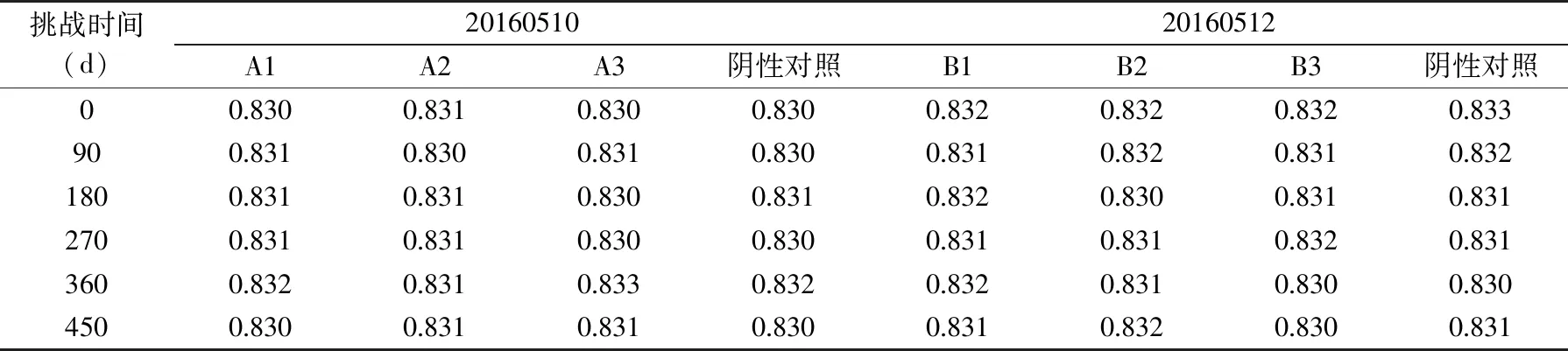
表7 豆瓣酱Aw检测结果Table 7 Test results of Aw in soybean paste
根据表5数据得出,酵母菌数量在整个过程中逐渐减少,至第3 d,酵母菌数量降至<10 CFU/g,符合GB4789.15-2016食品微生物学检验 霉菌和酵母计数中细菌增殖总量的要求。综合分析3 d后的数据,细菌总数达到相对稳定状态,且没有出现增殖状况。
根据表6数据得出,样品pH检测结果与对照样检测结果最大偏差值为0.05,符合GB5009.237-2016 食品安全国家标准 食品pH的测定中的不超过0.1的要求。样品本身的pH变化在0.05范围内,说明产品在这段时间内pH是相对比较稳定的。
根据表7数据得出,样品Aw检测结果与对照样检测结果最大偏差值为0.002,符合GB5009.238-2016 食品安全国家标准食品 水分活度的测定中的在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。样品本身的Aw值变化在0.002范围内,说明产品在这段时间内Aw相对比较稳定的。
综上所述,产品的细菌变化呈递减形式,且3 d后产品不再出现增殖,且后面维持不变,同时产品的pH、Aw也是相对比较稳定的,说明豆瓣酱对酵母菌具有抑制作用。
2.2 盒装300 g豆瓣酱金黄色葡萄球菌挑战性实验
根据整个过程金黄色葡萄球菌数量的变化进行记录,并整理出最终结果见表8。

表8 豆瓣酱金黄色葡萄球菌挑战性实验结果Table 8 Challenging experimental results of Staphylococcus aureus in soybean paste
根据表8数据得出,金黄色葡萄球菌数量在整个过程中逐渐减少,至第3 d,金黄色葡萄球菌数量降至<10 CFU/g,符合GB4789.10-2016食品微生物学检验 金黄色葡萄球菌检验中细菌增值总量的要求。综合分析3 d后的数据,细菌总数达到相对稳定状态且没有出现增值状况。
根据表9数据的得出,样品pH检测结果与对照样检测结果最大偏差值为0.03,符合GB5009.237-2016 食品安全国家标准 食品pH的测定中的不超过0.1的要求。样品本身的pH变化在0.03,说明产品在这段时间内pH相对比较稳定的。
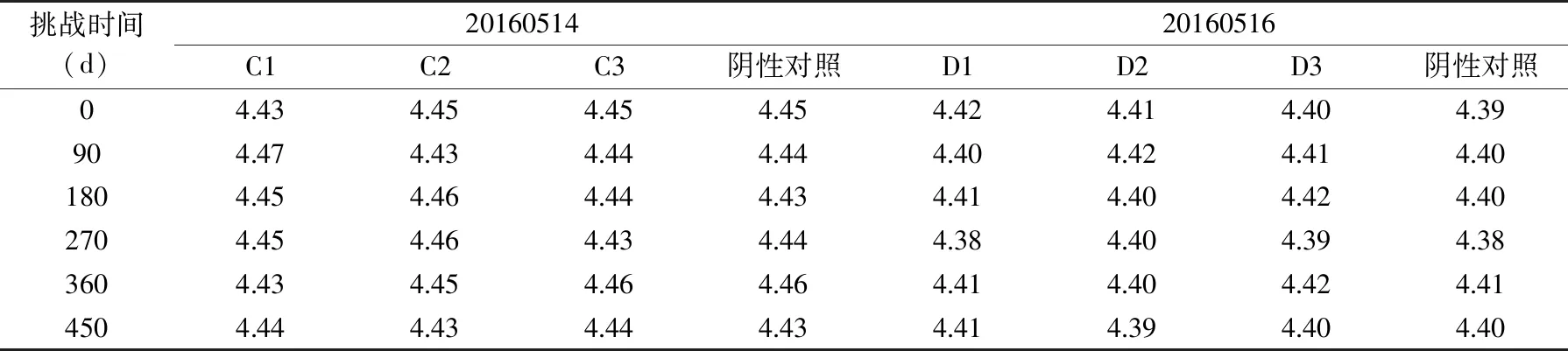
表9 豆瓣酱pH检测结果Table 9 Test results of pH in soybean paste
根据表10数据得出,样品Aw检测结果与对照样检测结果最大偏差值为0.004,符合GB5009.238-2016 食品安全国家标准食品 水分活度的测定中的在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。样品本身的Aw值变化在0.004范围内,说明产品在这段时间内Aw是相对比较稳定的。综上所述,产品的金黄色葡萄球菌变化呈递减形式,且三天后产品不再出现增殖,且后面维持不变,同时产品的pH、Aw也是相对比较稳定的,说明豆瓣酱对金黄色葡萄球菌具有抑制作用。

表10 豆瓣酱Aw检测结果Table 10 Test results of Aw in soybean paste
3 结论
酵母菌、金黄色葡萄球菌在细菌污染到最大量的条件下,经过3 d,细菌总数降至<10 CFU/g,同时监测的样品pH、Aw检测结果不论与对照样的变化,还是与自身的变化对比都符合相关要求,达到了微生物挑战的实验目的。说明Aw小于0.85的酿造酱产品对酵母菌、金黄色葡萄球菌具有抑制的作用。通过实验证实,即使酿造酱产品污染一定数量的致病菌,经过一段时间之后,产品本身可以恢复到产品的最初的安全状态,符合食品安全性的要求。
该实验结合食品自身的特性,参考化妆品风险挑战实验的方法。因此,实验过程和结果具有一定的科学性和参考价值。但是该实验也具有一定的局限性,在低酸酸化食品、无菌罐装食品的风险挑战性实验中,由于需要加入热力杀菌的步骤,因此在方法设置上还需要进一步完善。
