玉米醇溶蛋白颗粒和海藻酸丙二醇酯制备的新型双层乳液的理化特性
2019-03-28,,,*
, ,,*
(1.北京食品营养与人类健康高精尖创新中心,教育部北京市共建功能乳品重点实验室,北京 100083; 2.中国农业大学食品科学与营养工程学院,北京 100083)
玉米醇溶蛋白是玉米中的主要贮藏蛋白,属于食品级[1]醇溶性多肽。由于其疏水性以及能溶于乙醇水溶液[2]的特性,可通过调节溶剂的溶解性能,从而形成带正电的玉米醇溶蛋白颗粒(ZCP),达到运载生物活性成分的效果。海藻酸丙二醇酯(PGA)是一类食品级多糖[3],目前主要用作一种增加粘度、改善乳化性、包被活性成分的食品添加剂[4]。
与表面活性剂通过降低表面张力使乳液稳定的机制不同,Pickering乳液是一种由固体颗粒制备的乳液,固体颗粒可提供致密的物理隔层,从而防止液滴聚结,稳定乳液[5]。Pickering乳液的润湿性、粒径、形状、表面性质和浓度会受到颗粒类型的影响[6]。
由于传统的单层乳液在某些条件下稳定性较差,为了提升乳液的稳定性,可以采用化学改性[7]、低能乳化[8]、微乳液聚合[9]、逐层静电沉积技术(LBL)[10]等方法制备多层乳液。逐层静电沉积技术(LBL)是一种依靠带电聚合物之间的静电作用力,促使电性相反的带电聚合物逐层构建静电薄膜结构的技术[11-12]。通过这种技术构建的多层乳液,其油/水界面常由多层蛋白质、多糖或脂质组成[13],可以保护封装组分免受化学降解[14],并根据特定环境触发因素释放封装组分[15]。
本实验采用逐层静电沉积技术(LBL),在颗粒和乳化剂的共同存在下制备了双层乳液。该双层乳液的油/水界面由ZCP和PGA组成,并系统地研究了不同浓度的PGA以及ZCP与PGA的加入顺序,对双层乳液物理稳定性和微观结构的影响,并采用光学显微镜和激光共聚焦扫描显微镜(CLSM)对此新型双层乳剂的形态特征进行观察,以期为这种由颗粒和乳化剂复合稳定的新型双层乳液提供一些新的理论依据。
1 材料与方法
1.1 材料与仪器
玉米醇溶蛋白91.3%(w/w) Sigma-Aldrich公司(美国);无水乙醇99.99%(v/v)、固体氢氧化钠99.0%(w/w)、液体盐酸36%(w/w) Eshowbokoo生物技术有限公司(中国北京);食品级海藻酸丙二醇酯(PGA)87.9%(w/w) 汉骏糖业有限公司(中国上海);中链甘油三酯(MCT)50%(w/w) Lonza Inc.(美国);所有其他化学试剂 均为分析纯。
Ultra Turrax model T25高速剪切机 IKA公司(德国);LS230®激光散射粒度仪 贝克曼公司,(美国);Zetasizer NanoZS90 马尔文激光粒度仪 Malvern公司(英国);Leica DMD 108光学显微镜,Leica TCS SP5激光共聚焦扫描显微镜(CLSM) 徕卡公司(德国);LUM 290 LUMiSize稳定性分析仪 LUM公司(德国);SPSS 18.0 for Windows IBM公司(美国)。
1.2 实验方法
1.2.1 ZCP和PGA溶液的制备 将4 g玉米醇溶蛋白溶于800 mL 70%(v/v)乙醇水溶液中,600 r/min搅拌3 h,然后45 ℃旋蒸30 min[16],所得液体用蒸馏水稀释至200 mL,1000 r/min离心10 min,取上清液,用0.1 mol/L HCl溶液将所得样品pH调节至4.0,保存于5 ℃的冰箱。
将不同质量的PGA粉末溶解于蒸馏水中,制备不同质量浓度(0.01%、0.05%、0.1%、0.25%、0.5%、0.75%、1.0%、1.25%、1.5%)的PGA溶液,溶液于600 r/min下搅拌过夜(约12 h),然后用1 mol/L NaOH将溶液pH调节至4.0。
1.2.2 ZCP和PGA双层乳液的制备 以50%(v/v)MCT油作为分散相,制备两种不同添加顺序的双层乳液,双层乳液总体积为30 mL,所有乳液在室温(25 ℃)下贮藏12 h。
1.2.2.1 ZCP/PGA双层乳液的制备 将7.5 mL ZCP分散液(2.0%,w/v)缓慢加入15 mL MCT(油相)中并同时于12000 r/min下进行剪切,待ZCP分散液全部加入油相后继续剪切5 min,得到初级乳液。再在同样的剪切速度下分别向初级乳液中缓慢加入7.5 mL不同浓度的PGA水溶液(0.01%~1.5%,w/v),待PGA水溶液全部加入初级乳液后,将混合物继续剪切5 min,得到次级乳液。从而制备出z-0.01p,z-0.05p,z-0.1p,z-0.25p,z-0.5p,z-0.75p,z-1.0p,z-1.25p和z-1.5p的ZCP/PGA双层乳液。
1.2.2.2 PGA/ZCP双层乳液的制备 将7.5 mL PGA水溶液(0.01%~1.5%,w/v)缓慢加入15 mL MCT(油相)中并同时于12000 r/min下进行剪切,待PGA水溶液全部加入油相后继续剪切5 min,得到初级乳液。再在同样的剪切速度下向不同浓度PGA的初级乳液中分别缓慢加入7.5 mL ZCP分散液(2.0%,w/v),待ZCP分散液全部加入初级乳液后,将混合物继续剪切5 min,得到次级乳液。从而制备出0.01p-z,0.05p-z,0.1p-z,0.25p-z,0.5p-z,0.75p-z,1.0p-z,1.25p-z和1.5p-z的PGA/ZCP双层乳液。
1.2.2.3 对照组的制备 将15 mL ZCP分散液(2.0%,w/v)缓慢加入15 mL MCT(油相)中并同时于12000 r/min的速度下进行剪切,待ZCP分散液全部加入油相后,将混合物继续剪切5 min,作为对照,得到初级乳液,命名为“zein”。
1.2.3 乳液类型鉴别 取一滴乳液(约0.02 mL)分别加入到纯MCT和纯水(约10 mL)中,如果乳滴在水中迅速分散而在MCT中保持聚集,则认为是水包油(o/w)型乳液,否则为油包水(w/o)型乳液[17]。
1.2.4 粒径和电位测定 粒径测定:使用激光散射粒度分析仪,测量乳液的平均液滴粒径和粒径分布。MCT和水的折射率分别为1.52和1.33。计算体积面积(D3,2)以衡量乳液液滴大小,计算公式如下:
式中:ni是直径为di的颗粒数量。
电位测定:使用马尔文激光粒度仪测定双层乳液的Zeta(ζ)电位。用pH4.0的去离子水稀释乳液至0.005wt%。设定平衡120 s,所有数据重复测量三次。
1.2.5 物理稳定性分析
1.2.5.1 离心稳定性分析 使用LUMiSizer稳定性分析仪,测量乳液的离心稳定性。在2 mL离心管中加入1.8 mL乳液,设定转速3000 r/min,离心时间3600 s,温度25 ℃[18],测量不同离心时间下乳液透光率大小。
1.2.5.2 贮藏稳定性分析 测量贮藏1、7、14、21、28 d后乳液的液滴粒径和ζ电位,并通过拍照记录观察乳液表观特征的变化。
1.2.6 微观结构观察
1.2.6.1 光学显微镜观察 用pH4.0去离子水将乳液稀释10倍,用光学显微镜观察稀释后乳液的微观结构。
1.2.6.2 激光共聚焦扫描显微镜(CLSM)观察 用尼罗蓝(0.1%)和尼罗红(0.1%)混合荧光染料溶液对乳液进行染色,ZCP被尼罗蓝染成蓝色,MCT被尼罗红染成红色。用激光共聚焦扫描显微镜(CLSM)进一步观察染色乳液的界面结构。
1.3 数据处理
所有获得的数据均取三次测定的平均值,并用SPSS进行方差统计分析。统计学差异通过单因素方差分析(ANOVA)和Duncan检验来确定,p<0.05表示差异显著。
2 结果与分析
2.1 双层乳液的表观特征分析
由实验1.2.3可知,将zein和双层乳液滴在MCT和纯水中,它们在水相中的分散速度明显快于在MCT相中的分散速度,表明它们是水包油型乳液。图1显示在室温(25 ℃)下贮藏12 h后,zein乳液、不同浓度PGA和不同添加顺序对双层乳液的外观和物理稳定性的影响。由ZCP单独稳定的zein乳液不稳定,乳液的上相有大量油相释放,并有明显分层现象,这可能是由于ZCP的润湿性不足[2,16],不能很好地稳定在油水界面,从乳滴表面脱离,从而导致乳液分层。低浓度PGA(≤0.1%)形成的的Z/P双层乳液(图1A、C),表观特征与zein相似,均在上相很快释放出油相,并有明显分层现象,说明低浓度PGA基本上不能覆盖zein乳液的液滴,导致乳液液滴聚结。而且,带负电的PGA的加入降低了ζ电势,使其不能提供足够的静电排斥,以保持乳液稳定。随着PGA浓度的升高(0.01%~0.5%),Z/P双层乳液的乳化相体积不断增加。当PGA浓度达到0.5%以上时,乳液均一稳定,没有明显的油析或分层现象。添加顺序不同时,与Z/P双层乳液相比,使用P/Z双层乳液均呈乳白色,而Z/P双层乳液则由淡黄色逐渐转变为乳白色。该现象的出现可能有两个原因:一是PGA为两亲性多糖,具有比ZCP更快的界面吸收速度和更强的液滴乳化能力,所以当先加入PGA时,乳液可以形成更均匀和小粒径的液滴。二是PGA的充分覆盖改善了液滴的稳定性,从而改变了乳液的外观。

图1 zein乳液(E),Z/P(A、B)和P/Z(C、D)双层乳液的表观特征Fig.1 Visual appearance of zein-based emulsion,ZCP/PGA and PGA/ZCP bilayer emulsions
2.2 粒径分布和ζ电位测定结果
图2A和图2C给出了ZCP和PGA不同添加顺序形成的双层乳液的平均液滴粒径和ζ电位值,图2B和2D显示了相应的液滴粒径分布。可以发现,大部分双层乳液的平均液滴小于80 μm(除了0.01p-z)。与果胶和玉米醇溶蛋白稳定的Pickering乳液[16]相比,液滴粒径相对较小,证明PGA具有比果胶更好的乳化性。就Z/P双层乳液而言,当低浓度的PGA(0.01%和0.05%)加入到由ZCP稳定的Pickering乳液中时,液滴粒径增加。同时,Z/P双层乳液的Zeta电位值由正电荷(41.3±3.9) mV降至负电荷(-9.53±2.66) mV和(-10.25±2.98) mV,说明PGA中和了液滴表面上的相反电荷,而要达到静电稳定,ζ电位值的绝对值必须超过30 mV,并且在绝对值5~15 mV之间,发生耗尽絮凝[19]。因此,当PGA浓度较低时,液滴间由于静电排斥力不足,不具有足够的稳定性来防止聚结和分层。这与在添加低浓度PGA的Z/P双层乳液中观察到的分层和油相释放表观特征相一致(图1A)。

图2 不同浓度及添加顺序的ZCP与PGA形成乳液的液滴大小、Zeta电位(A、C)和粒径分布(B、D)Fig.2 Droplet size,zeta-potential(A,C)and size distribution(B,D)of zein-based Pickering emulsion and bilayer emulsions with two different adding sequences at various mass ratios of ZCP to PGA
而当PGA的浓度从0.1%升高至1.0%时,液滴的平均粒径从(36.58±0.64) μm逐渐减小至最小值(12.46±0.03) μm。同时,液滴的ζ电位从(-14.1±2.69) mV降低至最小值(-29.63±1.19) mV。当PGA浓度大于1.0%时,液滴粒径和ζ电位均未出现明显波动,表明此含量的PGA已提供了足够的静电排斥和机械阻隔,以稳定乳液防止液滴聚集。此外,吸附在液滴上的PGA分子提高了乳化效率,使得液滴粒径逐渐减小。但由于一些PGA分子可能与ZCP存在界面竞争吸附,并随后通过降低界面的表面张力来减小液滴粒径,所以当PGA浓度高于1.0%时,由于连续相中存在过量的游离PGA而促进液滴聚集,液滴粒径略微增加。此结果表明,1.0%的PGA可能是完全覆盖油/水界面和稳定Z/P双层乳液所需的最低浓度。
在P/Z双层乳液中发现了类似的规律。在低浓度PGA(0.01%)下,与Z/P双层乳液相比,P/Z双层乳液((155.2±2.5) μm)的液滴粒径显著增加(p<0.05),这表明乳液中发生了液滴聚集现象。这些乳液的PGA浓度太低,无法使油相大量乳化,并且PGA分子的负电荷被ZCP中和,静电排斥作用降低。而当PGA浓度升至0.05%时,P/Z双层乳液的液滴粒径迅速降至(73.93±0.47) μm,表明PGA具有较好的乳化性,能够更有效地降低双层乳液的液滴粒径。随着PGA浓度的升高(0.05%~0.5%),液滴粒径从(73.93±0.47) μm降低至(19.74±0.03) μm(p<0.05)。当PGA浓度高于0.5%时,液滴粒径下降至最小值(12.23±0.04) μm,这说明PGA完全被液滴表面吸附。如表1所示,zein乳液和两种类型双层乳液的D3,2显著受PGA水平的影响(p<0.05)。不同添加顺序并未影响平均液滴粒径的变化趋势,但它们的D3,2远小于其各自的液滴的平均粒径。
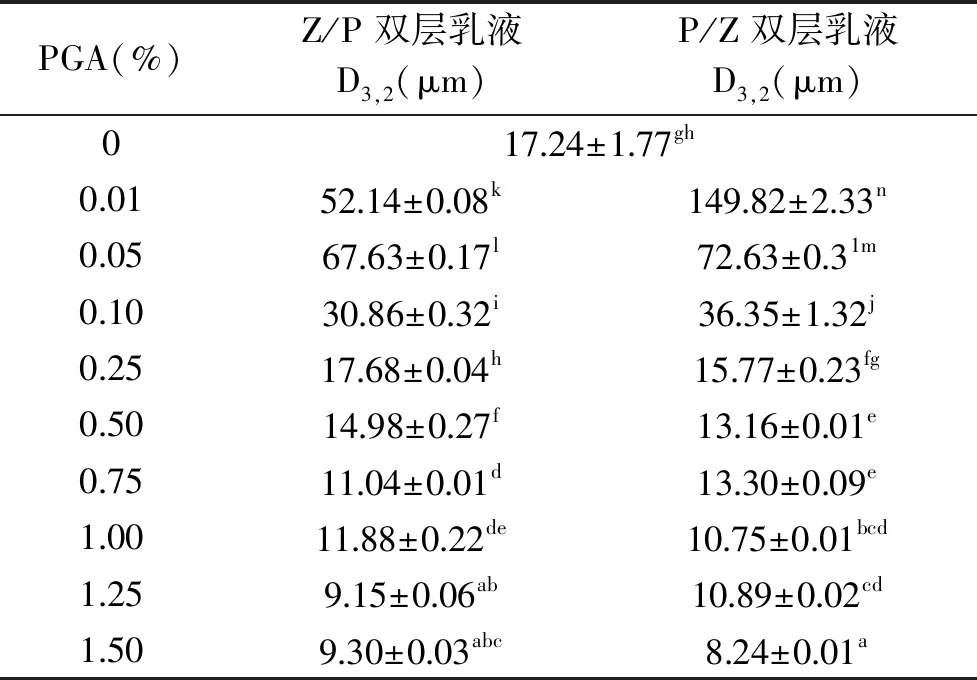
表1 不同浓度的玉米醇溶蛋白与PGA双层乳液的D3,2Table 1 D3,2 of bilayer emulsions with two different adding sequences at different mass ratios of zein and PGA
图2B和图2D中分别显示了Z/P和P/Z双层乳液的液滴粒径分布。zein乳液表现出较宽的粒径分布单峰,这表明单独用ZCP稳定的Pickering乳液,粒径不均匀。当添加较低浓度PGA时(0.01%和0.05%),Z/P双层乳液表现出大致均匀的粒径分布和窄峰,这可能是由于在pH4.0时,带负电的PGA分子会与邻近的带正电荷的液滴相互作用,引起絮凝。随着PGA浓度的升高,液滴的粒径分布从窄单峰模式变为双峰模式,并且在0.1%和0.25%的PGA水平可以清楚地观察到两个叠加峰。这可能是由于PGA分子逐渐被液滴表面吸附,但仍不足以完全覆盖液滴表面,从而产生不均匀粒径的液滴。当PGA浓度大于0.5%时,液滴粒径分布从双峰再次变为单峰,峰值逐渐下降。就P/Z双层乳液而言,粒径分布较为均匀,在低PGA浓度(0.01%和0.05%)下具有窄峰。在PGA存在下,双层乳液中出现宽双峰模式(0.1%)和两个重叠峰(0.25%),随着PGA含量增加到0.5%以上,液滴粒径分布变为近单峰,峰纵坐标值逐渐减小。
2.3 双层乳液的物理稳定性分析
2.3.1 离心稳定性分析 双层乳液的离心稳定性随离心时间变化如图3所示。如图3A所示,zein乳液的离心过程中透光率呈不断上升的趋势,且最终乳液透光率最大,乳液非常不稳定。在低浓度PGA下,由于PGA不能完全覆盖液滴,PGA的加入反而导致静电斥力的下降而使液滴间絮凝。随着PGA浓度的增加,稳定性增强,说明吸附在液滴表面的PGA不断增加,虽然0.5%PGA的Z/P双层乳液的稳定性仍然比zein乳液的稳定性差,但当PGA水平为0.75%时,Z/P双层乳液的稳定性高于zein乳液,并且随着PGA浓度的继续升高,透光率的波动逐渐平缓,说明双层乳液的物理稳定性随着PGA浓度的上升而不断提高,这可能是由于Z/P双层乳液液滴外层PGA的分子结构更加灵活,可以渗透界面空隙中,提供静电斥力和空间位阻,在大豆可溶性多糖和甜菜果胶对乳铁蛋白包覆橙油双层乳液实验[20]中也出现了类似的现象。当PGA浓度高于1.0%时,分层速率有所降低但不显著,说明ZCP稳定的液滴已经完全被PGA分子覆盖,并且由于水相中过量的PGA分子提高了相粘度,从而改善了Z/P双层乳液的物理稳定性,所以几乎不会发生液滴的絮凝。
如图3B所示,在相同PGA水平下,相比于Z/P双层乳液,P/Z双层乳液的透光率较小,乳液的乳化速率明显增大,加入的阳离子颗粒会与多个阴离子液滴结合,导致液滴絮凝。而当PGA浓度升高至0.5%时,P/Z双层乳液比zein乳液和Z/P双层乳液表现出更好的稳定性。并且随着PGA浓度的逐渐增大,波动极小的透光率可以反映出双层乳液良好的物理稳定性,说明高浓度PGA的添加会降低初级乳液的液滴粒径。在液滴表面被完全覆盖之后,水相中过量的PGA分子将增加双层乳液的粘度,由斯托克斯定律可知,乳液的物理稳定性与乳液的粘度正相关,稳定性的提升可能是粘度升高的原因[21]。
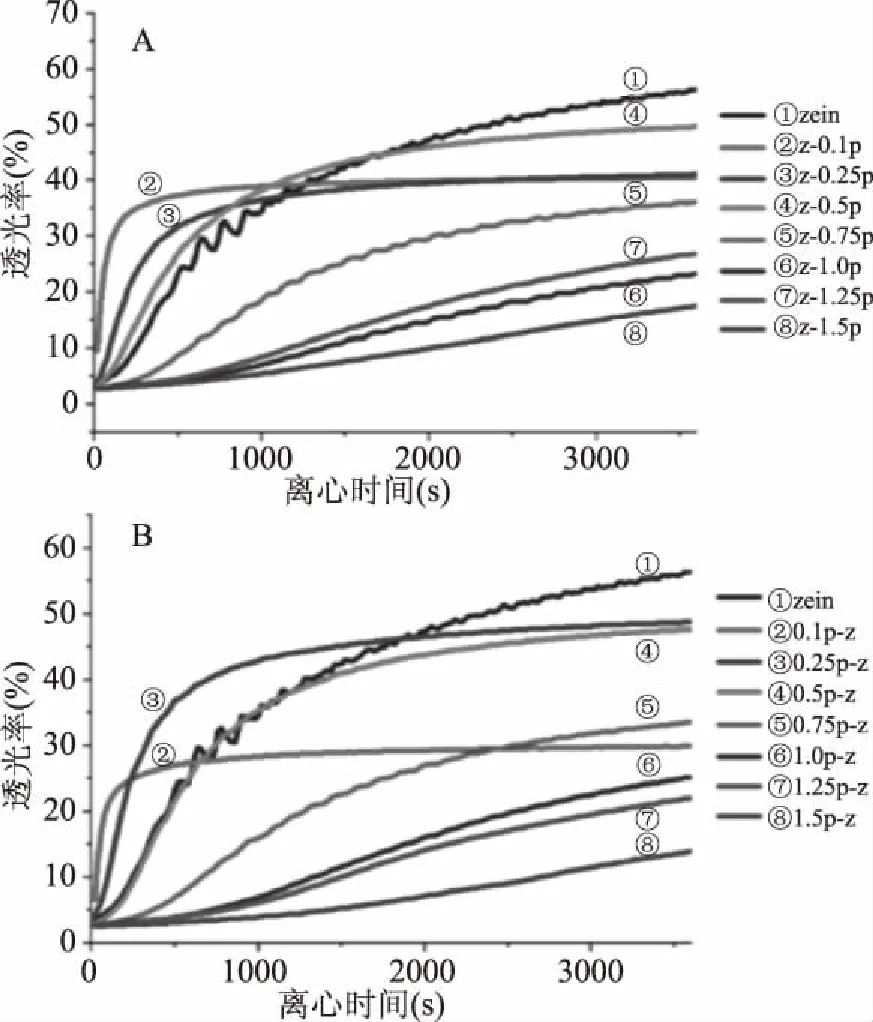
图3 不同浓度的Z/P双层乳液(A)和P/Z双层乳液(B)的透光率变化曲线Fig.3 Transmission profiles of ZCP/PGA bilayer emulsion(A) and PGA/ZCP bilayer emulsion(B) at different mass ratios of zein to PGA
2.3.2 贮藏稳定性分析 图4表示在25 ℃下贮藏一段时间后,zein乳液和与双层乳液的粒径和ζ电位变化。如图4A所示,贮藏时间对不同PGA浓度的Z/P双层乳液的液滴粒径和ζ电位具有不同的影响。zein乳液液滴的粒径和ζ电位变化最大,说明仅由ZCP稳定的Pickering乳液并不稳定。而且zein乳液液滴粒径和ζ电位的大幅波动,也表明ZCP在液滴表面发生反复的吸附和解吸,这可能是ZCP在界面的润湿性较差。低浓度PGA的Z/P双层乳液,由于乳液的不稳定性以及液滴的变形,从而导致液滴粒径比zein乳液还要略微增加,ζ电位也有明显波动。随着PGA浓度的不断升高,Z/P双层乳液的贮藏稳定性显著提高(p<0.05),并且由于稠化界面和高粘度连续相的存在,乳液液滴迁移率降低,贮藏不稳定性下降[22]。

图4 ZCP/PGA双层乳液(A)和PGA/ZCP双层乳液(B)在不同贮藏时间后的液滴粒径和ζ电位Fig.4 Droplet size and Zeta-potential of ZCP/PGA bilayer emulsion(A)and PGA/ZCP bilayer emulsion(B)after different storage times
如图4B所示,贮藏时间对不同PGA浓度的P/Z双层乳液的液滴粒径和ζ电位也有不同的影响。当PGA浓度较低时,双层乳液并不稳定,贮藏过程中液滴粒径和ζ电位有明显变化,削弱的静电斥力促进了乳液的絮凝。而当PGA浓度逐渐增加,PGA分子可以完全覆盖液滴表面并作为内层稳定双层乳液,同时,存在于连续相中的PGA分子,可以提高乳液的黏度,并在一定程度上相互交联形成致密的双层膜,从而提高乳液的贮藏稳定性[23]。
贮藏时间对zein乳液和双层乳液的外观影响如图5所示。25 ℃贮藏7 d后,zein乳液出现明显的分层和油相释放,这可能是由于乳液在贮藏期间因重力分离作用,ZCP从液滴界面分离导致了ZCP的明显沉降。PGA浓度较低时(≤0.05%),贮藏7 d后,两类双层乳液均逐渐发生解离分层,并出现油相释放现象,这是由于颗粒间斥力不足从而导致了液滴的聚结。随着PGA含量的逐渐增加,水层厚度与乳液总高度的比值不断降低。当PGA浓度达到1.0%时,ZCP和PGA共同稳定的双层乳液相对稳定,没有分层现象出现,PGA浓度的增加改善了双层乳液的贮藏稳定性[23]。

图5 不同贮藏时间对zein乳液、ZCP/PGA双层乳液和PGA/ZCP双层乳液外观的影响Fig.5 Effect of different storage times on visual appearance of zein-based Pickering emulsion, ZCP/PGA bilayer emulsion and PGA/ZCP bilayer emulsion
贮藏28 d后,低浓度PGA的双层乳液中出现更加明显的液滴聚集,具有较少PGA分子附着的界面不能提供足够的静电斥力来保证乳液的长期贮藏稳定性。此外,重力作用和粒子的布朗运动也导致了乳液的聚结,从而导致双层乳液的水层厚度与乳液总高度的比值均升高。随着PGA的浓度升高,双层乳液的水层厚度逐渐降低,这说明高浓度的PGA为双层乳液液滴提供了充足的静电斥力和稳定的空间结构,提高了乳液的长期贮藏稳定性[23]。
2.4 双层乳液的空间形态观察
2.4.1 光学显微镜观察 图6显示了不同类型乳液的光学显微镜照片。可以观察到zein乳液并不稳定,并在几分钟快速聚结,这可能是由于ZCP颗粒间的疏水吸引[24]。加入PGA后,乳液的物理稳定性大大提高,且PGA浓度越高,液滴粒径越小,乳液越均匀。所以,由于先加入ZCP的Pickering乳液中的液滴易于聚结,所以可以通过LBL技术对其进行稳定。

图6 ZCP和PGA共稳定的双层乳液和zein乳液的光学显微镜图像Fig.6 Optical microscope images of zein-based Pickering emulsion and bilayer emulsions co-stabilized by ZCP and PGA
当PGA浓度从0.1%增加到1.5%,双层乳液液滴的粒径减小,并且逐渐形成网络结构,说明具有较高浓度PGA的双层乳液中PGA所占体积分数也较大,因此乳液液滴彼此非常紧密并且具备较高的弹性模量[25]。乳化层中液滴的紧密堆积以及网络结构的形成,导致了凝胶状流变特性的体现[26]。
2.4.2 CLSM观察 使用CLSM来观察由ZCP和PGA稳定的双层乳液的界面结构,如图7所示,MCT为红色,ZCP为蓝色。图7A显示了zein乳液的微观结构,液滴不均匀且较大,液滴有明显的聚结现象,这种现象是由于玉米醇溶蛋白的润湿性不足,以及ZCP之间的疏水效应而导致了液滴的聚结,说明了zein乳液的不稳定性。相反,可以在图7B在观察到Z/P双层乳液中均匀的液滴和外层蛋白网络。说明外层PGA的添加促进了更加紧密的界面的形成。就P/Z双层乳液而言,虽然其液滴大小也较为均匀,但并没有形成连续的蛋白网络(图7C)。PGA作为内层,虽然减小了液滴的粒径,但也增加了比表面积,导致ZCP外层的不完全覆盖。

图7 由zein(A)、ZCP/PGA双层乳液(B)(1.5% w/v)和PGA/ZCP双层乳液(C)(1.5%,w/v)稳定的Pickering乳液的CLSM图像Fig.7 CLSM image of Pickering emulsion stabilized by zein(A),ZCP/PGA double emulsion(B) (1.5% w/v)and PGA/ZCP double emulsion(C)(1.5%,w/v)
3 结论
在本研究中,采用LBL静电沉积技术制备了ZCP和PGA稳定的新型双层乳液。与仅由zein稳定的Pickering乳液相比,双层乳液因其独特的颗粒-多糖双层结构而具有更好的稳定性,不易分层和聚结。随液滴表面PGA的浓度的增大,双层乳液液滴的粒径逐渐减小,形成三维网络结构,双层乳液的稳定性不断提高。不同的加入顺序对双层乳液的微观结构有重要影响,PGA具有更好的乳化性,随PGA浓度的升高,先加入PGA的双层乳液具有更小的液滴粒径。但是,ZCP和PGA在液滴界面中的共存,阻碍了双层乳液的稳定和网络结构的形成,从而使双层乳液具有凝胶性质。本文将界面工程技术、Pickering乳液和双层乳液三者结合,设计了由ZCP和PGA稳定的双层乳液。可以预想,这种由颗粒和乳化剂共同稳定的新型双层乳液会因其较好的稳定性和可控的界面性质在生物活性组分的递送方面展现出巨大的优越性。
