基于磁性纳米材料和适配体的荧光传感器检测牛奶中黄曲霉毒素M1
2019-03-28郭婷林淑凤马良谭红霞张宇昊
郭婷,林淑凤,马良,谭红霞,张宇昊
(西南大学 食品科学学院,重庆,400715)
目前,乳及乳制品受到黄曲霉毒素M1(aflatoxin M1, AFM1)污染的现象越来越严重。2011年国家质检总局抽检某批次纯牛奶AFM1超标140%;2012年广州工商局抽检发现部分幼儿奶粉AFM1含量超标;2014年国家食药监总局公布抽检的部分奶粉样品AFM1超标。AFM1是哺乳类动物摄入被黄曲霉毒素B1(aflatoxin B1, AF B1)污染的饲料后,在体内的肝微粒体单氧化酶系催化下,通过细胞色素P-448调节作用,其末端呋喃环C-10被羟化而生成AFM1存在于动物分泌的乳汁和尿液中,以乳中最为常见[1]。AFM1被世界卫生组织列为I类致癌物,具有强致癌性和致突变性。中国、美国等国家规定乳及乳制品中AFM1最大限量为0.5 μg/kg[2],欧盟规定生乳中AFM1的最大限量为0.05 μg/kg,婴儿配方乳粉中为0.025 μg/kg[3]。
目前AFM1检测方法主要有高效液相色谱法(high performance liquid chromatography,HPLC)[4-9]、免疫亲和层析法(immunoaffinity chromatography,IAC)[10-12]、酶联免疫吸附法(enzyme linked immune sorbent assay,ELISA)[13-14]等。其中色谱检测方法灵敏,稳定性强,但样品前处理复杂,成本高,不能满足目前食品安全快速检测的要求。ELISA法操作简便、用时短,但抗体的制备周期较长且稳定性差。与其相比,适配体可体外合成,稳定性好,在食品安全检测领域显示了巨大的应用前景。
近年来,越来越多的科研工作者构建基于适配体的传感器[15-18]。YANG等[19]使用未修饰的金纳米粒子(AuNPs)作为指示剂,实现对赭曲霉毒素(ochratoxin,OTA)的快速检测。当工作液中没有OTA时,适配体吸附在AuNPs表面,在盐溶液中保护AuNPs,未发生聚集现象,溶液为红色。当加入OTA后,适配体与OTA结合从而构象变化形成G-四联体结构,而AuNPs在在盐诱导下发生聚集导致颜色变化。BONEL等[20]开发了一种竞争性电化学传感器用来检测OTA。对辣根过氧化物酶(horseradish peroxidase, HRP)的活性反应进行检测,根据活性变化检测OTA。GUO等[21]利用PCR技术结合适配体实现了AFB1的痕量检测,检测限为25 fg/mL。
荧光传感器因其简便、高灵敏、快速等优点而被广泛的应用于检测领域[22-26]。随着纳米技术的快速发展,越来越多的纳米材料(石墨烯、碳纳米管、二硫化物等[27-32])应用在荧光传感器方面。GUO等[33]开发一种基于单壁碳纳米管(single-walled carbon nanotubes, SWNTs)的荧光传感器用于检测OTA。利用荧光染料修饰适配体,SWNTs对染料具有很强的猝灭效果;但当加入OTA时,其与适配体结合,使得适配体从SWNTs表面释放下来,荧光恢复。LV等[34]在以上实验基础上利用DNA酶进行信号放大,进一步提高了检测的灵敏度。然而,在实际荧光检测过程中,工作液中混合纳米材料及目标物等多种物质,纳米材料的存在增加本底值的干扰,影响检测灵敏度。
磁性纳米材料因其较大的比表面积、磁性分离效果等特性,受到越来越多的科研工作者关注[35-37]。目前,使用Fe3O4磁性纳米颗粒作为荧光猝灭剂的传感平台研究报道较少。本研究以AFM1为目标物,FAM修饰的适配体为识别元件,利用磁性纳米材料的猝灭性及磁分离性能,构建基于适配体和磁性纳米材料的荧光传感器。检测机理如图1所示,FAM-适配体吸附在Fe3O4表面发生能量共振转移,造成FAM-适配体的荧光猝灭;当体系中加入AFM1时,FAM-适配体与AFM1结合,FAM-适配体从Fe3O4表面脱附,荧光恢复。

图1 传感器的传感机理Fig.1 Illustration of sensor
1 材料与方法
1.1 仪器与试剂
紫外分光光度计(UV-2450),日本岛津公司;荧光分光光度计(F-2500),日本日立公司;台式高速离心机,德国Eppendorf公司; 透射电子显微镜(JEM-1200EX),日本电子株式会社。
FAM-适配体(5′-ACT GCT AGA GAT TTT CCA CAT-3′),生工生物工程(上海)有限公司;Tris,赛国生物科技有限责任公司;HCl,重庆川东化工有限公司;FeCl3·6H2O,氨水、甲醇、NaCl、乙腈、二氯甲烷,成都市科龙化工有限公司; FeCl2·4H2O,天津市大茂化学试剂厂; AFM1、AFB1、展青霉毒素(PAT)、脱氧雪腐镰刀菌烯醇(DON)、单端孢霉烯(T-2)毒素标准品,美国Sigma公司;纯牛奶,购于本地超市,250 mL;营养奶粉,购于本地超市,400 g;脱脂牛奶,购于本地超市,1 L。
1.2 试验方法
1.2.1 Fe3O4磁性纳米颗粒的合成
采用液相共沉淀法制备Fe3O4磁性纳米颗粒,将12.16 g FeCl3·6H2O与4.97 g FeCl2·4H2O溶解于200 mL蒸馏水中,剧烈搅拌并缓慢加入氨水,调节pH至9.0左右,于80 ℃熟化30 min得到Fe3O4粒子黑色溶液,用永磁体收集并用超纯水和乙醇交替洗涤后冷冻干燥,得到干燥黑色固体粉末。
1.2.2 DNA浓度测定
DNA浓度以单链浓度表示,利用紫外-可见分光光度计测定DNA在260 nm处的吸光度,依据朗伯比尔定律(A=εbc)计算得DNA的浓度,配置成100 nmol/L(Tris-HCl pH 8.0)的溶液,于-20 ℃备用。
1.2.3 荧光传感器对AFM1的检测
DNA备用溶液解冻后,水浴90 ℃处理10 min,逐渐冷却至室温备用。将Fe3O4溶液加入工作液(100 nmol/L DNA溶液)中,再将一定浓度的FAM1加入工作液中作用20 min,利用磁铁分离。取清液测定荧光光谱(激发波长480 nm)。
1.2.4 实际样品中AFM1的检测
向样品中加入一定量的AFM1,分别配成质量浓度为0.25、0.50、0.75 μg/L的阳性样本。(1)液体样品:取5 mL液态样品(纯牛奶和脱脂牛奶)置于离心管中,加入10 mL甲醇和0.5 g NaCl后旋涡振荡混匀30 s,在37℃下超声5 min,离心后取上清液过0.22 μm有机微孔滤膜得一定体积微萃取工作液;(2)固体样品:称取1 g固体样品(奶粉)置于离心管中,加入5 mL水,旋涡混匀后,加入10 mL甲醇和0.5 g NaCl并旋涡振荡混匀30 s,在37 ℃下超声5 min,离心后取上清液过0.22 μm有机微孔滤膜得一定体积微萃取工作液。将1 mL微萃取工作液、200 μL分散剂乙腈和60 μL萃取剂二氯甲烷加入离心管中,旋涡混匀成均匀的乳浊液,静置1 min,离心后抽取下层有机相CH2Cl230 μL于试管中,37 ℃水浴氮吹。将干燥物溶解于Tris-HCl缓冲液中制成样品溶液。然后按照构建的荧光传感器检测。另外,根据国家标准采用液相色谱法进行方法对照实验。
2 结果与讨论
2.1 Fe3O4磁性纳米颗粒的制备及表征
采用液相共沉淀法制Fe3O4磁性纳米颗粒的反应原理如下:
Fe2++2Fe3++8OH-=Fe3O4+4H2O
Fe2+与Fe3+在碱性条件下高温处理,合成黑色Fe3O4磁性纳米颗粒。利用透射电子显微镜对其进行表征,具体表征结果如图2-A所示。结果显示该方法制备的Fe3O4粒径约为8~15 nm。图2-B显示Fe3O4的磁滞回归线,说明该Fe3O4具有良好的磁分离能力,能够快速完成分离效果。

图2 Fe3O4磁性纳米颗粒的透射电镜图(A)和磁滞回归线(B)Fig.2 TEM images(A) and magnetization curves of Fe3O4(B)
2.2 检测原理
本研究以AFM1为研究对象,构建荧光传感器。将染料FAM修饰在适配体的一端,其荧光光谱图如图3曲线a。加入Fe3O4溶液后,FAM-适配体通过静电相互作用吸附在Fe3O4表面,Fe3O4与FAM-适配体发生荧光共振能量转移,荧光信号猝灭,如图3曲线d所示;当体系中加入AFM1时,FAM-适配体与AFM1识别并形成一定结构,致使FAM-适配体从Fe3O4表面脱附,荧光信号恢复,如图3中曲线c所示。
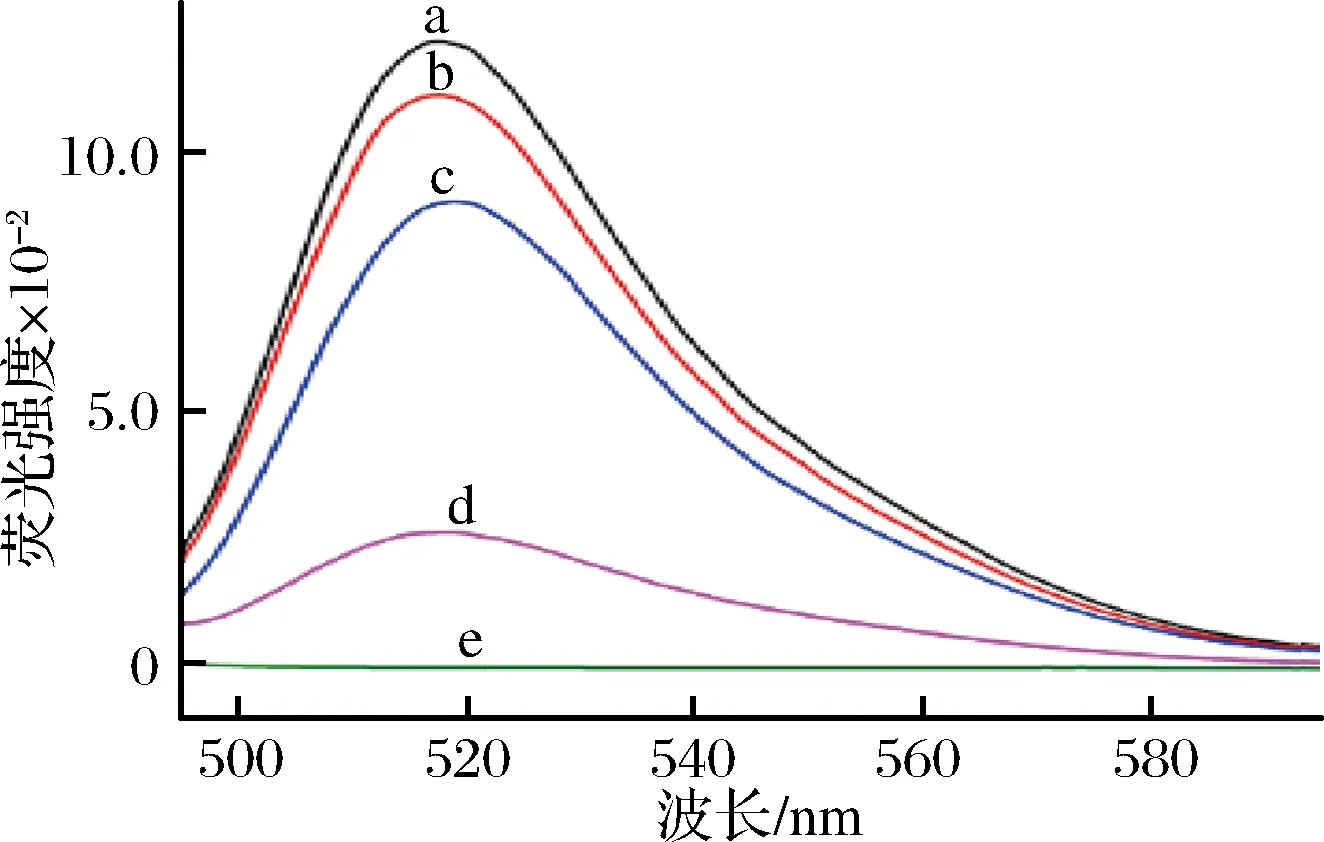
a-FAM-适配体;b-FAM-适配体+AFM1;c-FAM-适配体+Fe3O4+AFM1;d-FAM-适配体+Fe3O4;e-AFM1图3 不同条件下荧光光谱Fig.3 Fluorescence spectra under different conditions
因此,可以通过检测荧光信号强弱与体系中AFM1的浓度的关系,实现AFM1的定量检测。
2.3 检测条件优化
2.3.1 Fe3O4浓度
Fe3O4与FAM-适配体浓度比例在很大程度上影响会影响荧光传感器的灵敏度,因此考察二者的浓度比显得十分重要。如图4所示,含有100 nmol/L的FAM-适配体的缓冲溶液中,荧光强度随Fe3O4浓度的增加而急剧降低,当Fe3O4质量浓度到达0.35 mg/mL时,荧光强度趋于稳定,当Fe3O4质量浓度继续增加时,对FAM-适配体荧光的猝灭效果没有显著影响,且过量的Fe3O4会降低传感器的灵敏度。因此,选用0.35 mg/mL作为在后续实验中Fe3O4浓度。
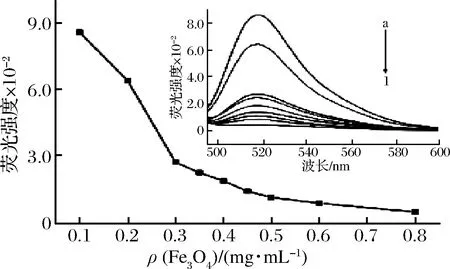
不同质量浓度Fe3O4下FAM-适配体的荧光光谱(a-0.1、b-0.2、c-0.3、d-0.35、e-0.4、f-0.45、g-0.5、h-0.6、i-0.8 mg/mL)图4 不同质量浓度Fe3O4对体系荧光强度的影响Fig.4 Effect of different concentrations of Fe3O4 on the fluorescence
2.3.2 荧光恢复时间
实验中添加AFM1后需要孵育一段时间才能引起荧光信号恢复,本实验研究了孵育时间0~80 min的荧光恢复情况。如图5所示,随着FAM-适配体和AFM1孵育时间的延长,荧光强度逐渐增加,20 min后趋于稳定。因此本研究选择20 min最佳荧光恢复时间。

插图:不同孵育时间对应的FAM-适配体(100 nmol/L)的荧光光谱(a-80、b-60、c-50、d-40、e-30、f-20、g-15、h-10、i-5、j-0 min)图5 不同孵育时间对荧光恢复的影响Fig.5 Effect of incubation time on fluorescence intensity
2.4 荧光传感器的构建
在上述优化实验条件下,以AFM1为目标构建荧光传感器。在荧光传感器中,加入不同浓度AFM1溶液。研究发现,在一定浓度范围内,随着AFM1质量浓度的增大,AFM1与更多的FAM-适配体结合,脱离Fe3O4,荧光强度逐渐恢复,如图6所示。然而,当AFM1的质量浓度达到一定值时,荧光强度不再明显增加,达到平衡。荧光强度与AFM1质量浓度范围在0.05~0.70 μg/L范围内呈线性关系,检出限为0.02 μg/L。

AFM1质量浓度a-0.05、b-0.1、c-0.2、d-0.3、e-0.4、f-0.5、g-0.6、h-0.7、i-0.8、j-0.9、k-1.0 μg/L图6 不同浓度AFM1对所构建传感器荧光响应变化(A)和荧光与AFM1浓度的线性关系(B)Fig.6 Fluorescence spectrum of sensor with different concentrations of AFM1(A) and relationship between F and concentrations of AFM1(B)
2.5 荧光传感器选择性
为了研究荧光传感器的选择性,本研究以AFB1、OTA、DON、PAT、T-2为对象考察该传感器的特异性。结果如图7所示,当加入0.5 μg/L AFM1时,荧光强度显著增加。加入10 μg/L对照毒素时荧光强度没有出现明显增强。结果表明本研究所构建的传感器对AFM1有较好的特异性。

图7 方法选择性Fig.7 Selectively of sensing systemAFM1质量浓度为0.5 μg/L,其他对照毒素质量浓度均为10 μg/L
2.6 实际样品测定
为了考察传感器实际测定效果,我们以纯牛奶、脱脂牛奶和奶粉作为实际阴性样品,研究加标回收情况,并用液相色谱法进行对照实验。结果如表1所示,利用传感器检测的加标回收率在82.5%~102.3%的范围内,这说明该荧光传感器可用于真实复杂样品中AFM1的测定。
3 结论
本研究构建一种基于适配体和磁性纳米材料的荧光传感器,可用于高灵敏度、高特异性检测AFM1。在最优条件下,传感器的线性范围0.05~0.70 μg/L,检测限为0.02 μg/L。且在实际样品检测中同样表现出较好的效果,说明本检测方法在食品安全检测中具有较强的实用性。为开发快速、灵敏和高选择性的食品安全生物传感器开辟了新的途径。
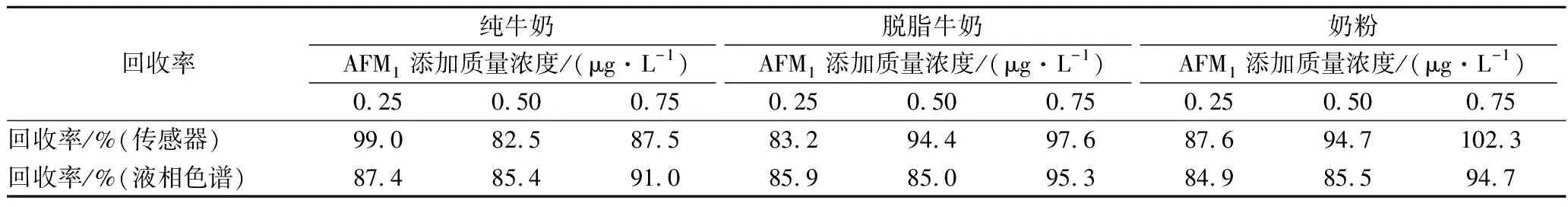
表1 实际样品加标回收率(n=3)Table 1 Real sample spike recovery (n=3)
