米曲霉AAP新基因的异源表达及其酶学性质研究
2019-03-28宋婷婷吴珍珍宗红陆信曜诸葛斌
宋婷婷,吴珍珍,宗红,陆信曜,诸葛斌*
1(糖化学与生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 2(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122) 3(江南大学 生物工程学院,工业微生物研究中心,江苏 无锡,214122)
米曲霉(Aspergillusoryzae)具有强大的蛋白分泌能力和公认的食品安全性,是传统豆酱、酱油等酿造工业的重要菌株[1],其分泌的蛋白酶能够将蛋白质水解成多肽及氨基酸,增强酿造食品的味道和风味[2-3]。由于长期受到高蛋白环境的驯化,米曲霉产生的蛋白酶对植物蛋白有较高的水解能力,同时可有效减轻大豆蛋白水解产物的苦味[4-5]。2005年,日本科学家完成了米曲霉RIB40全基因组序列的测序[6-7],为深刻理解米曲霉的遗传背景和生产性能、快速挖掘其作为工业生产菌株的潜能提供了丰富可靠的遗传信息。
蛋白质水解液的苦味是由多肽链末端的疏水性氨基酸引起的[8],氨肽酶作为蛋白酶中肽链外切酶的一种,可以从蛋白质或多肽链的N端水解氨基酸,使氨基酸呈游离状态,从而达到脱苦的目的[9-10]。目前已有多种细菌和真菌来源的氨肽酶被分离纯化或者异源表达,并被用于脱苦蛋白质水解液。黄伟谦等在毕赤酵母GS115中表达了来自酱油曲霉的亮氨酸氨肽酶,将其应用于大豆蛋白及酪蛋白酶解液中的苦味肽,发现苦味肽的苦味值分别下降了59.62%及64.18%,且游离氨基酸含量显著提高[11];雷芬芬等将从海洋地衣芽孢杆菌SWJS33中分离纯化出的氨肽酶与木瓜蛋白的碱性蛋白酶水解液作用,脱苦效果十分显著[12];而天冬酰胺氨肽酶可以从N端水解释放谷氨酸和天冬氨酸,而这两种氨基酸是鲜味氨基酸,具有低阈值的苦味,可以降低蛋白质水解液的苦味[13-15]。
本研究前期通过生物信息预测,挖掘出4个米曲霉疑似短肽酶的基因,其中只有天冬酰胺氨肽酶具有功能,并将新基因克隆到毕赤酵母中进行分泌表达,对其酶学性质进行研究,并应用于大豆多肽水解液中,进一步探讨该酶在食品脱苦中的应用。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
米曲霉CGMCC No.7586、大肠杆菌JM109、毕赤酵母GS115、质粒pPIC9K均保藏于本研究室。
1.1.2 主要试剂
限制性核酸内切酶、ExTaqDNA聚合酶及T4DNA连接酶,宝生物工程(大连)有限公司(Takara);Trizol试剂、反转录试剂盒,康为世纪科技有限公司;遗传霉素(G418)、酵母无氨基氮源(yeast nitrogen base,YNB),上海宝赛生物科技有限公司;多肽底物由常州康龙生物科技有限公司合成;其他试剂均为国产分析纯。
1.1.3 培养基
PDA(g/L):蔗糖20,马铃薯200,琼脂粉20;
LB(g/L):酵母粉5,蛋白胨10,氯化钠10,固体培养基中添加20琼脂粉;
YPD(g/L):酵母粉10,蛋白胨20,葡萄糖20,固体培养基中添加20琼脂粉;
脱脂牛奶培养基(g/L):YNB 13.4,生物素0.4 mg/L,甲醇体积分数为1%,脱脂奶粉20,琼脂粉20。
MD(g/L):YNB 13.4,葡萄糖20,生物素0.4 mg/L,琼脂粉20;
BMGY(g/L):酵母粉10,蛋白胨20,甘油10,YNB 13.4,生物素0.4 mg/L,0.1 mmol/L pH值为6.0磷酸钾缓冲液;
BMMY(g/L):酵母粉10,蛋白胨20,YNB 13.4,生物素0.4 mg/L,0.1 mmol/L pH值为6.0磷酸钾缓冲液,甲醇体积分数1%;
YPD-G418:在YPD中添加终质量浓度分别为1、2、3、4 mg/mL的G418,用于阳性转化子拷贝数的筛选。
1.1.4 引物的设计
根据GeneBank中公布的米曲霉RIB40的AAP基因序列设计引物,引物设计见表1。其中,上游引物F引入EcoRⅠ酶切位点,下游引物R引入NotⅠ酶切位点和6×His标签。

表1 本研究中使用的引物Table 1 Primers used in this study
1.2 方法
1.2.1 米曲霉AAP的生物信息学分析
利用NCBI-Blast、SWISS-MODEL、SignalP4.1等生物信息学分析工具,对米曲霉AAP的基本理化性质、序列特征、结构域、二级结构及三级结构等进行分析和预测。
1.2.2 目的基因的克隆及重组表达载体的构建
米曲霉RNA的提取及cDNA的合成按照试剂盒说明书进行。以米曲霉cDNA为模板,PCR扩增获得目的基因片段。将目的基因片段和质粒pPIC9K分别用EcoRⅠ和NotⅠ进行酶切,纯化回收后,用T4DNA连接酶将目的基因与载体连接,16 ℃保温过夜,转化至EscherichiacoliJM109感受态细胞中,将转化后的菌液涂布于含有Amp的LB固体平板中,37 ℃培养12 h。提取菌落PCR验证为阳性菌株的质粒,分别进行双酶切及测序验证。
1.2.3 重组毕赤酵母的构建及诱导表达
将重组质粒用SacⅠ线性化,纯化回收后电击转化至毕赤酵母GS115感受态细胞中,将转化后的菌液涂布于MD平板上,30 ℃培养2~3 d。挑取MD平板上长出的单菌落至YPD-G418梯度抗性平板上,在含质量浓度为4 mg/mL G418 YPD平板上挑取5个单菌落进行摇瓶发酵。
种子培养:将单菌落接种于YPD培养基中,30 ℃,200 r/min条件下培养18~20 h。
发酵培养:按1%的接种量接种至装有50 mL BMGY培养液的500 mL三角瓶中,30 ℃,200 r/min条件下培养24 h,收集发酵液并离心,将菌体转移至BMMY培养基中,按体积分数为1%的甲醇添加量,在30 ℃,200 r/min条件下诱导产酶。此后每隔24 h添加体积分数为1%的甲醇,同时取样测酶活并进行SDS-PAGE蛋白电泳及平板鉴定。
1.2.4 重组AAP的纯化
收集发酵液,离心取上清,即为粗酶液。用His Trap HP亲和色谱柱对粗酶液进行纯化,将纯化后的酶液于4 ℃保存备用。其中,纯化缓冲液A为0.5 mol/L NaCl,0.02 mol/L Na2PO4,0.02 mol/L咪唑,pH值为7.4;缓冲液B为0.5 mol/L NaCl,0.02 mol/L Na2PO4,0.5 mol/L咪唑,pH值为7.4。
1.2.5 重组AAP酶活的测定
将20 μL酶液和160 μL pH值为8.0的Tris-HCl缓冲液混匀,50 ℃预热2 min,再加入20 μL 10 mmol/L的Asp-pNA溶液,50 ℃水浴反应10 min。反应结束后立即加入200 μL体积分数为40%的乙酸终止反应,在405 nm处测定吸光值。
酶活的定义:在一定pH值,50 ℃条件下,每分钟水解Asp-pNA生成1 μgpNA所用的酶量为1个酶活力单位(U/mL)。

(1)
式中,U表示酶活,U/mL;n表示酶液的稀释倍数;20表示反应总体系对酶液的稀释倍数;138.12表示pNA的相对分子质量;A表示根据酶活反应测得的A405 nm的值,查标准曲线得到的pNA的浓度,mmol/L;10表示反应时间,min。
1.2.6 重组AAP的酶学性质研究
(1)最适pH及pH稳定性:在pH 3.0~10.0(pH 3.0~8.0 20 mmol/L柠檬酸-磷酸氢二钠缓冲液,pH 8.0~10.0 20 mmol/L Tris-HCl缓冲液)条件下测定酶活,最高酶活值为100%;将酶分别在pH 3.0~10.0条件下40 ℃保温1 h后检测蛋白酶的pH稳定性。
(2)最适温度及温度稳定性:在不同温度(30~70 ℃)条件下测定酶活,最高酶活值为100%;将酶分别在40~70 ℃条件下保温30、60、90、120 min后检测蛋白酶的温度稳定性。
(3)金属离子及抑制剂对重组AAP活性的影响:向反应体系中加入终浓度为10 mmol/L的金属离子(Fe2+、Ca2+、Zn2+、Be2+、Mg2+、Mn2+、K+),测定酶活,未加入金属离子的酶活值为100%;向反应体系中加入终浓度为1 mmol/L的碘乙酰胺(iodoacetamide,IAM)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、苯甲基碘酰氟(phenylmethylsulfonyl fluoride,PMSF)、胃蛋白酶抑制剂(pepstain),测定酶活。未加入抑制剂的酶活值为100%。
(4)底物特异性及动力学参数的测定:向反应体系中加入不同的底物(Asp-pNA、Pro-pNA、Asn-pNA、Glu-pNA、Tyr-pNA、Leu-pNA),测定酶活,最高酶活值为100%;向反应体系中加入不同的Asp-pNA浓度(0.2~10 mmol/L),测定酶活,采用Lineweaver-BurK法作图,计算其Km及Vmax。
1.2.7 重组AAP对大豆多肽的水解
用50 mmol/L pH值为7.0的磷酸缓冲液配制质量分数为10%的大豆蛋白,沸水浴中热处理15 min后冷却至室温,按酶与底物比(E/S)为5 000 U/g加入碱性蛋白酶,在其最适反应条件(pH值为10.0,温度50 ℃)下保温6 h,反应期间用0.1 mol/L的NaOH维持反应体系的pH。反应结束后沸水浴10 min使酶灭活,离心取上清,即得到大豆多肽溶液,于-20 ℃保存备用。以E/S分别为1 000、4 000、8 000 U/g向大豆多肽溶液中加入重组蛋白酶,在其最适反应条件(pH值为7.0,温度50 ℃)下按照同样的方法进行酶解。采用OPA(邻苯二甲醛)法测定水解液的水解度[13],并以不同浓度的咖啡因作为标准对苦味进行感官评定[11, 16-17]。
2 结果与分析
2.1 米曲霉AAP基因的克隆及生物信息学分析
根据GeneBank中公布的米曲霉RIB40的AAP基因序列设计引物,以提取的米曲霉RNA为模板合成cDNA,以cDNA为模板,PCR扩增获得目的基因片段,电泳结果如图1所示,获得1条约1.5 kbp左右的条带,与目的基因大小相符。由测序结果及Blast序列比对得知,该基因序列与米曲酶RIB40的AAP基因序列同源,氨基酸序列相似性达99.7%。
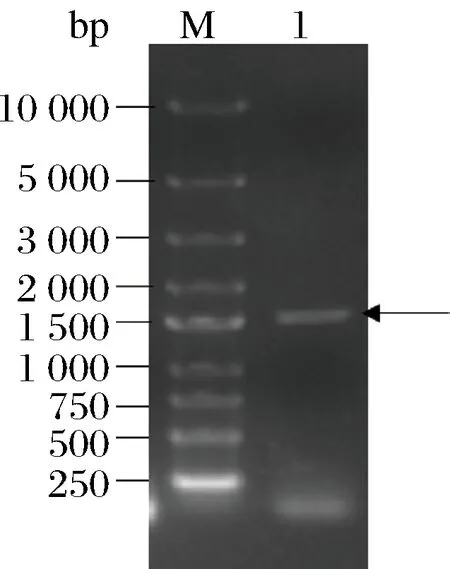
M-DL2503 Marker;1-AAP基因PCR产物图1 AAP基因PCR结果电泳图Fig.1 Electrophoretogram of AAP gene
对该基因进行基本理化性质预测,发现其存在信号肽序列,信号肽剪切位点位于第22~23位氨基酸之间,该基因编码498个氨基酸,其编码的蛋白质理论分子质量为53.9 kDa,等电点为5.94,存在糖基化及磷酸化位点,二级结构中含有33.94%的α-螺旋,5.62%的β-折叠,16.87%的延伸连,43.57%的无规则卷曲。结构域预测发现该基因编码的蛋白质属于氨肽酶M18家族,特异性切割末端氨基酸残基为酸性氨基酸的肽键。其活性位点具有2个催化Zn2+,由His91、Asp274、Glu312、Asp363、His463结合,其中Asp274连接2个Zn2+。以人天冬酰胺氨肽酶(human aspartly aminopeptidase,DNPEP)为模板进行同源建模,结果如图2所示。

图2 三级结构预测Fig.2 Prediction of the 3D structure
将该基因编码的氨基酸序列与GenBank中收录的来源于人、牛、酵母的天冬酰胺氨肽酶氨基酸序列进行同源性序列比对,一致性分别达到49%、51%、53%,比对结果如图3所示。据报道,来源于人的天冬酰胺氨肽酶有类似的结构,其活性中心存在Zn2+,由5个相同的氨基酸组成,分别为His94,Asp264,Glu302,Asp346和His440,其中Asp264连接2个Zn2+[18]。这5个金属配位残基在M18家族成员中形成严格保守的“H.D.E.D.H”特征。

图3 不同来源的天冬酰胺氨肽酶的氨基酸序列比对结果Fig.3 Amino acids sequence alignment of aspartyl aminopeptidase
2.2 重组毕赤酵母的构建及诱导表达
将目的基因连接至表达载体pPIC9K上,获得重组质粒pPIC9K/AAP,然后用EcoRⅠ和NotⅠ进行双酶切验证。如图4所示,获得1.5 kbp左右的目的基因片段和9.3 kbp左右的载体片段,与理论值相符。将重组质粒进一步测序,验证正确,表明重组质粒构建成功。质粒构建流程如图5所示。
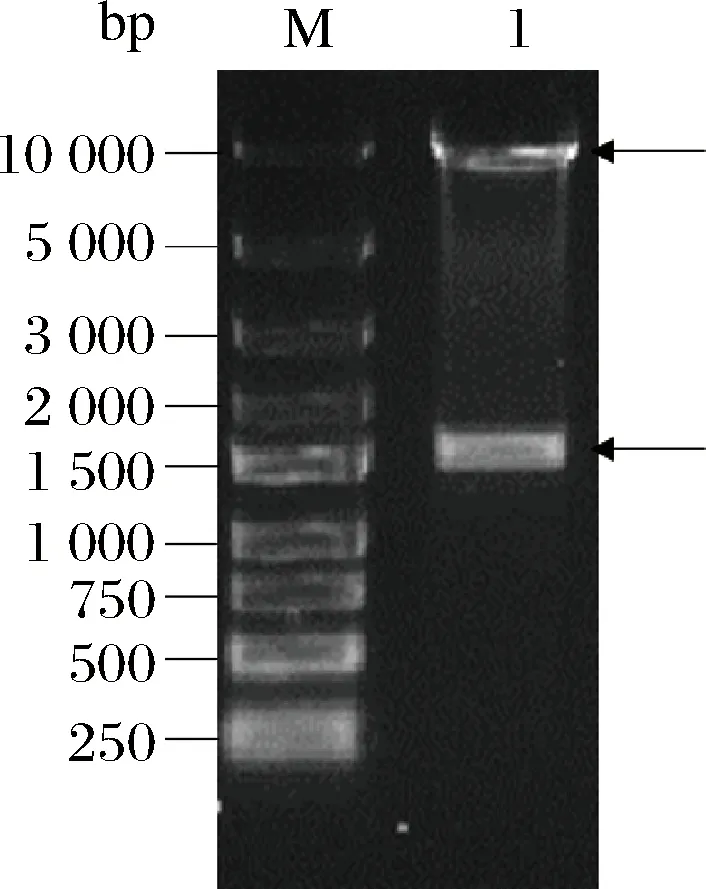
M-DL2503 Marker;1-pPIC9K/AAP双酶切产物图4 pPIC9K/AAP双酶切产物电泳图Fig.4 Electrophoretogram of pPIC9K/AAP product
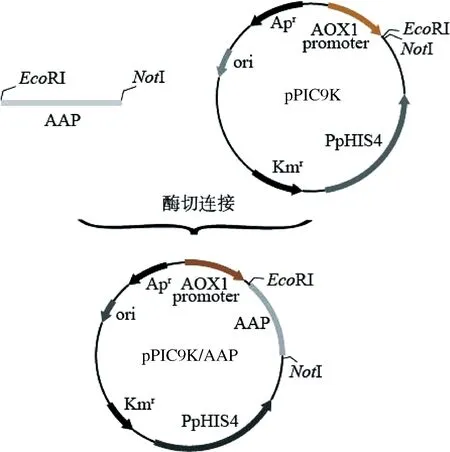
图5 pPIC9K/AAP构建示意图Fig.5 Construction of pPIC9K/AAP
将重组质粒pPIC9K/AAP用SacⅠ线性化后电击转化至毕赤酵母GS115中,通过不同浓度的G418抗性平板筛选阳性转化子,获得重组毕赤酵母工程菌,每隔24 h用甲醇对重组毕赤酵母进行诱导表达,其发酵液上清SDS-PAGE电泳图如图6所示。毕赤酵母可直接将外源蛋白分泌至胞外,如图7所示,将重组蛋白酶的发酵上清液点接至脱脂奶粉平板上,其发酵液周围形成明显的蛋白水解圈,说明重组菌具有蛋白酶活性。酶活测定结果如图8所示,重组蛋白酶在诱导第4天酶活达到最高,为 21.5 U/mL,此时菌体量也达到最高,OD600约为36.1。

M-蛋白质Marker;1-重组蛋白酶发酵液上清图6 重组菌发酵液上清SDS-PAGEFig.6 SDA-PAGE of supernatant protein

图7 平板透明圈鉴定重组蛋白酶Fig.7 Transparent circle of recombinant protease
2.3 重组AAP的纯化
收集发酵液上清,利用镍柱对发酵液进行纯化。经计算,纯化倍数和回收率分别为2.89倍和30.2%。将纯化后的重组蛋白酶进行SDS-PAGE蛋白电泳,结果如图9所示。该酶相对分子质量约为54 kDa,与根据氨基酸序列预测的相对分子质量相符,其纯度也已达到后续实验的要求。

图8 重组蛋白酶的摇瓶发酵Fig.8 Shake flask fermentation of recombinant protease
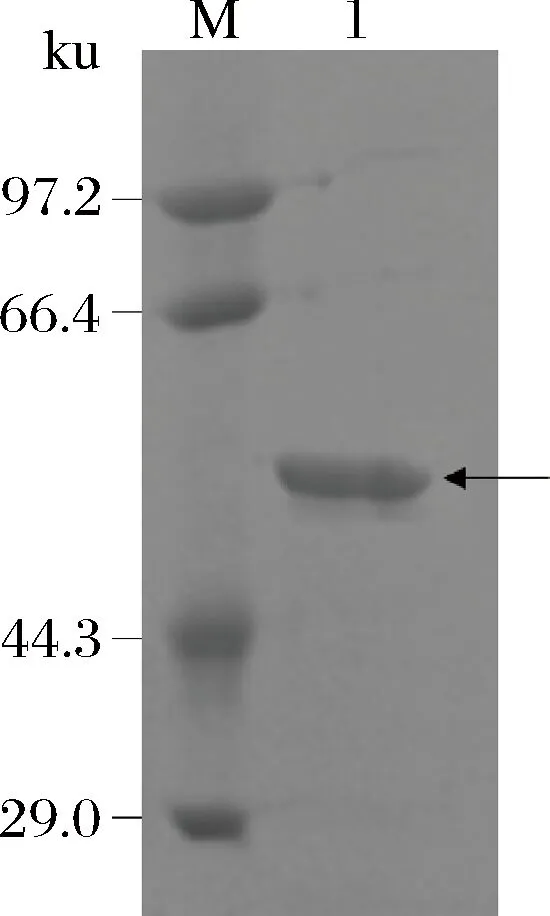
M-蛋白质Marker;1-纯化的重组蛋白酶图9 纯化的重组蛋白酶SDS-PAGE电泳图Fig.9 SDS-PAGE analysis of purified recombinant protease
2.4 重组AAP的酶学性质研究
2.4.1 最适pH、温度及稳定性
由图10-A可知,该酶的最适反应pH为7.0左右,当pH低于6.0时,酶的活性明显降低。由图10-B可知,经pH为5.5~9.5的缓冲液处理后,相对酶活仍保持在60%以上,说明该酶的pH值范围较宽广;当pH低于6.0或者9.0时,酶的稳定性迅速降低。
由图11-A可知,该酶的最适反应温度为50 ℃左右,当温度超过60 ℃时,酶的活性迅速降低。由图11-B可知,该酶在低于60 ℃时有较好的稳定性,当超过60 ℃并保温90 min以上时,酶活极不稳定,甚至活性全部丧失。
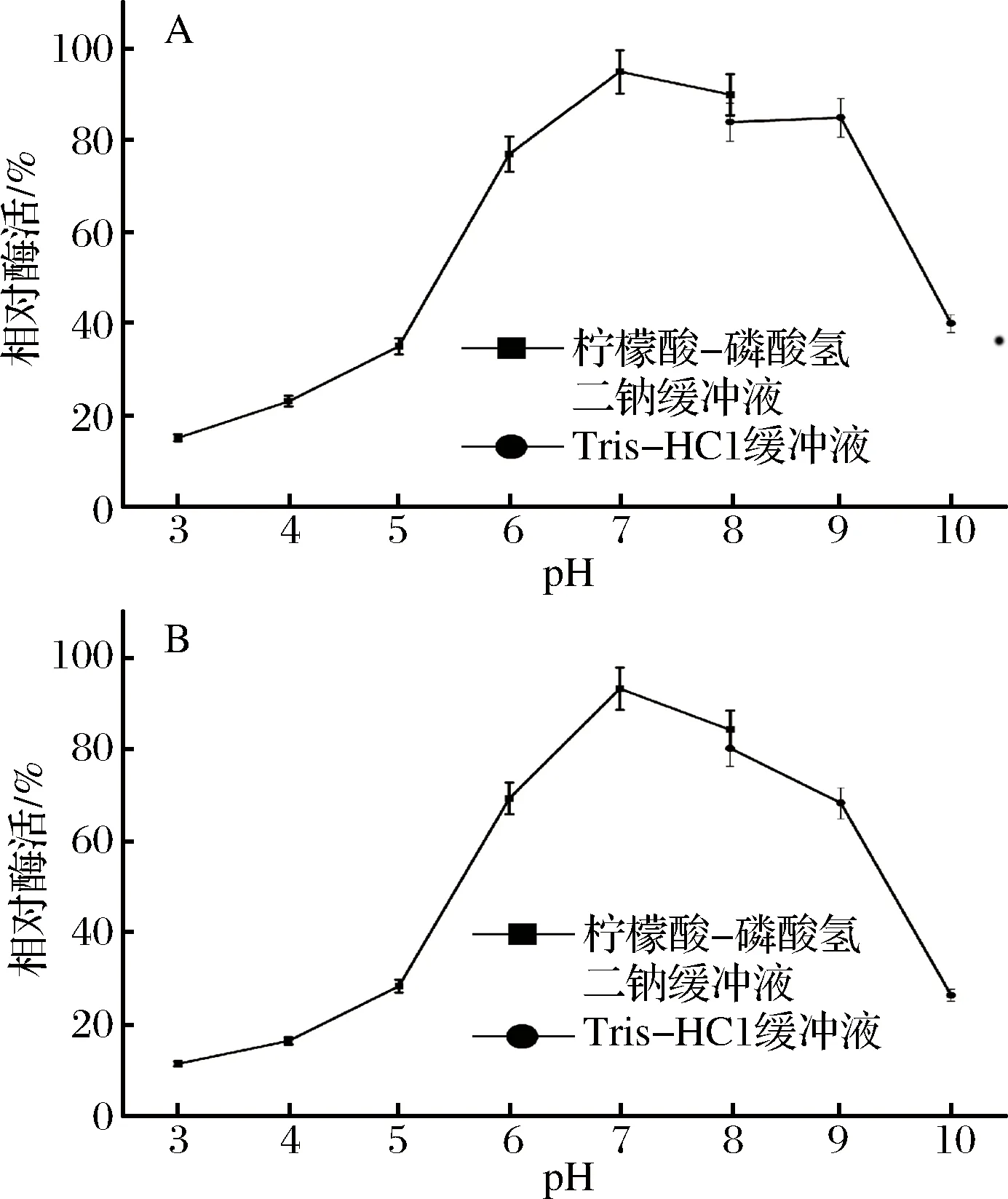
图10 pH对重组蛋白酶活性(A)及稳定性(B)的影响Fig.10 Effects of pH on the activity (A) and stability (B) of recombinant AAP
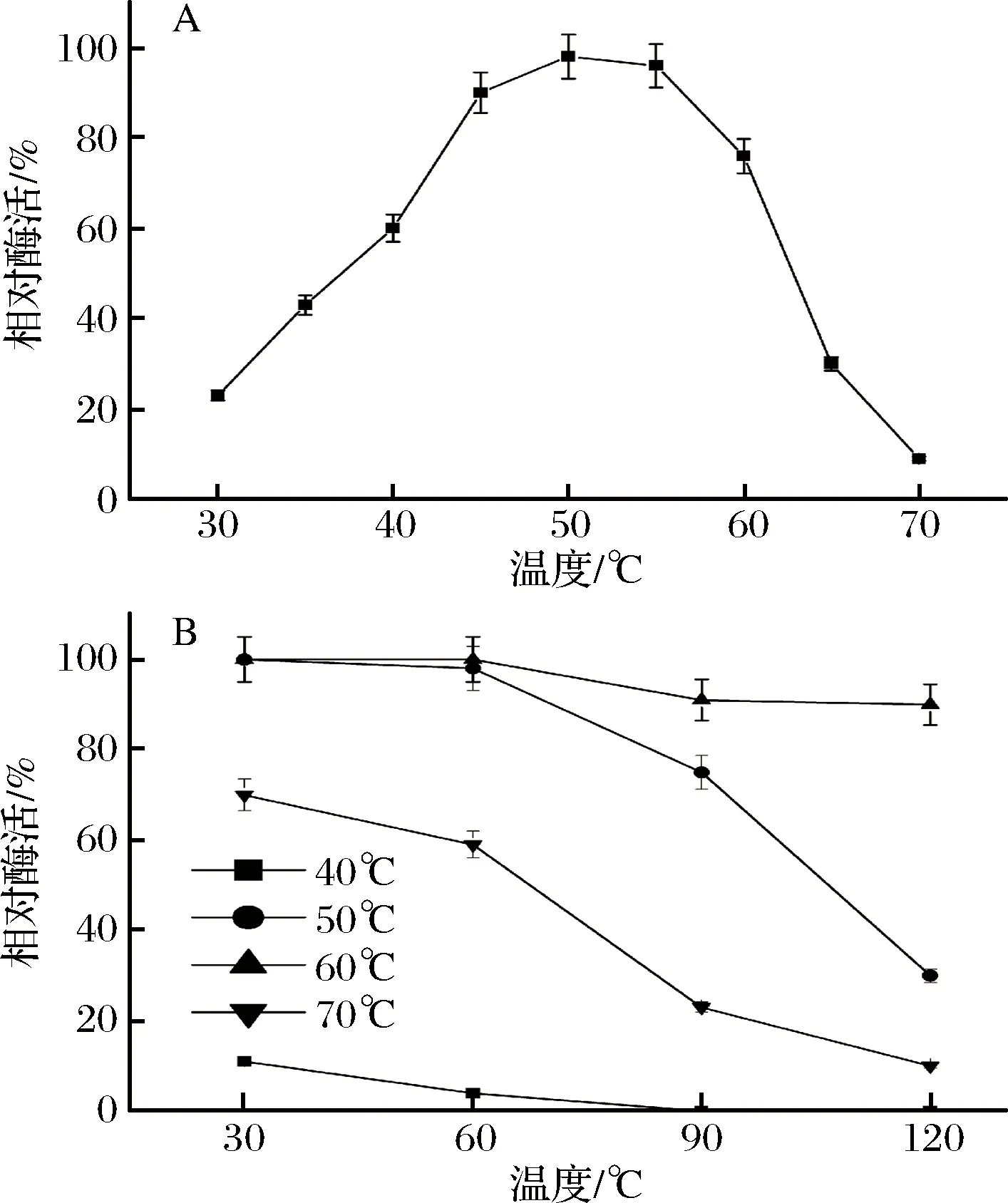
图11 温度对重组蛋白酶活性(A)及稳定性(B)的影响Fig.11 Effects of temperature on the activity (A) and stability (B) of recombinant AAP
2.4.2 金属离子及抑制剂的影响
图12可知,10 mmol/L的IAM、PMSF和Pepstatin对该酶有轻微的抑制作用,EDTA对该酶的抑制作用十分显著,推测该酶可能是一种金属蛋白酶[19]。根据报道,金属蛋白酶一般为中性蛋白酶,最适pH范围为7.0~8.0[19],这与该酶的最适反应pH偏中性的结论一致。金属蛋白酶的活性中心依赖于金属离子(大多为Zn2+)。如图12所示,添加10 mmol/L Zn2+可使AAP的相对酶活提高,这与结构域预测中该酶的活性中心存在Zn2+的结果一致;另外,Ca2+对该酶也有一定的促进作用,Fe2+、Mn2+和K+有轻微的抑制作用,Mg2+和Co2+的抑制效果不显著。

图12 金属离子及抑制剂对重组蛋白酶活性的影响Fig.12 Effects of metal ions and inhibitors on the activity of recombinant AAP

图13 重组蛋白酶的底物特异性Fig.13 Substrate specificity of recombinant AAP
2.4.3 底物特异性及动力学分析
重组蛋白酶底物特异性如图13所示,该酶只对Asp-pNA和Glu-pNA有水解作用,底物特异性较强,符合氨肽酶M18家族的水解特性,且对Asp-pNA的活性相当于对Glu-pNA活性的31%,说明该酶优先水解N末端氨基酸残基为天冬氨酸的多肽,其次水解谷氨酸,这一特性为该酶应用于大豆多肽的苦味的去除带来较大的优势。以Asp-pNA为底物,采用Lineweaver-BurK法作图,测得重组蛋白酶的Km为0.42 mmol/L,Vm为21.57 μmol/(mL·min),动力学方程为y=0.0209x+0.0438,R2=0.9932。
2.5 重组蛋白酶对大豆多肽的水解及脱苦效果
大豆蛋白经碱性蛋白酶处理后的水解度和苦味值分别为6.3%和3.3。如表2所示,当加入1 000、4 000、8 000 U/g的重组蛋白酶后,大豆多肽的水解度分别分8.5%、14.6%、20.0%,分别提高了2.2%,8.3%和13.3%。可见,重组蛋白酶可以提高大豆多肽的水解度。感官评定发现,水解液的苦味值由原来的3.9分别降低到3.3、2.4、1.9,说明重组蛋白酶对大豆多肽有较好的脱苦作用。

表2 不同浓度重组蛋白酶对大豆多肽的水解度及苦味值的影响Table 2 The degree of hydrdysis (DH) of soybean peptidesby recombinant AAP at different concentrations and theirbitterness scores
3 结论
本研究发现了源于米曲霉的天冬酰胺氨肽酶新基因AAP,并在毕赤酵母GS115中实现分泌表达,对该酶的酶学性质进行了研究,将其应用于大豆多肽的脱苦中,发现大豆多肽的苦味明显降低同时水解度升高。重组AAP的加入,不仅可以使水解液的苦味降低,而且使多肽链末端呈鲜味的天冬氨酸和谷氨酸大量释放,作为一种新型的风味酶在大豆多肽脱苦及调味品方面具有很好的应用前景,展现了其在食品行业中的应用潜力。
