miR-224在宫颈癌组织中的表达及对宫颈癌细胞增殖、侵袭和迁移的调控作用
2019-03-28陈小华孙莉娅
童 扬,姜 静*,陈小华,赵 雪,夏 雪,孙莉娅
(1四川省宜宾市第二人民医院南区妇科,宜宾 644000;2四川省宜宾市第二人民医院研究中心;3四川省宜宾市第二人民医病理科;4四川省宜宾市第二人民医院妇;*通讯作者,E-mail:914016419@qq.com)
微小RNA(miRNA,miR)是一类非编码的长约22 nt小分子RNA,通过与靶基因mRNA的3′非翻译区(3′-UTR)结合,调控靶基因表达,发挥转录后调控作用,调节如细胞分化、增殖、凋亡和肿瘤形成等多种细胞功能。某些miR的异常表达可直接作为抑癌或促癌因素,参与人类肿瘤的发生与发展[1]。有研究发现宫颈癌患者存在多种miR(miR-119b、miR-218、miR-119a)的表达异常现象,且通过调控宫颈癌的上皮间质转化(EMT)或增殖迁移能力可产生抑癌或促癌作用[2-4]。miR-224是miR家族的一员,被证实与胃癌、乳腺癌、卵巢癌的EMT及增殖、迁移密切相关,有研究报道miR-224与宫颈癌的病理特征及预后密切相关[5,6],但其在宫颈癌中的具体作用及机制仍缺乏相关报道。本研究检测了宫颈癌组织和宫颈癌细胞中miR-224表达的改变,并干扰其表达水平,以探索其对宫颈癌细胞EMT及增殖、迁移能力的影响。
1 资料与与方法
1.1 一般资料
选取于2018年1月至6月在宜宾市第二人民医院救治的宫颈癌患者24例作为研究对象,年龄36-58岁,平均年龄(45.8± 5.6)岁。纳入标准:①组织活检确诊为宫颈癌;②无其他部位恶性肿瘤;③患者及家属均知情并同意参与该研究。排除标准:①妊娠期及哺乳期患者;②既往有慢性肾病、慢性肝病患者;③合并自身免疫系统疾病的患者。本研究经我院伦理委员会批准同意。
1.2 方法
1.2.1 细胞株及主要试剂 人宫颈癌细胞株HCE1由宜宾市第二人民医院实验中心提供。兔多克隆抗体E-cadherin、N-cadherin和vimentin均购自美国Abcam公司,Cell Counting Kit-8(CCK-8)检测试剂盒购自中国碧云天公司,DMEM/F12培养基、胰蛋白酶购自美国Hyclone公司,胎牛血清购自美国Gibco公司,Trizol Reagent购自Invitrogen公司,miR逆转录试剂盒购自Thermo公司,PCR mix购自日本Toyobo公司。
1.2.2 宫颈癌细胞的增殖培养 人宫颈癌细胞株HCE1常规培养于5%的CO2饱和温度、37 ℃恒温培养箱中,培养基为含10%胎牛血清(FBS)和1%青霉素、链霉素的DMEM/F12培养基,每2-3 d用0.25%胰酶消化,以1 ∶2传代。在HCE1细胞生长稳定、呈对数期时用于实验。
1.2.3 miR-224分组与瞬时转染 miR-224的提取和反转录参照说明书进行,miR-224抑制剂采用miR-224成熟体的反向互补序列,并对所有碱基进行2′甲基修饰购自中国百奥迈科生物技术有限公司,转染步骤严格按照说明书执行。人宫颈癌细胞株HCE1接种于6孔板,加入含10% FBS的细胞培养液培养,在37 ℃ 5% CO2细胞培养箱中培养,约50%-60%融合时,采用脂质体Lipofectamine 3000方法瞬时转染。共分四组:空白组,常规培养的宫颈癌细胞;阴性对照(negative control,NC)组,转染miR-224 NC(100 nmol/ml)的宫颈癌细胞;miR-224抑制剂组,转染miR-224抑制剂(100 nmol/ml)的宫颈癌细胞;miR-224模拟剂组,转染miR-224模拟剂(100 nmol/ml)的宫颈癌细胞。严格按照脂质体法进行转染,6 h内用OMEM培养基进行培养。
1.2.4 E-cadherin、N-cadherin和vimentin水平检测 获得患者癌组织及癌旁组织,以及相应细胞系样本,均严格按照RNAgent Isolation System说明书,抽提总RNA。取1 μg总RNA,严格按照逆转录试剂盒说明书将总RNA逆转录成cDNA。PCR反应在PE公司的GeneAmp8 5700型PCR扩增仪上进行,严格按照SYBR green说明书加样,总反应体系20 μl,各样本加cDNA 2 μl;SYBR green 10 μl;商品化引物2 μl(miR-224,上海生工,中国;GAPDH:MQP027158;Genecopoeia公司,美国);RANase Rree去离子水2 μl。按两步法反应94 ℃ 30 s,58 ℃ 30 s,40个循环,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参照进行分析,检测E-cadherin、N-cadherin和vimentin基因的表达水平。采用Western blot进行检测。按不同因素处理细胞,提取蛋白,测定蛋白浓度,采用5×上样缓冲液稀释,使用12%分离胶电泳,转膜90 min,5%脱脂奶粉室温封闭1 h,TBST漂洗10 min×3次,用5%TBST稀释的BSA稀释一抗,分别与膜接触4 ℃孵育过夜后,用TBST漂洗10 min×3次,加二抗室温下孵育1 h后,用TBST洗膜10 min×3次,在Gene Gnome曝光仪上曝光并拍照。
1.2.5 宫颈癌细胞增殖、迁移、侵袭能力的检测 ①采用细胞增殖实验来检测宫颈癌细胞增殖能力,具体操作方法如下:在96孔板中每孔接种5×103个细胞,每组设置4个复孔。将细胞刚好贴壁记为0 h,于12 h利用CCK-8检测试剂盒检测细胞增殖;每孔加入10 μl CCK-8溶液,空白对照孔加10 μl 0.9%生理盐水,在细胞培养箱中孵育1 h,然后用酶标仪在570 nm处测定各孔的吸光度(A)值。②采用细胞划痕实验检测宫颈癌细胞的迁移能力,具体操作如下:细胞按每孔约5×105个细胞的密度接种到6孔板,培养24 h至细胞伸展,用无菌200 μl的枪头在细胞层垂直、快速划痕。划痕结束后在细胞孵化箱继续培养48 h后观察划痕愈合。③采用侵袭实验检测宫颈癌细胞侵袭能力,具体操作方法如下:Transwell小室(Millipore,USA)底部铺入50 μl Basement Membrane Matrix(Corning,USA,稀释=1 ∶2),置于细胞孵箱中2 h。收获细胞,制成每200 μl DMEM(GIBECO,USA)中含6×104个细胞悬液。Transwell上室加入200 μl DMEM细胞悬液,下室加入800 μl含10%胎牛血清DMEM,置于细胞培养箱中。侵袭48 h后取出小室,多聚甲醛中固定10 min,结晶紫中染色3 min。PBS洗净结晶紫,并用棉签轻轻擦拭Transwell小室上室底部。晾干后,将小室倒置于显微镜下观察并拍照,计算细胞数目观察各组细胞的侵袭能力。
1.3 统计学分析

2 结果
2.1 miR-224在宫颈癌及癌旁正常组织的表达
收集24例宫颈癌组织和24例癌旁组织,采用RT-PCR法检测肿瘤组织以及癌旁组织中miR-224的表达情况。结果显示,肿瘤组织miR-224的表达显著高于癌旁组织,差异有统计学意义(7.56±1.48vs4.28±0.65,t=3.176,P=0.002,见图1)。

图1 miR-224在24例宫颈癌组织和24例癌旁正常组织中的表达Figure 1 Expression of miR-224 in 24 cases of cervical cancer tissues and 24 cases of adjacent normal tissues
2.2 miR-224对HCE1细胞增殖能力的影响
采用miR-224抑制剂及模拟剂转染宫颈癌细胞株HCE1,采用CCK8法检测细胞的增殖能力。结果显示,不同组别之间细胞增殖能力有显著差异(F=13.33,P=0.002)。进一步行两两比较显示,miR-224抑制剂作用后,细胞增殖能力较NC组显著下降,差异有统计学意义(t=3.659,P=0.022);而采用miR-224模拟剂作用后,细胞的增殖能力较NC组显著升高,差异有统计学意义(t=6.454,P=0.003,见图2A)。
2.3 miR-224对HCE1细胞迁移、侵袭能力的影响
为进一步探究miR-224对宫颈癌细胞株HCE1迁移、侵袭能力的影响,采用划痕实验检测细胞迁移能力、侵袭实验检测侵袭能力。miR-224抑制剂组、miR-224模拟剂组及NC组之间迁移能力(F=8.805,P=0.007)、侵袭能力(F=10.73,P=0.004)组间差异有统计学意义。进一步行两两比较显示,miR-224抑制剂作用后,细胞愈合面积比例显著低于NC组(t=4.117,P=0.015),而miR-224模拟剂组细胞愈合面积比例显著高于NC组(t=8.672,P=0.001,见图2B)。由此可见,抑制miR-224可以抑制宫颈癌细胞的迁移能力。miR-224抑制剂作用后,miR-224抑制剂组细胞穿膜细胞数明显少于NC组(t=8.041,P=0.001),而miR-224模拟剂组,细胞穿膜细胞数明显多于NC组(t=3.448,P=0.026,见图2C)。结果提示,抑制miR-224可以抑制宫颈癌细胞的侵袭。

与NC组相比较,*P<0.05,**P<0.01图2 四组宫颈癌细胞增殖、迁移、侵袭能力比较Figure 2 Comparison of proliferation, migration and invasion ability of HCE1 cells among four groups
2.4 EMT标志物的表达水平
为进一步探究miR-224促进宫颈癌细胞株HCE1增殖、迁移和侵袭的机制,采用Western blot法检测不同组别EMT标志物E-cadherin、N-cadherin和vimentin的表达。三组间EMT标志物E-cadherin(F=12.66,P=0.002)、N-cadherin(F=16.79,P=0.001)和vimentin(F=13.88,P=0.002)的表达差异有统计学意义。进一步行两两比较显示,miR-224抑制剂组上皮标记物E-cadherin的蛋白表达显著高于NC组(t=6.148,P=0.004);而间质标记物N-cadherin(t=7.021,P=0.002)和vimentin(t=4.569,P=0.010)的蛋白表达显著低于NC组。但是在miR-224模拟剂组中,E-cadherin的蛋白表达显著低于NC组(t=6.005,P=0.004);而间质标记物N-cadherin(t=5.606,P=0.005)和vimentin(t=4.151,P=0.014)的蛋白表达显著高NC组(见图3,4)。由此可见,抑制miR-224可以抑制宫颈癌细胞的EMT,而过表达miR-224可以促进宫颈癌细胞的EMT。

图3 不同组别细胞E-cadherin、N-cadherin、vimentin蛋白表达灰度Figure 3 Expression of E-cadherin, N-cadherin, and vimentin proteins in different groups by Western blot
3 讨论
宫颈癌是女性常见的生殖系统肿瘤。近年来,发病率呈现逐年上升趋势,更加年轻化。早期诊断及治疗被认为是降低宫颈癌死亡率、提高患者生存质量的重要措施。miR作为一种具有广泛调节能力的信号分子,具有癌基因或抑癌基因的作用,通常促癌miRs在肿瘤中表达上调,通过解除抑癌基因调控,阻止细胞的分化,调控细胞恶性转化,还可以通过抑制细胞凋亡、促进细胞增殖等多种途径来促进肿瘤的发展。有研究[7]证实miR在宫颈癌的发生和发展中起到重要作用。miR-224作为miR家族的一员,已经被证实在髓母细胞瘤、乳腺癌等多种肿瘤中发挥促癌效应[8,9]。陈文波等[6]研究结果显示miR-224在宫颈癌组织中表达上调,且表达越高,肿瘤分化越低,患者预后越差,Shen等[10]研究结果与陈文波等[6]研究结果具有一致性,进一步佐证了miR-224在宫颈癌组织具有促癌作用。本研究亦证实,miR-224在宫颈癌患者的组织中及宫颈癌细胞中的表达明显增加,且过表达miR-224可以显著增加宫颈癌细胞的增殖、迁移及侵袭能力。可能原因有:①miR-224可通过激活AKT信号传导和直接靶向肿瘤抑制基因PPP2R1B促进细胞迁移和侵袭[11,12]和rho GTP酶活化蛋白ARHGAP9和ARHGAP21,其使CDC42失活[13]。②miR-224可以通过直接或间接调节基质金属蛋白酶来影响侵袭和转移,所述基质金属蛋白酶是癌细胞分泌的酶,其降解细胞外基质并有助于传播。③miR-224可能在调节EMT中起作用,EMT作为癌细胞增殖、迁移与侵袭能力增加的重要机制,在宫颈癌中发挥的相应作用近来受到越来越多学者的重视[14]。EMT的实质是调控肌动蛋白丝的动态装配,因此,上皮标志物(E-cadherin)的表达下调,而间质标志物(N-cadherin、vimentin)的表达上调被认为是肿瘤细胞获得EMT的重要标志[15,16]。同时miR可以通过启动后机制、共翻译蛋白降解机制、启动机制、miR介导的mRNA降解等多种途径[17]调控细胞的EMT。本研究在宫颈癌患者蛋白水平在发现EMT标志物表达改变,过表达miR-224可以下调E-cadherin的表达,促进N-cadherin与vimentin的表达,进一证实了miR-224可能在宫颈癌的发病中起到促癌作用,为宫颈癌治疗提供新的治疗思路。但由于本次纳入的样本数较少,仍需要更大样本的研究来进一步证实。
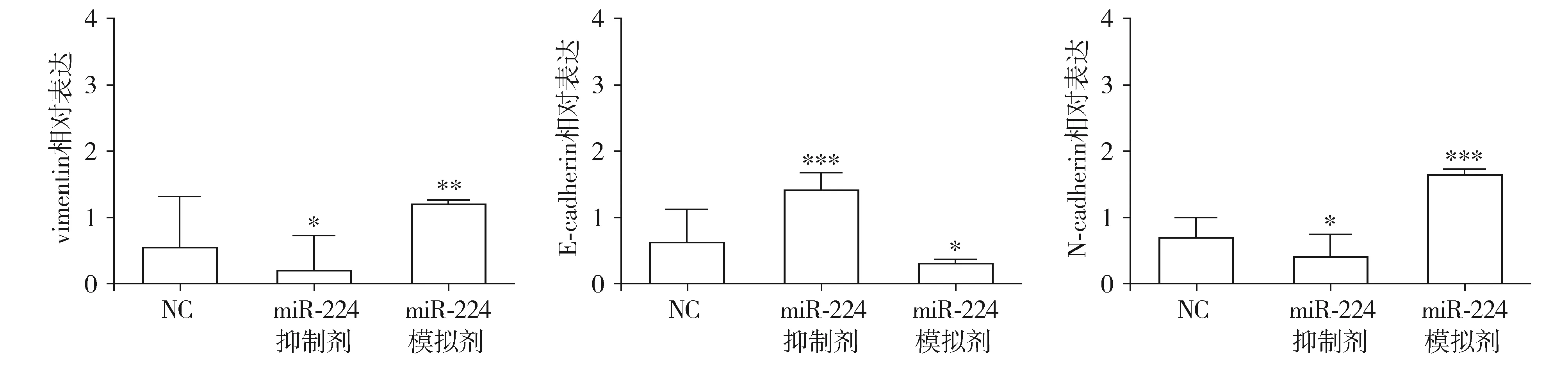
与NC组相比,*P<0.05,**P<0.01,***P<0.001图4 EMT标志物E-cadherin、N-cadherin、vimentin蛋白表达灰度分析Figure 4 E-cadherin, N-cadherin and vimentin protein expression in different groups
综上所述,miR-224通过促进N-cadherin与vimentin的表达,抑制E-cadherin的表达,调控宫颈癌细胞的EMT,促进宫颈癌的增殖、侵袭和迁移。在宫颈癌中,miR-224可能发挥促癌作用,为宫颈癌治疗提供新的治疗思路。
