Ang-(1-7)和Ang Ⅱ对肌源性泡沫细胞高密度脂蛋白受体、ATP结合盒转运子A1表达的影响
2019-03-28梁长清庄德贞杨志明
梁长清,庄德贞,高 然,陈 军,杨志明
(1深圳市宝安区人民医院心内科,深圳 518101;2山西医科大学第二医院心内科;*通讯作者,E-mail:lcqt3@hotmail.com)
平滑肌源性泡沫细胞是动脉粥样硬化(atherosclerosis,AS)形成的重要标志之一[1]。细胞内脂质摄取过多和/或流出减少导致脂质大量蓄积是泡沫细胞形成的主要原因[2]。三磷酸腺苷结合盒转运体(ATP binding cassette transporter,ABC)家族中的ABCA1主要负责胆固醇的流出[3]。ATP结合盒转运子A1(ATP-binding cassette transporter A1,ABCA1)介导细胞内胆固醇流出至胞外乏脂的载脂蛋白A1(apolipoprotein A1,ApoA1)形成新生高密度脂蛋白(high density lipoprotein,HDL)。HDL主要通过促进胆固醇逆转运(reverse cholesterol transport,RCT)发挥抗动脉粥样硬化的作用。清道夫受体高密度脂蛋白受体(scavenger receptor class B type 1,SR-BI)是HDL的高亲和力受体,具有特异的脂质转运功能,可介导HDL从外周组织接受过量的胆固醇,并在HDL内部把胆固醇转变为胆固醇酯,经代谢排出体外或生成激素,故SR-BI在清除体内多余胆固醇的过程中起到重要作用[4]。
血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)是肾素-血管紧张素系统(renin-angiotensin system,RAS)的主要活性成分之一,可逆转巨噬细胞内胆固醇外流,促进巨噬细胞源性泡沫细胞的形成。而血管紧张素-(1-7)[angiotensin-(1-7),Ang-(1-7)]具有抗血管内皮细胞增殖、抑制炎症因子、利钠利尿等拮抗Ang Ⅱ的作用。目前,有关Ang Ⅱ能否抑制肌源性泡沫细胞SR-BI、ABCA1的表达以及Ang-(1-7)能否拮抗Ang Ⅱ的此作用,少见相关文献报道。本实验以肌源性泡沫细胞为研究对象,通过观察Ang-(1-7)与Ang Ⅱ对细胞SR-BI、ABCA1表达的作用,初步探讨RAS对肌源性泡沫细胞RCT的影响。
1 材料与方法
1.1 细胞株及主要试剂
小鼠平滑肌细胞购自中科院上海细胞库,PMA、Ang Ⅱ、Ang-(1-7)、A-779、apoA-Ⅰ、油红O试剂均购于美国Sigma公司,DEME培养基、胎牛血清购于美国HyClone公司,胰蛋白酶购于美国GIBCO公司,oxLDL购于北京协生生物科技有限责任公司,引物购自宝生物工程(大连)有限公司,总RNA提取试剂盒(Trizol)购自美国Promega公司,抗荧光淬灭剂、兔单克隆抗体SR-BI一抗、小鼠单克隆抗体ABCA1一抗购自美国Santa cruz公司,HRP标记山羊抗兔、HRP标记山羊抗小鼠二抗购自武汉三鹰生物技术有限公司。
1.2 细胞鉴定与培养传代
细胞制备:实验前接种105个细胞到24孔板中(爬片),37 ℃、5%CO2培养24 h。
免疫荧光鉴定:取培养后细胞,PBS清洗,经固定、透化、封闭,分别加入一抗α-actin(1 ∶50)、二抗(goat anti-rabbit-488,1 ∶100)孵育,DAPI染核,在载玻片上滴加抗荧光淬灭剂,将盖玻片倒扣在载玻片上,滴加指甲油封片。倒置荧光显微镜拍照。
细胞培养传代:小鼠原代VSMCs中加入含15%胎牛血清及1%青-链霉素溶液的DMEM/F12培养基,5%CO2、37 ℃培养,隔日换液1次。当细胞生长至覆盖培养瓶底部80%以上面积时,加入1 ml含EDTA的0.25%胰蛋白酶消化传代,3-5 d传1代。采用对数生长期的细胞进行实验研究。
1.3 平滑肌源性泡沫细胞模型的制备及鉴定
取3-5代细胞消化后,接种合适的细胞量到24孔板爬片,5%FBS+DMEM预先饥饿培养24 h,再加入终浓度为100 mg/L的oxLDL,培养72 h,使VSMC转化为泡沫细胞,建立泡沫细胞模型[5]。泡沫细胞形成通过油红O染色证明。
1.4 实验分组及处理
实验分为六组:①control组,即肌源性泡沫细胞组;②100 nmol/L Ang Ⅱ组;③100 nmol/L Ang-(1-7)组;④100 nmol Ang-(1-7)+100 nmol/L Ang Ⅱ组,在先加入100 nmol Ang Ⅱ 1 h后加入100 nmol Ang-(1-7);⑤100 nmol/L Ang Ⅱ+100 nmol/L Ang-(1-7)+100 nmol A-779组,先加入100 nmol/L Ang Ⅱ 1 h后再加入100 nmol/L Ang-(1-7)及100 nmol/L Ang-(1-7)特异性拮抗剂A-779;⑥100 nmol/L A-779组。细胞按以上分组,每组药物干预48 h后离心收集细胞,-70 ℃冰箱保存待用。每组设6个复管,用于SR-BI、ABCA1蛋白及基因水平的表达的检测。
1.5 Western-blot检测ABCA1、SR-BI蛋白的含量
抽提细胞蛋白定量后,将样品变性、加样(配取5%浓缩胶与8%分离胶用于检测ABCA1蛋白,配取10%浓缩胶与8%分离胶用于检测SR-BI蛋白),均用SDS-PAGE垂直凝胶电泳分离不同分子量的蛋白质,电转移于NC膜上。转膜后封闭液封闭过夜,按1 ∶1 000分别加入小鼠单克隆抗体ABCA1一抗、兔单克隆抗体SR-BI一抗,4 ℃孵育过夜,TBST洗3次,按1 ∶5 000的稀释倍数分别加入辣根过氧化物酶标记羊抗鼠二抗、羊抗兔IgG,室温孵育2 h,TBST洗3次。增强化学发光法,X片放射自显影,数码凝胶图像定量分析系统成像、条带密度扫描,以同管β-actin为内参照,分别测定各样本ABCA1、SR-BI蛋白的相对表达量。
1.6 RT-PCR检测ABCA1 mRNA、SR-BI mRNA的表达
用Trizol抽提细胞总RNA,紫外分光光度仪确定样品中RNA纯度(OD260/OD280=1.8-2.0)与含量。将RNA逆转录生成的cDNA作为模板进行扩增。ABCA1 PCR反应条件:预变性95 ℃,3 min;95 ℃变性10 s;60 ℃退火15 s;72 ℃延伸1 min;72 ℃终止5 min,共40个循环。SR-BI PCR反应条件:预变性95 ℃,3 min;95 ℃变性10 s;58 ℃退火15 s;72 ℃延伸20 s;72 ℃再延伸5 min;继续扩增至40个循环。GAPGH PCR反应条件:预变性94 ℃,4 min;94 ℃变性1 min;55 ℃退火30 s;72 ℃延伸1 min;72 ℃终止5 min,共40个循环。PCR产物经1.5%琼脂糖凝胶电泳回收,用全自动凝胶分析系统灰度扫描分析。以GAPDH为内参,采用2-ΔΔCt法计算各组目的产物的基因相对表达量(引物序列见表1)。
1.7 统计学分析
表1各组引物序列
Table1Primersequencesofdifferentgenes

名称引物序列 产物长度(bp) ABCA1上游:5′-GGAGGCAATGGCACTGAG-3′107下游:5′-ATGCGGGAAAGAGGACTA-3′ SR-BI上游:5′-CCCATCCTCACTTCCTCAA-3′170下游:5′-GCCTGCGACAGATTTCAT-3′ GAPGH上游:5′-CAAGGTCATCCATGACAACTTTG-3′496下游:5′-GTCCACCACCCTGTTGCTGTAG-3′
2 结果
2.1 平滑肌细胞的形态鉴定结果
低倍镜下观察可看正常的平滑肌细胞为梭形或长梭形,呈典型的“峰谷”生长。高倍镜下观察可以看到胞质内有大量的纤维细丝,与细胞的长轴平行,细胞核呈卵圆形,位置居中,证明所培养的细胞是平滑肌细胞(见图1)。
2.2 平滑肌细胞的免疫荧光鉴定结果
免疫荧光显示平滑肌细胞的标记分子SMA为阳性(见图2),证明所分离的细胞为平滑肌细胞,纯度在98%以上[6]。

A.光镜下 (×40) B.光镜下HE染色 (×400)图1 正常生长的平滑肌细胞形态Figure 1 Morphology of VSMCs
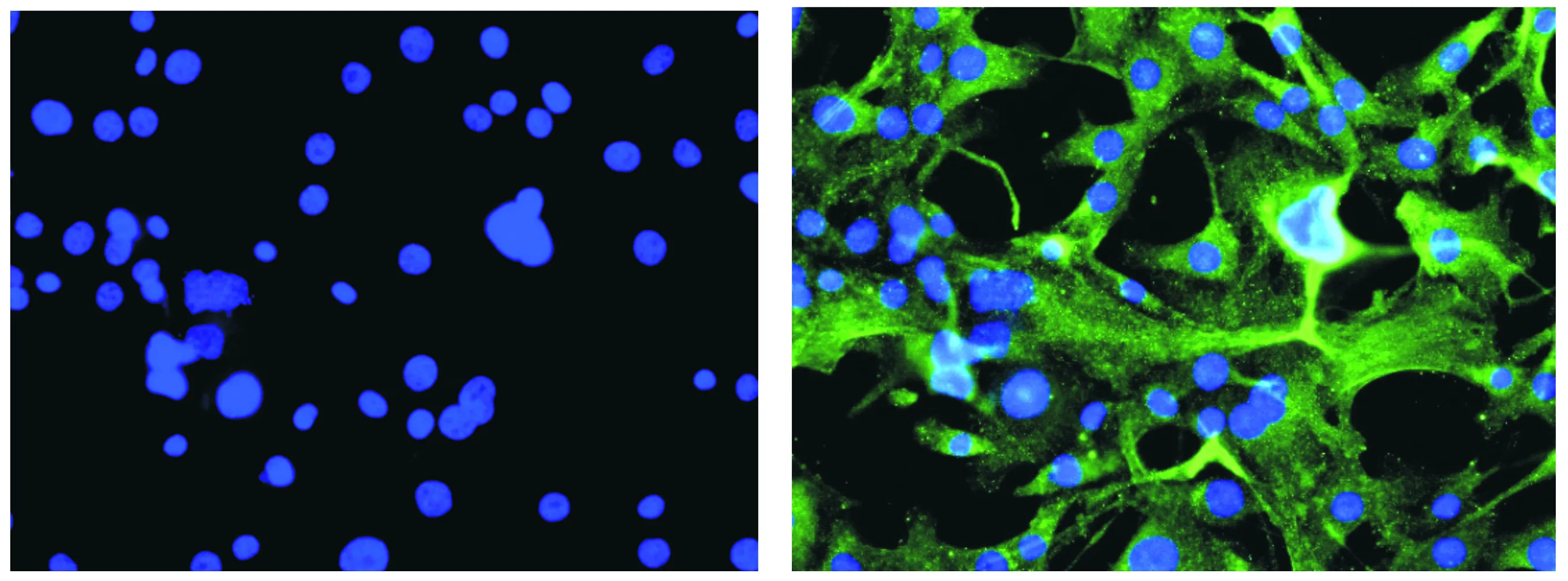
图2 平滑肌细胞的免疫荧光结果 (DAPI染色法,×400)Figure 2 SMA immunofluorescence staining of VSMCs (DAPI staining,×400)
2.3 泡沫细胞的形态及鉴定结果
ox-LDL处理VSMC后形成肌源性泡沫细胞,进行油红O染色,光镜下可见平滑肌细胞形态发生变化,呈不规则性,胞质内大量红色脂滴颗粒存在,而细胞核呈淡蓝色,符合泡沫细胞的形态特征(见图3)。

A.放大倍数×100 B.放大倍数×200图3 光镜下油红O染色的肌源性泡沫细胞的形态Figure 3 The shape of VSMCs derived foam cells by oil red O staining under light microscope
2.4 Ang Ⅱ与Ang-(1-7)对肌源性泡沫细胞SR-BI、ABCA1蛋白表达的影响
与control组比较,Ang-(1-7)组SR-BI、ABCA1表达明显增加(P<0.05),而Ang Ⅱ组显著抑制细胞表面SR-BI、ABCA1蛋白的表达(P<0.05);Ang Ⅱ+Ang-(1-7)组与Ang Ⅱ组比较,SR-BI、ABCA1蛋白的表达明显增加(P<0.05),但与Ang-(1-7)组比较差别无统计学意义(P>0.05);Ang Ⅱ+Ang-(1-7)+A-779组与Ang-(1-7)组比较SR-BI、ABCA1的表达明显减弱(P<0.05),但与Ang Ⅱ组比较差异无统计学意义(P>0.05,见表2,图4)。
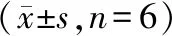


组别SR-BI蛋白相对表达量ABCA1蛋白相对表达量control组Ang Ⅱ组Ang-(1-7)组Ang Ⅱ+Ang-(1-7)组Ang Ⅱ+Ang-(1-7)+A-779组A-779组0.761±0.0180.452±0.021∗0.992±0.026∗#1.194±0.031∗#0.555±0.019∗0.732±0.0250.594±0.0410.431±0.020∗0.626±0.037∗#0.738±0.036∗#0.497±0.018∗0.536±0.033
与control组比较,*P<0.05;与Ang Ⅱ组比较,#P<0.05

1.control组; 2.Ang Ⅱ组;3.Ang-(1-7)组;4.Ang Ⅱ+Ang-(1-7)组;5.Ang Ⅱ+Ang-(1-7)+A-779组;6.A-779组图4 各组肌源性泡沫细胞SR-BI、ABCA1蛋白的表达Figure 4 SR-BI,ABCA1 protein expression in VSMCs-derived foam cells after different treatments
2.5 Ang Ⅱ与Ang-(1-7)对肌源性泡沫细胞SR-BI mRNA、ABCA1 mRNA表达的影响
在肌源性泡沫细胞中,与control组比较,Ang-(1-7)组SR-BI mRNA、ABCA1 mRNA表达明显增加(P<0.05),而Ang Ⅱ组SR-BI mRNA、ABCA1 mRNA的表达显著减弱(P<0.05);Ang Ⅱ+Ang-(1-7)组与Ang Ⅱ组比较, SR-BI mRNA、ABCA1 mRNA表达明显增加(P<0.05),但与Ang-(1-7)组比较差异无统计学意义(P>0.05);Ang Ⅱ+Ang-(1-7)+A-779组与Ang-(1-7)组比较,SR-BI mRNA、ABCA1 mRNA的表达明显减弱(P<0.05),但与Ang Ⅱ组比较差异无统计学意义(P>0.05,见表3)。

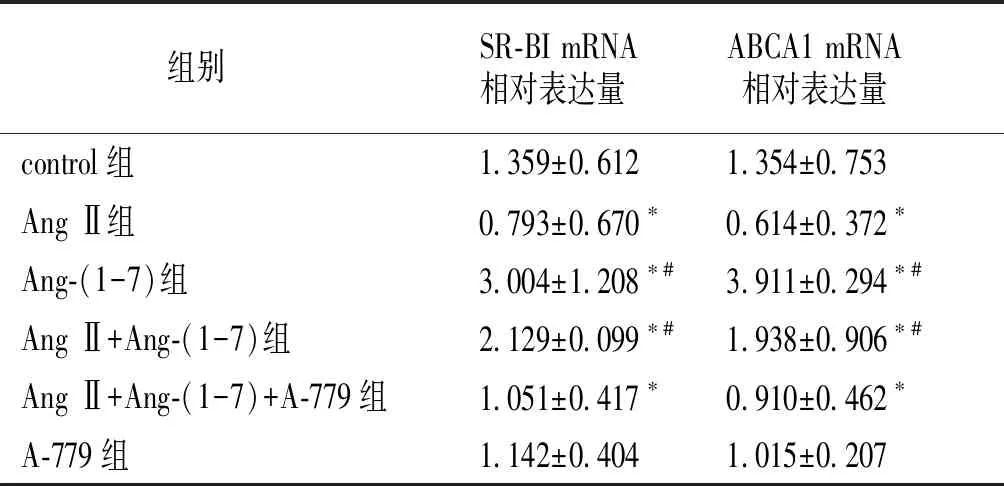
组别SR-BI mRNA相对表达量ABCA1 mRNA相对表达量control组1.359±0.6121.354±0.753Ang Ⅱ组0.793±0.670∗0.614±0.372∗Ang-(1-7)组3.004±1.208∗#3.911±0.294∗#Ang Ⅱ+Ang-(1-7)组2.129±0.099∗#1.938±0.906∗#Ang Ⅱ+Ang-(1-7)+A-779组1.051±0.417∗0.910±0.462∗A-779组1.142±0.4041.015±0.207
与control组比较,*P<0.05;与Ang Ⅱ组比较,#P<0.05
3 讨论
在AS中晚期病变中,血管平滑肌细胞结合并吞噬氧化的低密度脂蛋白,形成泡沫细胞,进而促进了AS发展[7]。在胆固醇逆转运(RCT)过程中,高密度脂蛋白将胆固醇从周围组织(包括动脉粥样斑块)转运到肝脏进行再循环或以胆酸的形式排泄,从而减轻动脉粥样硬化病灶[8]。ATP结合盒转运体和清道夫受体BI是介导RCT的两个关键蛋白[9]。
ABCA1是细胞胆固醇转运相关蛋白,将细胞内胆固醇和磷脂(主要是卵磷脂)转运至细胞表面的HDL前体apoAI,该蛋白负责RCT的第一步也是主要的限速步骤[10]。近期研究表明[11],在血管平滑肌细胞中,激活TRPV1能够通过钙调蛋白和PKA依赖的机制增加ABCA1的表达;而上调ABCA1的表达后,可促进其介导的胆固醇外流,从而有效清除细胞内蓄积的胆固醇,最终阻断或延缓AS的发生、发展[12,13]。本研究显示,Ang-(1-7)可促进平滑肌源性泡沫细胞ABCA1表达,与相关报道一致[14]。
SR-BI是位于细胞表面的糖蛋白,在肝脏中大量表达[15,16]。在RCT起始过程中,SR-BI结合HDL促进胆固醇外流,防止其在外周动脉壁的堆积;SR-BI还可以介导HDL胆固醇酯(CE)的选择性吸收[17,18]。研究发现,SR-BI基因敲除会加重apoE-/-基因敲除小鼠的AS病变,而apoE基因敲除小鼠移植SR-BI+/+小鼠骨髓后,粥样斑块面积明显减小[19]。以上研究表明SR-BI在调节细胞内胆固醇流出,维持细胞内胆固醇平衡中起关键作用。本实验显示,Ang Ⅱ抑制了肌源性泡沫细胞SR-BI表达,而Ang-(1-7)则促进了SR-BI的表达。
Ang Ⅱ与Ang-(1-7)均属于RAS成员,Ang Ⅱ具有促进细胞增殖、心肌细胞肥大、间质纤维化、水钠潴留及动脉粥样硬化的作用。已有研究显示Ang-(1-7)通过ERK1/2通路拮抗Ang Ⅱ诱导的平滑肌增殖及迁移[20],并可拮抗Ang Ⅱ诱导的巨噬细胞ABCA1、SR-BI表达的减少,促进胆固醇逆转运,进而减少泡沫细胞的形成[21]。而在巨噬细胞源性泡沫细胞形成后,Ang-(1-7)亦可拮抗Ang Ⅱ对ABCA1SR-BI表达的抑制作用[21]。本研究亦显示,在肌源性泡沫细胞中Ang-(1-7)可拮抗Ang Ⅱ对ABCA1、SR-BI表达的抑制作用;当加入Ang-(1-7)特异性受体MAS受体拮抗剂A-799后,Ang-(1-7)抑制Ang Ⅱ的作用完全消失,提示Ang-(1-7)通过MAS受体介导发挥拮抗Ang Ⅱ的作用。已有研究表明,ABCA1、SR-BI的表达水平还受PPAR、p38 MAPK/JNK等多种因素调控[22,23],但Ang-(1-7)能否通过PPAR、p38MAPK/JNK等信号途径影响ABCA1、SR-BI表达尚需进一步论证。因此,深入研究Ang-(1-7)与Ang Ⅱ之间的相互关系及其对泡沫细胞RCT的影响机制,将会为防治动脉粥样硬化提供新的靶点和作用途径。
