介质阻挡低温等离子处理对花生蛋白持水性及溶解性的影响
2019-03-28于娇娇李书红
季 慧,于娇娇,张 金,魏 瑞,李书红,陈 野
介质阻挡低温等离子处理对花生蛋白持水性及溶解性的影响
季 慧1,2,于娇娇1,张 金1,魏 瑞1,李书红1,陈 野1※
(1. 天津科技大学食品工程与生物技术学院,教育部食品营养与安全实验室,天津 300457;2. 临沂大学生命科学学院,临沂 276002)
花生蛋白营养丰富,但因功能性质差,导致其在食品工业应用受限。低温等离子技术作为一种新兴的、非热、无危害技术,越来越受人关注,介质阻挡放电(dielectric barrier discharge,DBD)等离子体技术由于具有适应频率宽,可在较大空间内获得高密度非平衡等离子体,并且工艺简单、快速高效、节能环保,是近年来蛋白质改性研究的热点之一。采用介质阻挡低温等离子体对花生蛋白溶液进行改性处理,研究等离子体处理时间对花生蛋白结构及功能特性影响。试验结果表明:低温等离子处理能显著提高花生蛋白的溶解性、持水性,低温等离子处理时间为2 min时,花生蛋白溶解性和持水性达最大,与未处理样品相比分别提高了24.8%和79.6%;同时,花生蛋白乳化性、乳化稳定性、起泡性、起泡稳定性和持油性也有不同程度的提高。借助十二烷基硫酸钠-聚丙烯酰胺电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)、傅里叶红外光谱(Fourier transform infrared,FTIR)、表面疏水性分析低温等离子对花生蛋白结构影响。分析结果表明,低温等离子处理并未改变花生蛋白的分子量分布;低温等离子处理后,-折叠和无规则卷曲的含量增加,-螺旋和-转角的含量降低,蛋白的有序结构被破坏,结构由紧密变松散;花生蛋白表面疏水性显著提高。低温等离子处理是一种改善蛋白功能性质的有效方法。
蛋白;等离子;结构;低温等离子;花生蛋白;功能性质
0 引 言
花生是世界上最重要的油籽作物之一,中国是世界上第二大花生生产国[1]。脱脂花生粉是一种富含蛋白质的花生油提取副产品,含有47%~55%的高质量蛋白质,其抗营养因子水平较低。然而,与大豆蛋白相比[2-3],它的低溶解度、乳化、发泡和凝胶性能等不良的功能特性限制了花生蛋白在食品工业上的应用。改善花生粉的功能特性对提高其在食品工业中的应用至关重要。
为了提高花生蛋白的功能特性,国内外专家对花生蛋白的功能特性进行了一些物理和化学改性。其中包括酶解、高压、超声波处理、微射流、微波和糖基化处理[1,4-6]。这些方法确实可以在不同水平上提高花生蛋白的功能特性,同时容易引起反应产物复杂、热变性和食品安全问题。寻求一种方便、快速、高效和绿色的新型改性技术是提高花生粉在食品工业利用率的关键问题。
低温等离子体(cold plasma,CP)是一种全新的、无危害、无热、高技术、前景广阔的高新技术,目前在食品工业中备受关注。等离子体作为物质的除固态、液态、气态之外的第四态,是气体部分或完全电离产生的非凝聚体系,CP包括紫外光子、电子、正离子和负离子、自由基、激发态或非激发分子和原子,这些粒子可以破坏共价键并引发各种化学反应[7]。因为电能产生的高能电子直接作用于等离子体的电子元件,使得等离子体的处理组分保持在室温[8-9]。CP已被广泛应用于灭菌、表面改性、高分子功能化、不良创面愈合及脂质膜的改性[10-14]。由于它的高能量,CP处理可以在微米到纳米范围内改变材料的结构[8],并作为一种很有前途的方法来处理材料表面,而不破坏它们的整体性能。研究表明[15-17],低温等离子能够引起玉米及马铃薯淀粉、面粉、乳清蛋白的二级、三级结构的改变,从而改善蛋白的功能性质。然而低温等离子改性花生蛋白的研究很少。
本文采用低温等离子处理花生粉溶液,研究低温等离子对花生蛋白结构及功能性质的影响,为提高花生粉在食品中的应用提供理论支持。
1 材料与方法
1.1 材 料
低温脱脂花生粉购买于临沂天申生物技术有限公司;血清白蛋白购买于华美生物工程有限公司。其他试剂都是分析纯级。
1.2 仪器与设备
DBD-50低温等离子体南京苏曼等离子科技有限公司;Ultra-Turrax T25高速乳化剪切机,德国IKA公司;紫外分光光度计E-201-C-9上海罗素科技有限公司;电泳DY-6C北京六一仪器厂;傅立叶变换红外光谱NicoletiS50 美国赛飞世尔科技有限公司;F-4500荧光分光光度计,日本HITACHI 公司;
1.3 试验方法
1.3.1 花生蛋白等离子处理
低温脱脂花生粉与去离子水配置成4 g/L的悬浮液于锥形瓶中,分散均匀后调整到pH值为10,放入冰箱(4 ℃)过夜充分水合备用。取10 mL花生蛋白溶液放入介质阻挡DBD-50反应器中处理,根据Dong等[18]报道,在预试验结果的基础上,选取放电等离子处理条件为,输入电压为35 V,在整个作用过程中,调节放电频率使输入电流维持在2 A,即输入功率为70 W,放电距离8 mm,放电时间为0、1、2、3、4、5 min对脱脂花生蛋白溶液进行改性处理。取部分处理后的样品真空冷冻干燥后备用。影响等离子处理效果的因素除了输入功率和处理时间外,放电间距也是影响等离子处理效果的一个主要因素,在我们的预试验中发现,随着放电间距的增加,等离子作用效果急剧减弱;在本试验中我们选取最小的放电间距8 mm,在固定输入功率的条件下,研究了不同等离子处理时间对花生蛋白结构及功能的影响,对等离子作用花生蛋白的机理进行初探。低温等离子体示意图如图1所示。
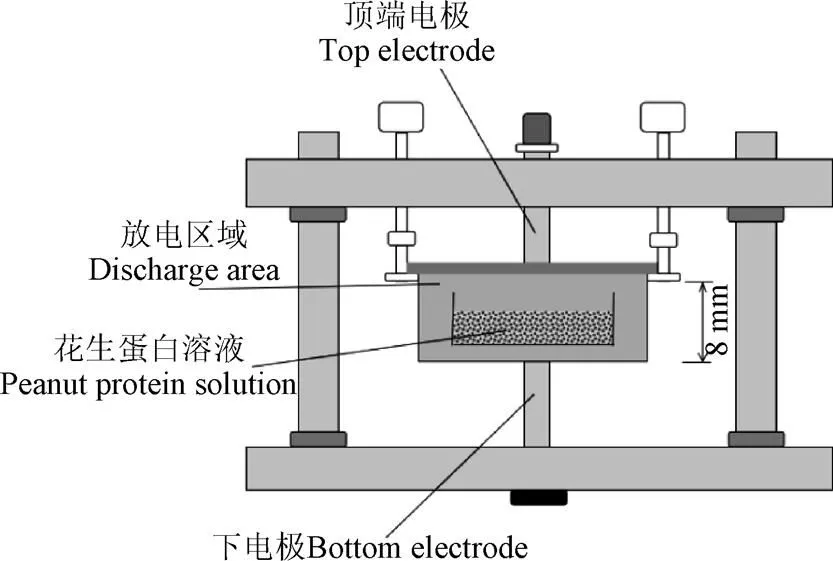
图1 低温等离子系统简易示意图
1.3.2 花生蛋白等离子处理后功能性质及结构的测定
1)溶解度
将等离子时间处理后花生蛋白溶液pH值调到10.00,采用考马斯亮蓝法[19],以牛血清白蛋白作标准曲线,测定等离子处理后蛋白溶解度。
2)乳化性和乳化稳定性的测定
等离子处理后的溶液(pH值调到10.00)在4 000 rad/min的条件下离心10 min后,从上面取上清液15 mL,再加入5 mL液体石蜡。用高速剪切机以10 000 rad/min剪切1 min制得的乳状液,立刻从底部吸取0.05 mL加到质量分数为0.1%的十二烷基硫酸钠溶液中混合均匀,在波长为500 nm处测定吸光度记为0。10 min后从底部吸取0.05 mL加到质量分数为0.1%的十二烷基硫酸钠溶液中混合均匀,在波长为500 nm处测定吸光度记为10。分别按照公式(1)计算花生蛋白的乳化活性指数(emulsion ability index,EAI)和公式(2)计算花生蛋白的乳化稳定性指数(emulsion stability index,ESI)[20]。
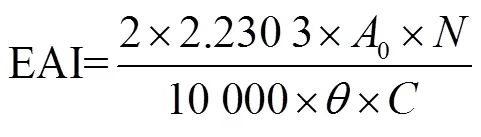
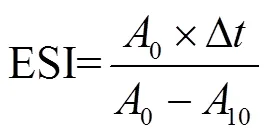
式中为稀释倍数;为油体积分数,%;∆为间隔时间,min;为溶液浓度, g/mL。
3)起泡性和起泡稳定性的测定
等离子处理后的溶液(pH值调到10.00)放置于30 ℃水浴锅中保温10 min,而后全部在4 000 rad/min的条件下离心10 min后,从上面取上清液20 mL,用高速剪切机以10 000 r/min的转速剪切2 min,立即记下各瓶泡沫的体积(0,mL),静置20 min后再次记下各瓶泡沫的体积(20,mL),按照公式(3)和(4)分别计算花生蛋白的起泡能力(foaming ability,FC)和花生蛋白的泡沫稳定性(foam stability,FS)[21]。
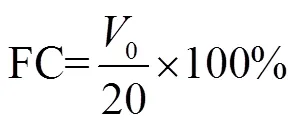
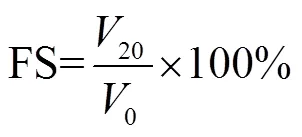
4)持水性和持油性的测定
分别称取低温等离子处理后的花生蛋白样品0.5 g(1)于已知质量的离心管(2)中,再加入20 mL蒸馏水,搅拌使其充分在水中分散溶解,置于30 ℃恒温水浴锅保温30 min。在4 000 rad/min的条件下离心10 min后,倒掉上清液,称量离心管质量(3)。按照公式(5)计算花生蛋白的持水性(water-holding ability,WHC)。
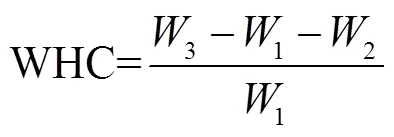
称取上述花生蛋白样品0.5 g于已知质量的离心管中,加入20 mL液体石蜡,搅拌使其充分在液体石蜡中分散溶解,置于30 ℃恒温水浴锅中让其保温30 min。用4 000 r/min离心10 min后倒掉没有被吸附的液体石蜡,称量离心管质量(′3)。按照公式(6)算花生蛋白的持油性(oil absorbing capacity,OAC)[22]。
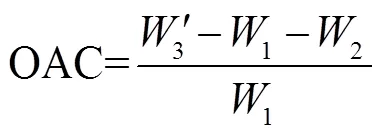
5)SDS-聚丙烯酰胺凝胶电泳
采用还原型聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)方法鉴定低温等离子处理前后花生蛋白中亚基的变化情况。根据Ji等[23]方法,选取分离胶和浓缩胶的浓度分别为12%和4%,样品中加入1 mmol/L-巯基乙醇。电泳后,蛋白胶用考马斯亮蓝R250染色。
6)傅里叶红外光谱分析
准确称量0.001 g花生蛋白样品,加入一定量的KBr至0.15 g,用研钵研磨成均匀粉末,压制成薄片,用傅里叶红外光谱仪做全波段扫描(4 000~400 cm-1),扫描次数为32[24]。
7)表面疏水性的测定
采用ANS(1-苯胺基-8-奈磺酸)荧光探针法来测定花生蛋白的表面疏水性[25],每个样品经等离子处理后都稀释为浓度梯度为0.2%、0.1%、0.05%、0.025%、0.012 5%的溶液,并配置8 mmol/L的ANS溶液。将40L ANS溶液加入到5 mL每种稀释液中,使用荧光分光光度计在390 nm(激发)在470 nm(发射)的波长下测量每个稀释液荧光强度,狭缝宽度为5 nm。纵坐标为各稀释液的荧光强度,横坐标为各稀释液荧光强度对应的蛋白浓度作图花生蛋白样品的表面疏水性指数可以用所得直线的斜率来表示。
采用SPSS统计软件(Version 19.0, SPSS Inc., Chicago, IL, USA),通过单因素方差分析(ANOVA)验证低温等离子处理对花生蛋白特性有显著性差异,<0.05认为有显著性差异。
2 结果与讨论
2.1 等离子处理对pH值和溶解度影响
等离子处理对花生蛋白溶液pH值的影响如表1所示。由表1可知,随着等离子对花生蛋白处理时间的增加,溶液的pH值显著降低(<0.05),处理5 min后,pH值从10.00降到2.55。pH值下降的原因可以解释为低温等离子在放电过程中会产生大量的高能粒子使氧分子电离单分子氧,使NO氧化成NO2,生成亚硝酸(HNO2)和硝酸(HNO3),以及水分子与过氧化氢(H2O2)在空气或液体中反应生成酸性H3O+离子。
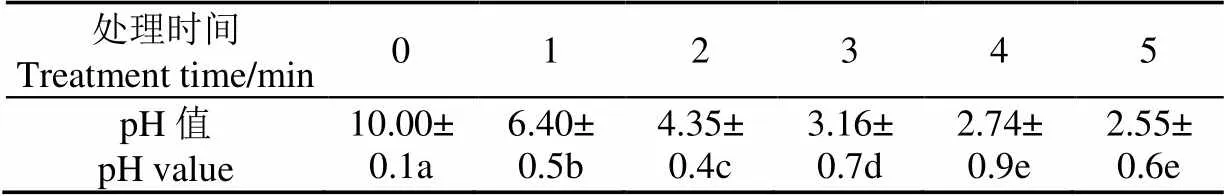
表1 等离子处理对花生蛋白溶液pH值的影响Table 1 Effect of CP treatment on pH value of Peanut protein
注:采用 Duncan’s multiple range test 方法分析,同列小写字母不同表示差异显著(<0.05)
Note: Mean values in the same column with different letters are significantly (<0.05) different, as determined by Duncan’s multiple range test.
由表1的结果可知,低温等离子处理后,高能粒子电离介质(空气)引起花生蛋白溶液pH值显著下降,pH值是影响蛋白功能性质的重要因素之一,为探求低温等离子对花生蛋白的结构与功能性质影响机理,消除溶液pH值对蛋白的影响,故在后续的试验中,把等离子处理前后的溶液的pH值均调到统一值10.00。不同低温等离子处理时间对花生蛋白溶解度的影响如图2所示。蛋白质的溶解度会影响蛋白的其它功能性质,从而对其在食品工业中的使用产生影响。由图2可知,花生蛋白的溶解度随着等离子处理时间的增加呈先升高后略降低的趋势,但都高于未处理时的蛋白溶解度。低温等离子处理时间为2 min时,花生蛋白的溶解度最大为132.78 mg/L,比未处理时提高24.8%。花生蛋白溶解度增加可能是由于等离子放电产生的高能粒子的轰击使蛋白表面产生刻蚀,花生蛋白表面结构被打开,蛋白比表面积增加,活性位点增加,加大蛋白胶束与水基团的碰撞几率,同时,高能粒子促使大量的水基团被激发,在蛋白表面形成水膜,花生蛋白的溶解度增加。随着等离子处理时间的延长,持续的放电可能使能引发花生蛋白不同的氨基酸侧链的变化,如−SH基团。芳香型和含硫氨基酸侧链尤其容易氧化,−SH或−S−CH3变成−S−S−[26-28],引起蛋白之间的交联,蛋白表面的活性位点减少,蛋白溶解度降低。
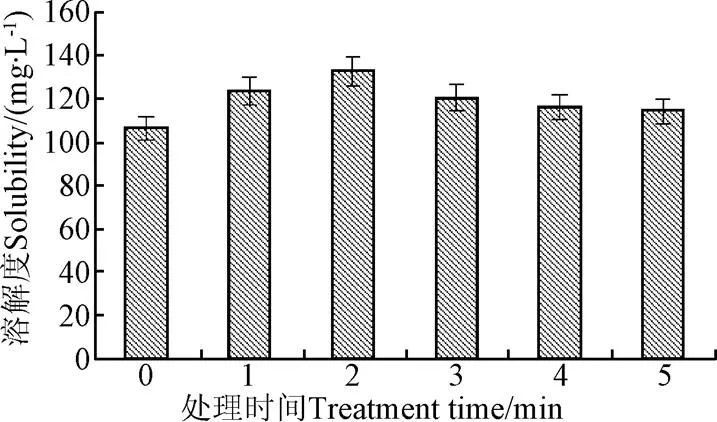
图2 低温等离子处理时间对花生蛋白溶液溶解度的影响
2.2 等离子处理对乳化性和乳化稳定性的影响
等离子处理时间对乳化性和乳化稳定性的影响如图3所示。乳化性质表示蛋白质每单位质量界面区域稳定,表征蛋白质吸附到油-水界面的性质。由图3可已看出,低温等离子处理能显著增加花生蛋白的乳化稳定性,适当的低温等离子处理会在一定程度上增加花生蛋白的乳化性。在处理3 min内,随着处理时间的延长,花生蛋白的乳化稳定性逐渐增加,3 min时达最大为38.95 m2/g,与未经处理的花生蛋白13.16 m2/g相比,乳化稳定性提高了196.2%。可能的原因是低温等离子产生的高能粒子轰击花生蛋白使表面结构破坏,疏水基团暴露,蛋白乳化稳定性增加[29]。3 min后,高能粒子的持续放电,引起蛋白之间的交联,蛋白表面疏水性降低,乳化稳定性下降。
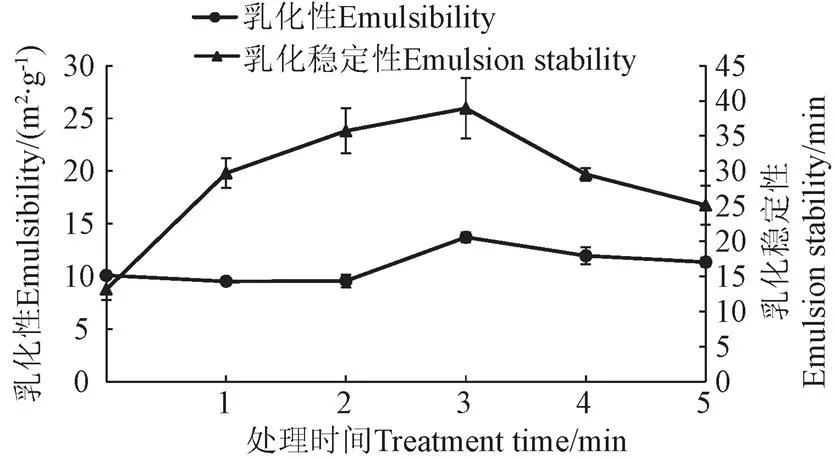
图3 等离子处理时间对乳化性和乳化稳定性的影响
2.3 等离子处理时间对花生蛋白起泡性和泡沫稳定性的影响
等离子处理时间对花生蛋白起泡性和泡沫稳定性的影响如图4所示。由图4可知,花生蛋白的起泡性和泡沫稳定性都随着等离子处理时间的增加呈先升高后降低的趋势,在等离子处理时间为3 min时,花生蛋白的最大起泡能力为106.67%,泡沫稳定性为81.25%,与未处理样品60.00%,38.89%相比分别提高了77.8%,108.9%。可能是由于适度的等离子处理使花生蛋白的结构变得较为疏散,蛋白分子间形成了比较稳定的界面膜,但是随着处理时间的增加,蛋白分子间的界面膜由于破裂,所以起泡性和泡沫稳定性都降低。
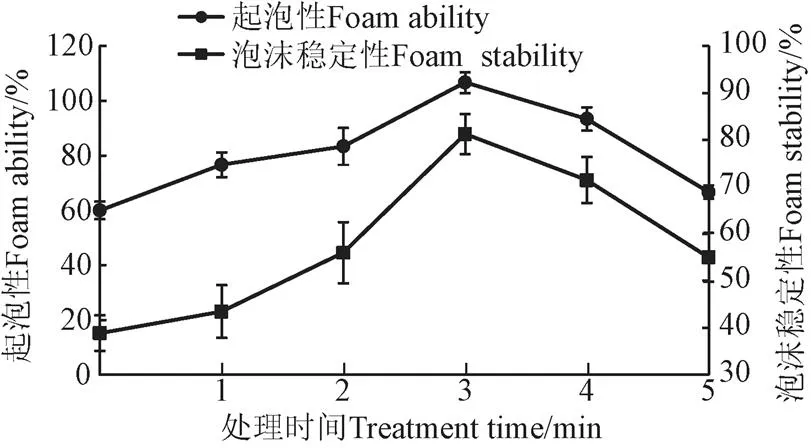
图4 等离子处理时间对花生蛋白起泡性和泡沫稳定性的影响
2.4 等离子处理时间对花生蛋白持水性和持油性的影响
等离子处理时间对花生蛋白持水性和持油性的影响如图5所示。由图5可知,花生蛋白的持水性随着等离子处理时间的增加呈先增加后降低的趋势,在等离子处理时间为2 min时,持水性最大为1.93 g/g,比未处理时增加79.6%,该结果与溶解性变化趋势相一致。等离子处理前2 min,花生蛋白的持油性稍有降低,在等离子处理时间为3 min时,花生蛋白的持油性升高并达到最大值2.47 g/g,与蛋白乳化性变化趋势相似。等离子处理对花生蛋白持水性和持油性的影响可能与等离子处理活性位点增加,花生蛋白表面结构变疏散,疏水基团被暴露有关。
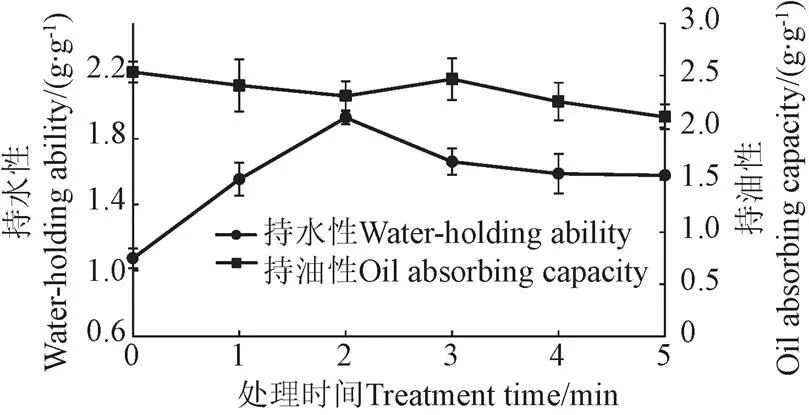
图5 低温等离子处理对花生蛋白持水性和持油性的影响
2.5 SDS-聚丙烯酰胺凝胶电泳结果
SDS-聚丙烯酰胺凝胶电泳结果如图6所示。由图6可知,花生蛋白亚基的电泳图谱包含5个主要类别:伴花生球蛋白(>50 kDa)、酸性花生球蛋白(38~49.9 kDa)、中分子量蛋白质(23~37.9 kDa)、碱性花生球蛋白(18~22.9 kDa)、低分子量的花生球蛋白(14~17.9 KDa)。与未处理的花生蛋白相比,等离子处理并没有引起蛋白质电泳图谱的重大变化,表明等离子处理并没有改变花生蛋白的一级结构,并且花生蛋白和其他分子(蛋白质、碳水化合物、水胶束等)之间没有形成共价键[30]。可能是因为本试验选择的放电功率下,高能粒子的能量并没有引起蛋白亚基的变化,没触及蛋白肽键的断裂和重组。
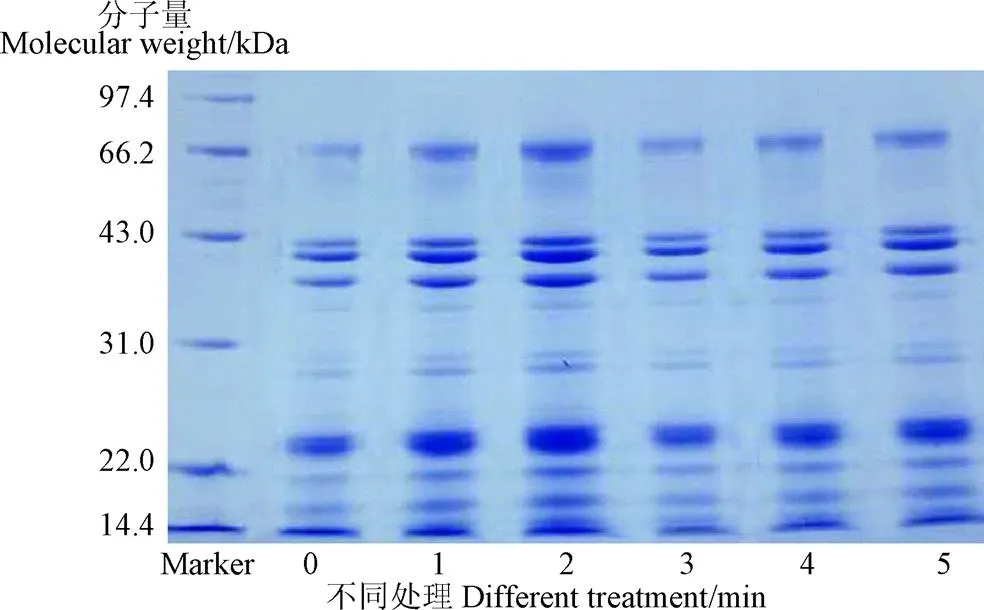
图6 低温等离子处理不同时间后花生蛋白的SDS-PAGE图
2.6 傅里叶红外光谱分析结果
选取红外光谱中的酰胺Ⅰ带(1 600~1 700 cm-1)进行详细研究,用Omnic软件用对蛋白质各二级结构进行定量分析。对应于二级结构的谱带如下:1 650~1 670 cm-1对应于-螺旋,1 610~1 640 cm-1对应于-折叠,1 660~1 700 cm-1对应于-转角,1 640~1 650 cm-1对应于无规则卷曲。每个二级结构组分的百分比通过相应峰的面积来计算[31]。蛋白质各二级结构进行定量分析结果如表2。
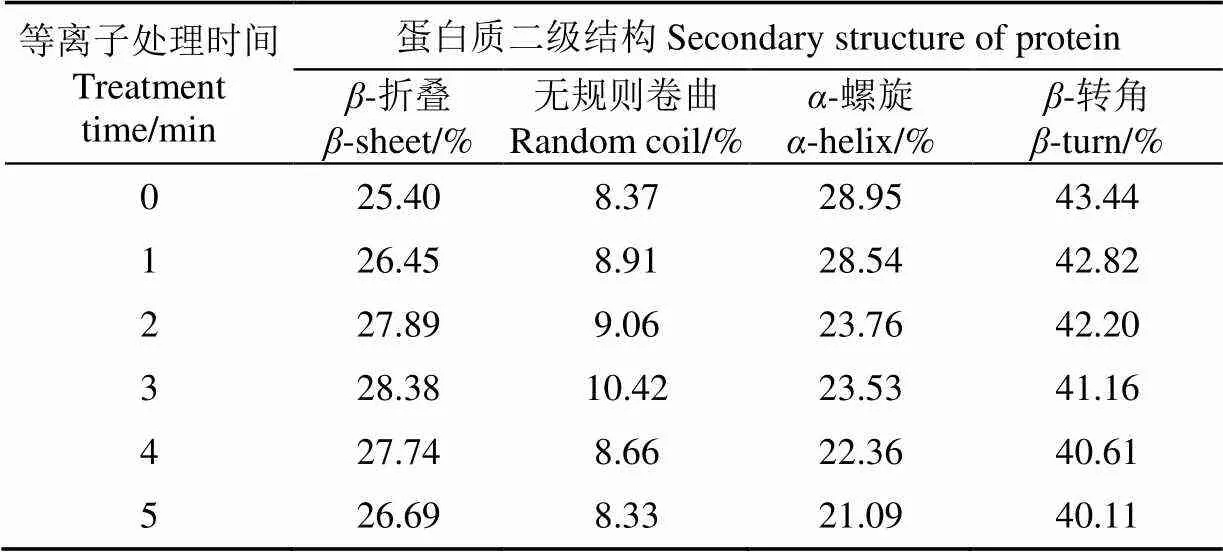
表2 低温等离子处理时间对花生蛋白二级结构的影响
由表2可知,低温等离子处理过程中,-折叠和无规则卷曲的含量先增加然后稍有降低,3 min时-折叠和无规则卷曲的质量分数达到最大,分别比对照样品增加了2.98%和2.05%。蛋白质中的部分变性和高度分散性结构增加了其在油水界面的稳定性,因此经较短时间等离子处理使花生蛋白乳化性能提高,这与前面了乳化性和乳化稳定性的结果相一致。-螺旋的质量分数从28.95%(0 min)逐渐下降了7.86个百分点至21.09%(5 min)。-转角的质量分数同样从43.44%(0 min)逐渐下降了3.33个百分点至40.11%(5 min)。低温等离子处理引发花生蛋白的二级结构的变化,其中-折叠和无规则卷曲的质量分数增加,而-螺旋和-转角的质量分数降低,表明花生蛋白的有序结构被破坏,高能离子的轰击使花生蛋白结构从有序和紧密变得无序和松散。
2.7 表面疏水性(HO)的测定结果
蛋白质表面疏水性是与极性水环境相关的蛋白质表面疏水基团数量的指标,ANS对环境变化极为敏感,对蛋白质分子的结构构象变化也非常敏感[32],与其乳化性能密切相关。低温等离子处理时间与花生蛋白表面疏水性的关系如图7所示。由图7可知,随着低温等离子处理花生蛋白时间的增加,表面疏水性呈现先稍有下降后逐渐升高的趋势,3 min时H达到最大值703。花生蛋白的表面疏水性稍有降低可能是因为等离子处理初期在蛋白表面形成水膜有关。随着等离子处理时间的增加,低温等离子的持续放电,花生蛋白的表面结构被破坏,蛋白结构变得无序和松散,大量疏水基团被暴露,花生蛋白表面疏水性显著提高。随着处理时间的进一步增加,花生蛋白可能发生交联反应,暴露了的疏水基团的数量减少导致花生蛋白的表面疏水性降低。该结果进一步证实了花生蛋白溶解度和乳化稳定性的结果。
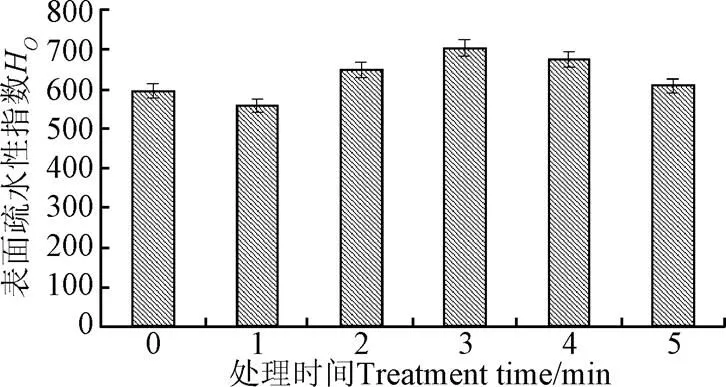
图7 低温等离子处理时间对花生蛋白表面疏水性的影响
3 讨 论
低温等离子体产生的高能粒子通过能量传递,对蛋白表面进行轰击,诱使蛋白的表面二级或高级结构被破坏,更多的活性位点被暴露,蛋白结构由紧密变松散,从而引起的功能性质的改善。等离子技术由于其操作简便,处理时间短,副产物少,绿色、安全在食品工业应用尤其是蛋白改性方面会有广阔的前景。由于在本试验中我们设定了溶液的pH值为10.00,只对等离子改性前后花生蛋白的功能性质进行了分析,没有与其它同类植物蛋白(如大豆蛋白)性质相对照分析。
4 结 论
低温等离子技术处理对花生蛋白粉的溶解性、乳化性和乳化稳定性、起泡性和起泡稳定性、持水性和持油性有一定影响,具体结果为,在70 W处理功率下,低温等离子放电时间为2 min时,溶解度和持水性达到最大,此时,花生蛋白溶解度为132.78 mg/L,持水性为1.93 g/g;放电时间为3 min时,花生蛋白的乳化性、乳化稳定性、起泡性、起泡稳定性和持油性也达到最佳。
在后续研究中,将继续对等离子放电工艺参数进行优化,为低温等离子在食品工业中应用提供技术支持;同时,在分子水平上探求等离子作用蛋白的机理,为低温等离子改性蛋白应用提供理论参考。
[1] He X H, Liu H Z, Liu L, et al. Effects of high pressure on the physicochemical and functional properties of peanut protein isolates[J]. Food Hydrocolloids, 2014, 36(5): 123-129.
[2] Zhao G, Liu Y , Zhao M , et al. Enzymatic hydrolysis and their effects on conformational and functional properties of peanut protein isolate[J]. Food Chemistry, 2011, 127(4): 1438-1443
[3] Wu H, Wang Q , Ma T , et al. Comparative studies on the functional properties of various protein concentrate preparations of peanut protein[J]. Food Research International, 2009, 42(3): 343-348.
[4] Ma T, Zhu H G , Ma J, et al. Influence of extraction and solubilizing treatments on the molecular structure and functional properties of peanut protein[J]. LWT-Food Science and Technology, 2017, 79: 197-204.
[5] Ariana O R, Yazel N V, Sergio O, et al. Microwave and ultrasound to enhance protein extraction from peanut flour under alkaline conditions: Effects in yield and functional properties of protein isolates[J]. Food & Bioprocess Technology, 2017, 10(3): 1-13.
[6] Zhang Q T, Tu Z C, Xiao H, et al. Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J]. Food and Bioproducts Processing, 2014, 92(1): 30-37.
[7] Kim S, Sessa D J, Lawton J W. Characterization of zein modified with a mild cross-linking agent[J]. Industrial Crops & Products, 2004, 20(3): 291-300.
[8] Fausser C, Puma A L, Gabriel F, et al. Tokamak D-T neutron source models for different plasma physics confinement modes[J]. Fusion Engineering & Design, 2012, 87(5/6): 787-792.
[9] Hoffmann C, Berganza C, Zhang J. Cold atmospheric plasma: Methods of production and application in dentistry and oncology[J]. Medical Gas Research, 2013, 3(1): 21-35.
[10] Chen Y. High voltage atmospheric cold plasma treatment of refrigerated chicken eggs for control of Salmonella enteritidis on external surfaces[J]. LWT-Food Science and Technology, 2017, 76: 124-130.
[11] Xie J, Xin D, Cao H, et al. Improving carbon fiber adhesion to polyimide with atmospheric pressure plasma treatment[J]. Surface & Coatings Technology, 2011, 206(2): 191-201.
[12] Vasile Nastuta A, Topala I, Grigoras C, et al. Stimulation of wound healing by helium atmospheric pressure plasma treatment[J]. Journal of Physics D Applied Physics, 2011, 44(10): 162-172.
[13] Akishev Y S , Grushin M E , Karal'Nik V B , et al. Generation of a nonequlibrium plasma in heterophase atmospheric-pressure gas-liquid media and demonstration of its sterilization ability[J]. Plasma Physics Reports, 2006, 32(12): 1052-1061.
[14] Attri, P, Arora B, Choi E H. Utility of plasma: a new road from physics to chemistry[J]. Rsc Advances, 2013, 3(31): 12540-12567.
[15] 蒲华寅. 等离子体作用对淀粉结构及性质影响的研究[D]. 广州:华南理工大学,2013.
[16] Misra N N, Kaur S, Tiwari B K, et al. Atmospheric pressure cold plasma (ACP) treatment of wheat flour[J]. Food Hydrocolloids, 2015, 44: 115-121.
[17] Segat A, Misra N N, Cullen P J, et al. Atmospheric pressure cold plasma (ACP) treatment of whey protein isolate model solution[J]. Innovative Food Science & Emerging Technologies, 2015, 29: 247-254.
[18] Dong S, Wang J M, Cheng L M, et al. Behavior of zein in aqueous ethanol under atmospheric pressure cold plasma treatment[J]. Journal of Agricultural and Food Chemistry, 2017, 65(34): 7352-7360.
[19] 邓丽莉,潘晓倩,生吉萍,等. 考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J]. 食品科学,2012,33(24):185-189.
[20] 王晓琳,朱力杰,陈妍婕,等. 不同干热处理对花生蛋白二级结构及乳化性的影响[J]. 食品与发酵工业,2016,42(5):86-90.
[21] 王忠合,王军,李珍妮,等. 超声波处理对豌豆分离蛋白功能特性的影响[J]. 食品工业科技,2015,23(15):116-120.
[22] 邵悦,张琪,张程,等. 超声波对花生蛋白功能特性的影响[J]. 食品工业科技,2012,33(24):130-133.
[23] Ji H, Dong S, Han F, et al. Effects of dielectric barrier discharge (DBD) cold plasma treatment on physicochemical and functional properties of peanut protein[J]. Food and Bioprocess Technology, 2018, 11(2): 344-354.
[24] 吴姣,郑为完,赵伟学,等.有限酶解米渣蛋白的乳化功能特性表征[J]. 食品与发酵工业,2007,33(10):23-26.
[25] İbrahim G, Demet G, Bruce B D, et al. Structural and functional changes in ultrasonicated bovine serum albumin solutions[J]. Ultrasonics Sonochemistry, 2007, 14(2): 173-183.
[26] Cataldo F. On the action of ozone on proteins[J]. Polymer Degradation & Stability, 2003, 82(1): 105-114.
[27] Davies M J. The oxidative environment and protein damage[J]. Biochim Biophys Acta, 2005, 1703(2): 93-109.
[28] Segat A, Misra N N, Fabbro A, et al. Effects of ozone processing on chemical, structural and functional properties of whey protein isolate[J]. Food Research International, 2014, 66: 365-372.
[29] 邵俊花,吴菊清,周光宏,等. 巯基和疏水性对蛋白质乳化及凝胶特性的影响[J]. 食品科学,2013,34(23):155-159.
[30] 刘丽,石爱民,刘红芝,等. 花生蛋白亚基结构与性质研究进展[J]. 中国粮油学报,2016,31(10):151-156.
[31] 雷莉,赵强,范婷,等. 高压微射流处理对白木通籽分离蛋白结构及流变性质的影响[J]. 现代食品科技,2015,31(2):145-150.
[32] Tong P, Gao J, Chen H, et al. Effect of heat treatment on the potential allergenicity and conformational structure of egg allergen ovotransferrin[J]. Food Chemistry, 2012, 131(2): 603-610.
Effects of dielectric barrier discharge cold plasma treatment on solubility and water holding capacity of peanut protein
Ji Hui1,2, Yu Jiaojiao1, Zhang Jin1, Wei Rui1, Li Shuhong1, Chen Ye1※
(1.,,,300457; 2.,276002,)
The peanut protein, a protein-rich byproduct from oil extraction, contains 47%-55% high-quality protein, with low levels of anti-nutritional factors. It exhibits an excellent amino acid profile, a captivating aroma, and an exhilarating white color and is used as cholesterol-free commercial animal protein substitutes. However, its poor functional properties such as low solubility as well as emulsifying, foaming, and gel properties limit its applications. Therefore, improvement in the functional properties of peanut protein may be crucial to increase its application in food industry. Application of cold plasma (CP), a brand-new, nonhazardous and nonthermal, high technology with bright prospects, is currently attracting much attention. CP comprises ultraviolet photons, electrons, positive and negative ions, free radicals, and excited or non-excited molecules and atoms. In combination, these particles can break covalent bonds and initiate various chemical reactions. CP has been widely applied to clean, sterilize, and modify surfaces. Due to the advantages on broadness in frequency range, availability of the high-density non-equilibrium plasma in the larger space, simplicity in process, rapidity, efficiency, as well as other characteristics including energy-saving and environmental friendly, dielectric barrier discharge (DBD) cold plasma is considered to be the most popular plasma technology that can be applied in industry, thus becomes a major concern in the research field in modification of protein. Peanut protein solutions were modified by dielectric barrier discharge (DBD) cold plasma (CP) treatment. Effects of CP treatment on the structure and functional properties of peanut protein were evaluated by analysis of sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE), Fourier transform infrared (FTIR) and protein surface hydrophobicity index (. A significant improvement in solubility and water holding capacity was found to be improved by CP, and reached a maximum value at 2 min treatment, solubility of peanut protein reaches 132.78 mg/L and water holding capacity of peanut protein is 1.93 g/g, increasing by 24.8% and 79.6% respectively compared with untreated samples. At the same time, emulsion ability, emulsion stability, foaming ability, foaming stability and oil absorbing capacity was all improved to some extent after CP treatment. The results showed that the molecular weight of peanut protein remained unaffected, meanwhile, an increase in thesheet and random coil content and a decrease in the-helix and-turn content was found, indicating that the structure of the protein changed from compact to loosen after CP treatment. The results of surface hydrophobicity indicated that CP treatment induced tertiary structural changes of the proteins,of peanut protein was increased remarkably. Our study results will further broaden the application of peanut protein in food industry such as dairy, meat products, and beverages. Furthermore, the operation was easy and the treatment time was short, which may make CP as a novel effective technology for protein modification.
proteins; plasma; structure; cold plasma; peanut protein; functional properties
季 慧,于娇娇,张 金,魏 瑞,李书红,陈 野. 介质阻挡低温等离子处理对花生蛋白持水性及溶解性的影响[J]. 农业工程学报,2019,35(4):299-304. doi:10.11975/j.issn.1002-6819.2019.04.037 http://www.tcsae.org
Ji Hui, Yu Jiaojiao, Zhang Jin, Wei Rui, Li Shuhong, Chen Ye. Effects of dielectric barrier discharge cold plasma treatment on solubility and water holding capacity of peanut protein[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(4): 299-304. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.04.037 http://www.tcsae.org
2018-10-15
2019-02-27
国家自然科学基金资助项目(31701526, 31501503)
季 慧,博士,讲师,研究方向:粮食、油脂及植物蛋白工程。Email:hji8002@126.com
陈 野,博士,教授,研究方向:粮食、油脂及植物蛋白工程。Email:13752758201@126.com
10.11975/j.issn.1002-6819.2019.04.037
TS214.9
A
1002-6819(2019)-04-0299-06
