结肠癌干细胞在结肠癌组织的表达及其对肿瘤线粒体呼吸链的影响
2019-03-27余少鸿赵永恒李建昌宋登辉高俊勇
余少鸿,赵永恒,朱 磊,罗 然,杨 杰,舒 杰,李建昌,宋登辉,高俊勇
(1.云南省昆明市第一人民医院甘美国际医院普外科 650000;2.重庆市涪陵中心医院肿瘤内科 400800)
结肠癌是消化系统常见肿瘤之一[1],虽然有手术、化疗、分子靶向治疗等综合治疗手段,但疗效不佳。肿瘤干细胞理论是近年来提出的新理论[2],可能更好解释肿瘤发生、发展、复发、转移、耐药等过程。研究发现,肿瘤干细胞存在于白血病、乳腺癌、结直肠癌、肝癌、胃癌、胰腺癌等多种肿瘤。2007年首次报道结直肠癌干细胞的存在[3-5],其具有自我更新、多向分化、能连续传代等特征。其鉴定的方法主要是流式细胞仪检测表面标志物CD133、CD44、乙醛脱氢酶1(ALDH1)、上皮细胞黏附分子(epithelial cell adhension molecule,EpCAM)、CD166等。CD44是一种与细胞增殖、肿瘤侵入、血管增生相关的膜受体,动物实验表明,拮抗CD44可抑制肿瘤细胞生长。
分离培养肿瘤干细胞是研究结肠癌干细胞的前提,国内有文献报道,从结肠癌Lovo细胞提取CD44/EpCAM阳性细胞可以达到17.4%[6]。因此,笔者拟采用新鲜结肠癌及结肠癌细胞分离培养结肠癌干细胞,并建立稳定传代的结肠癌干细胞珠。线粒体是细胞能量生成、储存和供给的场所,电子在线粒体内沿电子传递链经氧化磷酸化的方式被转化成含有高能磷酸键的腺苷三磷酸(ATP),线粒体呼吸链酶复合物Ⅰ~Ⅳ是电子传递链的组成成分,其活性变化能直接或间接地反映线粒体呼吸功能的变化。复合物Ⅰ是呼吸酶复合物中最大的一个,高能电子首先经过复合物Ⅰ,释放能量后依次下传。复合物Ⅲ细胞色素C氧化酶(COX)是位于线粒体内膜上呼吸链末端的限速酶,是唯一能将电子传递给氧分子的细胞色素复合物,因此复合物Ⅰ和Ⅲ在整个电子传递及氧化磷酸化过程中起关键作用。本研究探索人结肠癌干细胞COXⅠ、ND1基因mRNA的表达变化。
1 材料与方法
1.1材料 新鲜结肠癌组织选自本院37例结肠癌手术患者标本;人结肠癌HCT-116、HT-29细胞均由中国医学科学院昆明生物研究所惠赠;CD44抗体及CD133抗体均购自德国Miltenyi Biotec公司,Actin抗体、细胞裂解液(RIPA)均购自碧云天公司(中国),10%胎牛血清购自美国Biological Industries公司,Dulbecco改良细胞培养基(DMEM培养基)购自美国Thermo Scientific公司,实时荧光定量PCR仪购自美国ABI公司,流式细胞仪Accuri C6购自美国BD公司。
1.2方法
1.2.1新鲜结肠癌细胞的分离 选取结肠癌患者新鲜病理标本,剪碎标本,离心,DTT液去除黏膜,PBS液冲洗4次,DNA裂解酶分离裂解标本,PBS液洗涤,DNA酶拮抗剂中和,磨碎标本,离心,提取结肠癌细胞。
1.2.2细胞培养与分离 将结肠癌细胞株接种于含10%胎牛血清的DMEM培养液中,在37℃、5%CO2的培养箱中培养,常规传代。CD44磁珠与人新鲜结肠癌细胞、HT29细胞和 HCT116细胞孵育,然后用LS柱(Miltenyi Biotec,130042401)与磁珠分选起始套装(Miltenyi Biotec,130091051)混合分离CD44+细胞;CD44+/-细胞培养于DMEM/F12 培养液(Gibico,1237830),包括cEGF、bEGF和B27等因子。而没有分离的细胞培养于DMEM 培养液(HyClone,SH30243.01B)。每隔3 d显微镜下观察细胞生长情况。
1.2.3流式细胞仪检测其表面标记物 收集结肠癌细胞后,把每管0.5 mol/L细胞,离心,取沉淀,混匀,添加抗体IgG1-PE、IgG1-FITC、CD133-PE和CD44-FITC(各2 μL/0.5 mol/L)在2~8 ℃孵育。CD133或CD44阳性细胞由流式细胞仪Accuri C6筛选。重悬细胞于培养液中继续培养。
1.2.4细胞总RNA的提取和鉴定 结肠癌干细胞继续培养8 h,以同期培养的结肠癌细胞株为对照,提取细胞总RNA。首先用PBS缓冲液将细胞清洗3遍,而后按照TRIzol试剂说明书的步骤进行操作,最终提取的RNA以DEPC水溶解后加入DNase酶消化去除DNA,并利用紫外分光光度计测定RNA的浓度与纯度,琼脂糖凝胶电泳检测RNA的完整性。
1.2.5引物合成 ND1、COXⅠ、t3-actin引物由上海生工生物工程有限公司合成。根据人线粒体基因组序列(www.mitomap.org),应用Primer Premier 5.0设计mtDNA上的3对引物,且以看家基因t3-aetin作为内参照,并在BLAST上进行同源性分析,引物核苷酸序列如下:ND1上游引物5′-AATCGCAATGGCATTCCTAA-3′,下游引物5′-GTAGAGGGTGATGGTAGATGTG-3′,长度229 bp;COXⅠ上游引物5′-TACCCATCATAATC GG A G GC-3′,下游引物5′-ATAGCAGATGCGAGCAGGAG-3′,长度223 bp;t3-actin上游引物5′-ACTTAGTT GCGAC ACC CrnC-3′,下游引物5′-GACTGCTGTCACCTTCACCG-3′,长度162 bp。
1.2.6实时荧光定量PCR(Real-time PCR)法检测ND1及COXⅠ mRNA的表达 定量检测线粒体基因表达。反应体系25 mol/L:2×SYBR green 12.5 μL,cDNA模板2 μL,上下游引物各0.2 μL,补双蒸水至25 μL,每个样品设置3个平行样。反应条件:95 ℃预变性10 min后进行下述40个循环,95 ℃变性15 s,60 ℃退火和延伸1 min。由于本研究使用的是相对定量方法,所以必须观察融解曲线来优化引物含量。

2 结 果
2.1细胞形态 分选新鲜结肠癌细胞、HT-29细胞、HCT-116细胞中CD44+分别为2.1%、4.0%及4.6%,后继实验证明细胞生长良好,见图1。
2.2流式细胞仪检测其生物学特征 结肠癌细胞、HCT-116细胞、HT-29细胞中CD44及CD133表达同时阳性细胞百分率仅为0%、1.8%及2.1%,见图2。
2.3各组ND1 mRNA的表达情况 与CD44-比较, CD44+的结肠癌细胞ND1 mRNA的表达水平升高了300%,HCT-116细胞升高了400%,差异均有统计学意义(P<0.05);而HT-29细胞只升高了5%,差异无统计学意义(P>0.05),见图3、4。

图1 各组CD44+细胞形态

图2 流式细胞技术检测各组CD133/CD44阳性表达情况
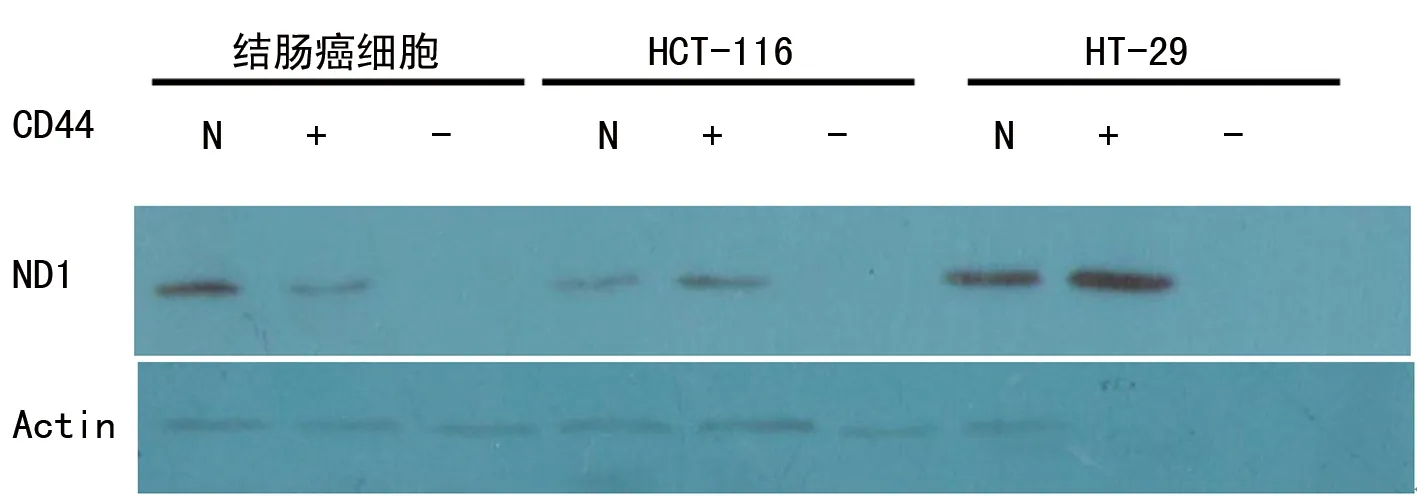
图3 各组ND1 mRNA PCR电泳情况
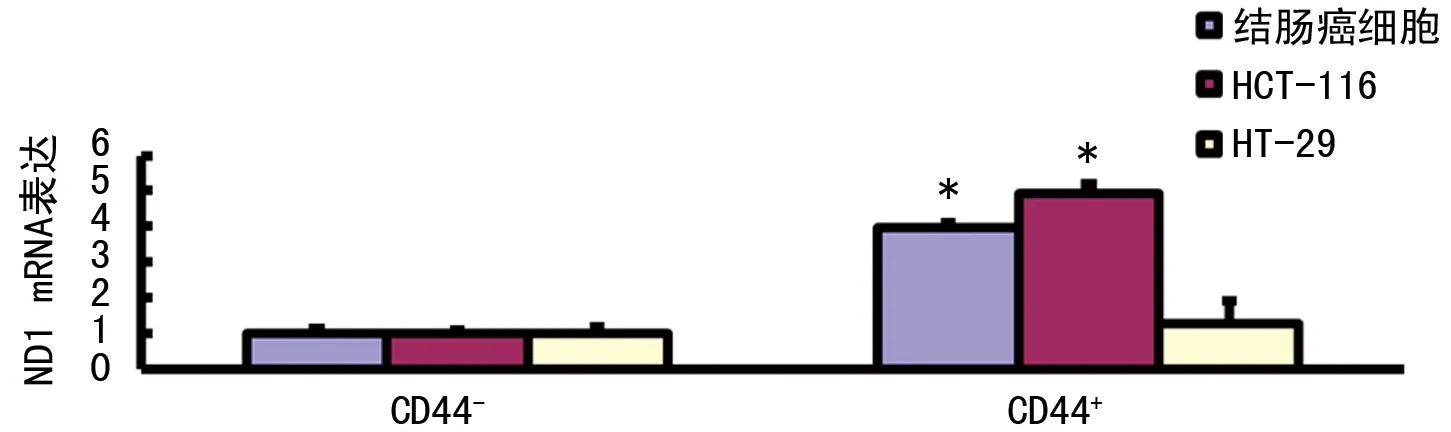
*:P<0.05,与CD44-细胞比较
图4各组ND1 mRNA的表达情况
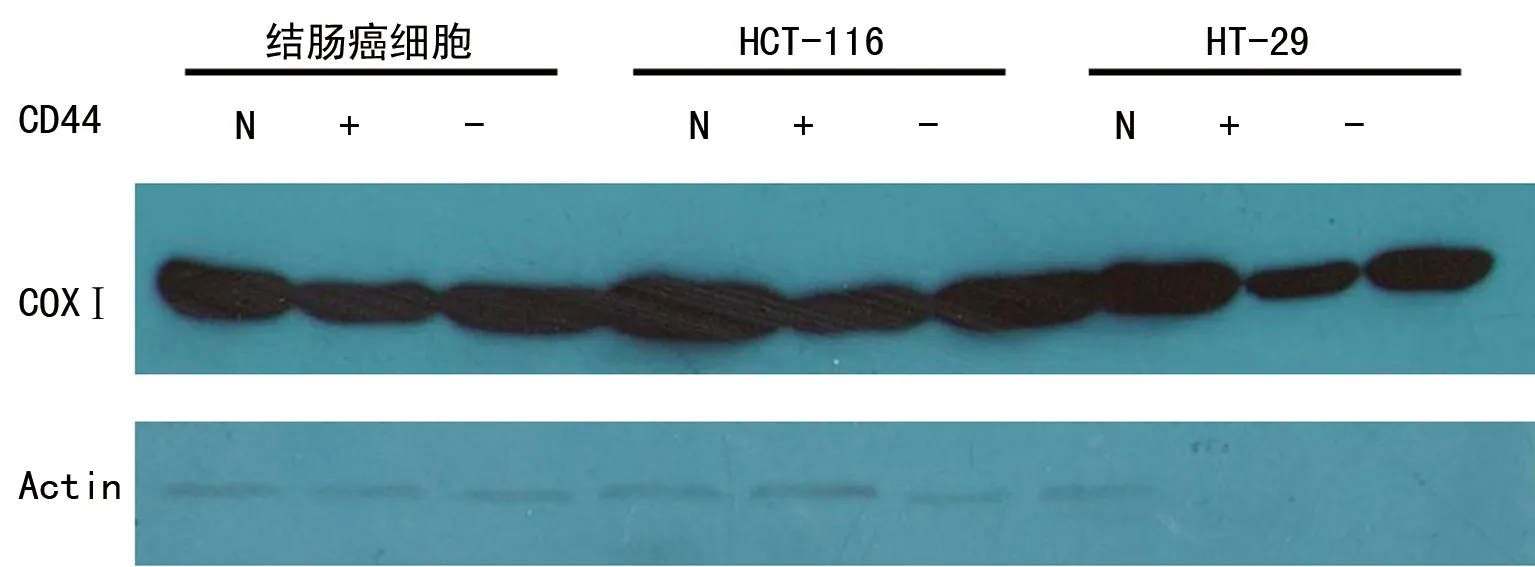
图5 各组COXⅠ mRNA PCR电泳情况
2.4各组COXⅠ mRNA的表达情况 与CD44-比较, CD44+的结肠癌细胞COXⅠ mRNA的表达水平升高了350%,HT-116细胞升高了300%,差异均有统计学意义(P<0.05);而HT-29细胞无明显变化,差异无统计学意义(P>0.05),见图5、6。

*:P<0.05,与CD44-比较
图6各组COXⅠ mRNA的表达情况
3 讨 论
肿瘤干细胞学说认为[7-9]:肿瘤细胞存在异质性,其中一小群具有自我更新、无限增殖能力和不定分化潜能的肿瘤细胞即为肿瘤干细胞,是肿瘤形成的起始细胞,并维持肿瘤的生长;肿瘤干细胞对放疗及化疗药物不敏感[10-11],可能是肿瘤转移、复发的根源。目前绝大多数常见恶性肿瘤的肿瘤干细胞分离已取得成功,本实验选取37例新鲜结肠癌患者病理标本及两种人结肠癌细胞系。HT-29是人高分化结肠癌细胞,易形成球形,用于观察肿瘤细胞间细胞连接与免疫细胞作用;HCT-116是人来源结肠癌细胞,处于结肠癌分化早期阶段,更接近于干细胞特性;以CD44表面抗原为基础,联合CD133表面抗原,以肿瘤干细胞特有和必需的生物学特性,证实肿瘤干细胞具有自我更新、增殖分化能力、强致瘤性及遗传稳定性,分离、鉴定了结肠癌干细胞,为下一步分子生物学研究提供基础。
人们对线粒体的认识已不再停留在“细胞能量工厂”的最初阶段,目前的研究认为线粒体还参与氧化损伤、细胞凋亡和人类进化,甚至与一些慢性退行性疾病和多种肿瘤的发生相关。近年来,越来越多的关于线粒体的研究已深入到线粒体膜通透性转变孔道、线粒体膜点位、Ca2+负荷、氧化损伤、凋亡前体分子、线粒体基因组稳定性、线粒体DNA缺失及拷贝数变化等方面[12],但有关线粒体基因表达方面的研究较少。研究表明,放射可诱导人线粒体COXⅠ、ND1和ND6表达升高[13]。结肠癌发生与线粒体细胞色素氧化酶COXⅠ缺乏与突变有关[14-15]。本研究结肠癌干细胞线粒体呼吸氧化系统酶指标明显升高,代谢更加活跃,干细胞需要能量及需氧量更加旺盛,阻断ND1或COXⅠ的表达有可能会抑制肿瘤细胞的生长。因此,抑制线粒体呼吸系统酶活性有望成为治疗肿瘤的又一潜在指标。
