COPD急性加重期不同临床表型相关性分析
2019-03-27郭太平孟凡亮
郭太平,孟凡亮
(安徽医科大学附属巢湖医院呼吸内科,合肥 238000)
慢性阻塞性肺疾病(COPD)发病率和病死率高,预计到2020年成为世界第三大死亡原因。COPD是一种异质性疾病,不同患者的病理生理、影像学改变、临床表现、病情进展、治疗反应和预后均有很大差异,可分为与易感因素、呼吸生理、临床表现、影像学和合并症相关的多种表型,能够反映疾病特征和严重程度的差异,其中肺功能表型和全身炎性反应表型是重要的COPD相关表型[1]。虽然目前肺功能是评估COPD严重程度的主要指标,但不能全面反映COPD的异质性,探讨多种表型之间的相关性对于指导表型特异性治疗和判断预后具有重要意义。炎症机制和自身免疫机制与COPD的发生、发展有关,多种炎症介质如白细胞介素(IL)-6、超敏C反应蛋白(hs-CRP)异常表达和炎性细胞浸润在COPD气道炎症和全身炎症的发生、发展中起重要作用[2-3]。研究发现,COPD患者气道、肺实质及肺血管均有T淋巴细胞浸润,COPD患者免疫功能紊乱[4-5]。COPD肺功能持续不可逆地恶化,严重影响患者的生活质量,慢性阻塞性肺疾病评估测试(CAT)是评估CODP患者生活质量和病情严重程度的重要工具,在欧美国家广泛应用,但国内关于CAT评分与炎症和免疫等多项指标间的综合分析甚少[6]。目前COPD全身炎性反应和自身免疫紊乱与COPD严重程度和临床表现之间的关系尚未完全明确。本文通过研究COPD急性加重期不同分级患者hs-CRP、IL-6与T淋巴细胞亚群水平的变化及其与CAT评分和肺功能的相关性,探讨上述指标在COPD急性加重期病情评估中的应用价值。
1 资料与方法
1.1一般资料 收集2017年9月至2018年4月因COPD急性加重入住本院呼吸内科的患者90例,其中男66例,女24例,年龄52~87岁,平均(72.5±7.7)岁,体质量指数(BMI)15.22~29.52 kg/m2,平均(21.65±3.53)kg/m2,吸烟指数515(0,800),均符合中华医学会呼吸病学分会2013年修订的《慢性阻塞性肺疾病诊治指南》的诊断标准和分期定义[7]。排除标准:(1)合并哮喘、肺结核、支气管扩张、肺间质纤维化等其他慢性肺疾病;(2)合并严重的心、肝、肾疾病;(3)恶性肿瘤;(4)自身免疫性疾病;(5)肺外感染性疾病;(6)近1个月内接受过全身激素治疗者(口服或静脉注射治疗)。按慢性阻塞性肺疾病全球倡议(GOLD)分级分为4组,Ⅰ级20例、Ⅱ级25例、Ⅲ级25例、Ⅳ级20例。各组年龄、性别比例、BMI、吸烟指数比较,差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经伦理委员会批准,患者及家属知情同意。
1.2方法
1.2.1检测方法 受试对象入院次日空腹采集肘静脉血4 mL,静置30 min,4 000 r/min离心5 min,分离血清,-20 ℃保存备检。血清hs-CRP采用免疫比浊法检测,试剂盒由上海酶联生物科技有限公司生产;IL-6采用上转发光法检测,试剂盒由北京热景生物技术股份有限公司生产;T淋巴细胞亚群采用流式细胞术检测,包括CD3+、CD4+、CD8+、CD4+/CD8+,流式细胞仪为美国BD FACSCantoTMⅡ型,采用配套试剂,操作均按试剂盒说明书进行。
1.2.2CAT评分 采用CAT量表,由患者在入院当天独立对各项目进行评分,量表包含咳嗽、咳痰、胸闷、爬坡或爬一层楼的感觉、家务活动、外出信心、睡眠质量、精力8个项目,总分40分,0~10分为轻微影响患者,11~20分为中等影响患者,21~30分为严重影响患者,31~40分为非常严重影响患者。
1.2.3肺功能 患者入院次日行肺功能检查,均由同一位医师测定,采用德国耶格肺功能仪,检测指标包括1 s用力呼气容积(FEV1)、1 s用力呼气容积占预计值百分比(FEV1%pred)、1 s用力呼气容积占用力肺活量比值(FEV1/FVC)。

2 结 果
2.1CAT评分、hs-CRP、IL-6、肺功能比较 不同GOLD分级CAT评分、hs-CRP、IL-6随GOLD分级增加而增加,差异有统计学意义(P<0.05);肺功能指标FEV1、FEV1%pred、FEV1/FVC随GOLD分级增加而降低,差异有统计学意义(P<0.05),见表2。
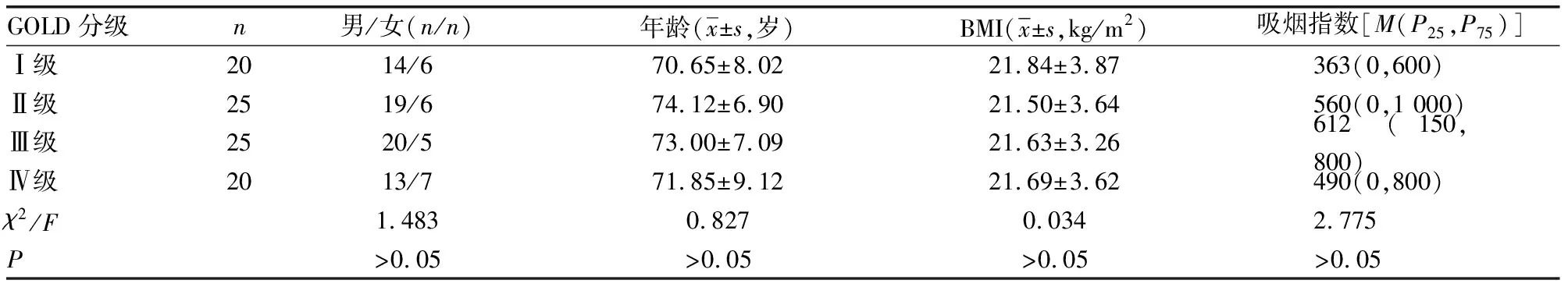
表1 不同GOLD分级性别比例、年龄、BMI、吸烟指数比较

表2 不同GOLD分级CAT评分、hs-CRP、IL-6、肺功能指标比较
*:P<0.05,与Ⅰ级比较;#:P<0.05,与Ⅱ级比较;△:P<0.05,与Ⅲ级比较

表3 不同GOLD分级T淋巴细胞亚群比较
*:P<0.05,与Ⅰ级比较;#:P<0.05,与Ⅱ级比较;△:P<0.05,与Ⅲ级比较
2.2T淋巴细胞亚群比较 不同GOLD分级T、CD8+差异无统计学意义(P>0.05);Ⅳ级CD4+低于其他3级,Ⅲ级CD4+低于Ⅰ级和Ⅱ级,差异有统计学意义(P<0.05),Ⅰ级和Ⅱ级CD4+差异无统计学意义(P>0.05);CD4+/CD8+随GOLD分级增加而降低,差异有统计学意义(P<0.05),见表3。
2.3相关性分析 hs-CRP与IL-6呈正相关(r=0.563,P<0.01);hs-CRP、IL-6与CD4+、CD4+/CD8+均呈负相关(hs-CRP:r=-0.498、-0.654;IL-6:r=-0.457、-0.598,P<0.01);hs-CRP、IL-6与FEV1、FEV1%pred、FEV1/FVC均呈负相关(hs-CRP:r=-0.694、-0.770、-0.732;IL-6:r=-0.641、-0.694、-0.631,P<0.01);CD4+、CD4+/CD8+与FEV1、FEV1%pred、FEV1/FVC均呈正相关(CD4+:r=0.624、0.602、0.508;CD4+/CD8+:r=0.738、0.825、0.812,P<0.01);CAT评分与hs-CRP、IL-6均呈正相关(r=0.605、0.596,P<0.01),与CD4+、CD4+/CD8+、FEV1、FEV1%pred、FEV1/FVC均呈负相关(r=-0.501、-0.722、-0.652、-0.812、-0.775,P<0.01)。
3 讨 论
COPD作为一种高度异质性疾病,表型分类标准尚不统一,各表型之间存在交互影响机制,单纯根据病理生理、临床表现、易感因素的表型分类不能全面地反映COPD的异质性,探讨不同表型特异性指标之间的相关性,有助于多维评估COPD患者的全身状态,更好地指导个体化治疗[8]。全身炎性反应表型是重要的COPD表型之一。COPD炎症并不局限于气道和肺实质,而是表现为全身炎性反应异常激活,CRP、IL-8、IL-6、肿瘤坏死因子(TNF)-α和瘦素等循环细胞因子增加[9]。研究发现全身炎性反应在COPD病程中持续渐进发展,血清IL-6和CRP水平升高可预测COPD患者的病死率[10]。EMAMI等[11]研究发现,稳定期COPD患者血清IL-6和CRP随GOLD分级升高而升高,IL-6与FEV1和FEV1/FVC呈正相关。RUBINI等[12]认为,IL-6在诱导气道阻力增加中具有致因作用,IL-6通过促进胶原聚集、抑制细胞外基质分解和刺激成纤维细胞增殖参与COPD气道重塑。本研究结果显示血清hs-CRP、IL-6水平与气流受限程度呈正相关,推测炎症因子高表达可促进COPD患者的气道黏液高分泌和气道重塑,从而促使肺功能恶化,检测血清IL-6、hs-CRP水平可反映急性加重期炎症程度。
COPD患者稳定期和急性加重期免疫功能均低下,诱发反复呼吸道感染致气道重塑和气流阻塞,促使COPD渐进性恶化。正常免疫功能的维持与T细胞亚群的分布密切相关,CD4+/CD8+比值的相对稳定性是维持正常免疫功能的重要因素。本研究结果显示细胞免疫功能与气流受限程度呈负相关,推测CD4+T细胞的减少可导致辅助抗体生成和辅助淋巴细胞作用的降低,而CD8+T细胞的增加可导致抗体生成的抑制,T淋巴细胞免疫功能失衡,呼吸道防御能力下降,患者易反复感染导致COPD恶化;同时炎症因子水平与细胞免疫功能呈负相关,提示炎症介质和细胞免疫存在交叉影响机制,共同促进COPD的发生与发展。
随着对 COPD 的认识越来越深入,从以前单纯强调肺功能分级,到现在更全面的综合急性发作次数和主观症状进行病情评估,更有利于针对特异表型的个体化治疗[13]。肺功能可反映气流受限的严重程度,FEV1快速下降与高住院率和高病死率密切相关,以肺功能为代表的生理学指标变化是一种独特的COPD表型[14],但就个体用药而言,仅肺功能指标并不能完全反映COPD患者的总体情况,不能单独用于指导COPD的治疗。2011年GOLD使用CAT评分作为评估COPD临床症状的工具,为COPD临床症状和生存质量的评估提供了客观和可靠的基础。GHOBADI等[15]发现稳定期血清IL-6水平与GOLD分级和CAT评分均呈正相关,炎症标志物的增加与生活质量的降低和缺氧程度有关。本研究结果显示CAT评分与肺通气指标呈负相关,与炎症因子水平呈正相关,推测可能是COPD患者体力活动的减少增加了炎症因子如CRP、IL-6和纤维蛋白原等的表达[16];同时CAT评分与细胞免疫功能呈负相关,提示患者生存质量的下降与全身炎性反应和细胞免疫功能的下降密切相关。因此包括CAT评分、肺功能指标、炎症和细胞免疫水平的多种表型相关因子的综合评估有助于判断COPD急性加重期病情严重程度,对指导个体化治疗和判断预后具有重要意义。
