米非司酮对大鼠子宫内膜异位病灶中COX-2及VEGF表达的影响
2019-03-27李玉洁
南 燕,李玉洁
(新乡医学院第三附属医院妇产科,河南新乡 453003)
子宫内膜异位症是一种常见的良性妇科病症,以慢性盆腔痛、性交痛、不孕、月经失调等为主要临床表现,对生育期女性的健康造成严重不良影响,在不孕患者中发病率高达25%~50%[1],但其作用机制尚未阐明,临床治疗难度较大,近些年来该病的发病率呈逐年上升的趋势。目前临床上治疗子宫内膜异位症的方法多种多样,但是只有彻底明确药物治疗的作用机制,才能保障用药安全性和合理性。本研究选取造模成功的子宫内膜异位症大鼠作为研究对象,观察不同剂量米非司酮对子宫内膜异位症的疗效,以及环氧合酶-2(COX-2)与血管内皮生长因子(VEGF)表达的影响。
1 材料与方法
1.1实验动物 选取8周龄健康雌性SD大鼠,体质量200~220 g,由新乡医学院实验动物中心提供,在室温18~26 ℃、相对湿度40%~70%的环境内饲养,自由饮水、饮食。通过阴道脱落细胞检查确认均为处于发情期的性成熟大鼠。
1.2方法
1.2.1造模及分组 用10%水合氯醛给予SD大鼠腹腔注射麻醉,在腹部正中做长约2 cm的纵行切口。分离大鼠子宫,切断中部的一段子宫,两端结扎。然后将管状子宫剪切成两块子宫片段,大小均为5 mm×4 mm,其中一部分保存在-80 ℃冰箱冻存,另一部分缝合于腹部切口处腹肌与皮下筋膜层之间,常规关腹。术后每天观察腹部切口及包块情况,4周后再次开腹,可见移植病灶体积明显增大,并有液体积聚的透明小泡,囊壁表面有新生血管形成,HE染色显微镜下观察可见腺体及间质细胞,说明造模成功[2]。建模成功的112只大鼠分为对照组、低剂量组、中剂量组、高剂量组,每组28只。
1.2.2药物及剂量 采用米非司酮原药粉,由浙江仙琚制药公司提供。低、中、高剂量分别对应临床用药 10、12.5、25 mg/d,根据实验动物学药物换算公式:大鼠用药剂量=(用药剂量/60 kg)×大鼠体质量(kg)×6.25,进行计算后得出低剂量组给药剂量为1.041 mg·kg-1·d-1,中剂量组给药剂量为1.24 mg·kg-1·d-1,高剂量组给药剂量为2.604 mg·kg-1·d-1。将米非司酮原药粉与花生油进行融合,形成 1 mg/mL 混悬液后灌胃,对照组仅给予1 mL花生油灌胃。
1.2.3观察指标
1.2.3.1异位内膜病灶体积变化 建模成功后用游标卡尺测量异位囊肿的长、宽、高,根据公式V=0.52×长×宽×高[3],计算体积 V1。灌胃治疗4周后,再次剖腹测量并计算异位囊肿的体积V2,处死大鼠取异位病灶组织,放入-80 ℃冻存。
1.2.3.2RT-PCR法检测COX-2、VEGF的表达水平 Trizol裂解细胞,检测并计算出RNA的浓度和纯度,反转录后进行PCR,条件为94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共40个循环,72 ℃再延伸7 min,4 ℃保存。COX-2上游引物:5′-AGA AGT TGA TAA TCG GGT AGT C-3′,下游引物:5′-CCT AGT GAA GGA TGG GTC-3′;VEGF上游引物:5′-ATC TTC AAG CCG TCC TGT GTG-3′,下游引物:5′-TTC TCC GCT CTG AAC AAG GC-3′;GAPDH上游引物:5′-GGC AAG TTC AAG GCA CAG-3′,下游引物:5′-GCC AGT AGA CTC CAC GAC AT-3′。采用2-ΔΔCt法计算出 COX-2、VEGF mRNA表达[4]。

2 结 果
2.1造模前后两种内膜组织中COX-2、VEGF mRNA的表达情况 造模成功后大鼠腹壁异位内膜组织中COX-2 mRNA、VEGF mRNA的表达水平较造模前在位内膜组织明显升高(P<0.05),见表1。

表1 造模前后不同内膜组织中COX-2、VEGF mRNA表达比较
2.2各组大鼠异位内膜病灶体积变化 治疗后,与对照组比较,其他3组异位内膜病灶体积明显缩小,差异有统计学意义(P<0.05);米非司酮各治疗组治疗后较治疗前均有缩小,差异有统计学意义(P<0.05),见表2。
表2 各组大鼠异位内膜病灶体积变化
a:P<0.05,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.05,与中剂量组比较

表3 各组大鼠内膜异位组织中COX-2、VEGF mRNA表达
a:P<0.05,与对照组比较;b:P<0.05,与低剂量组比较;c:P<0.05,与中剂量组比较
2.3各组大鼠COX-2、VEGF mRNA表达情况 不同剂量米非司酮治疗组COX-2、VEGF mRNA表达水平均低于对照组,差异有统计学意义(P<0.05),且随剂量增加呈下降趋势(P<0.05),见表3、图1。
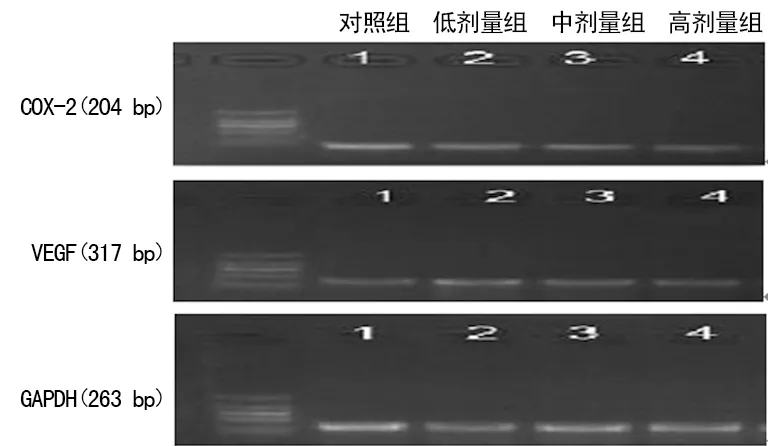
图1 各组异位内膜组织中COX-2、VEGF mRNA的表达
2.4Pearson相关性分析 COX-2 和VEGF 的表达具有明显的相关性(r=0.782,P<0.05)。
3 讨 论
子宫内膜异位症是一种激素依赖性疾病,其发病机制目前尚不清楚,可能与年龄、月经周期、口服避孕药等因素相关[5],临床表现主要有盆腔疼痛、月经紊乱及不孕等,且存在恶变的可能[6]。根据患者病情严重程度、年龄、有无生育要求及意愿等可选择手术、药物及手术联合药物治疗等方法。目前临床上常用的药物有来曲唑、高效孕激素、促性腺激素释放激素激动剂等[7],但这些药物均有明显不良反应。
米非司酮可拮抗雌、孕激素,以及下调其受体,影响体内多种细胞因子的代谢和产生,如黏附分子、抗侵袭因子、抗血管生成因子等。自KETTLE等于1991年首次将米非司酮用于临床治疗子宫内膜异位症,已有20多年,但其作用机制尚不明确,也无推荐的使用剂量。现有的治方案中使用腹腔镜与米非司酮联合治疗子宫内膜异位症,临床疗效好,复发率降低[8]。有研究证实雌激素能促进COX-2表达,从而诱导PGE2 的产生,而米非司酮能通过其抗雌激素作用,干扰PGE2对异位子宫内膜的刺激作用[2]。也有研究表明,米非司酮能使宫内膜腺体及间质中雄激素受体(AR)表达增加,通过高雄激素抑制雌激素的作用。LI 等[9]通过大鼠异位症模型证实米非司酮能够降低COX-2基因转录,使其蛋白表达下降,从而达到降低前列腺素分泌。BOUCHARD研究表明:米非司酮可以抑制异位内膜病灶组织在腹腔中的植入及促进凋亡[10]。
COX-2是一种膜结构蛋白,能将花生四烯酸转代谢成各种PG产物,多种生长因子、细胞因子、肿瘤启动因子、激素等可诱导COX-2产生。研究表明,COX-2可能和子宫内膜异位症的发生、发展相关,它参与了异位内膜血管的生成。COX-2对子宫内膜异位症患者异位内膜高表达的机制如下:(1)雌激素可以直接或间接调节COX-2表达;(2)异位内膜损伤可产生如IL-1和IL-2等多种细胞因子,能刺激COX-2的表达;(3)子宫内膜异位症是一种雌激素依赖性疾病,雌激素可以增加自身抗体合成,但后者能增加上皮细胞COX-2的表达。
血管形成是子宫内膜异位症致病和病情进展的重要因素,VEGF可通过促进血管内皮细胞的增殖,促进血管形成和生长[11-12],作用尤为显著。黎俊伶[13]研究证实,VEGF参与了新生血管内皮细胞的有丝分裂,促进了新生血管的形成能力,与子宫内膜异位症的发病、进展密切相关。秦江霞等[14]发现COX-2、VEGF、MVD在子宫内膜异位症中的高表达,与在子宫内膜异位的血管生成有关。近期JANA等[15]发现MMP-2参与细胞迁移和侵入,可通过COX-2-PGE2-pAKT轴途径促进子宫内膜异位症的血管生成。SUTRISNO等[16]发现COX-2可以使肿瘤细胞内的VEGF表达上调,可能是通过一系列的转导机制调控了VEGF的表达,参与了血管的生成。
本实验结果显示,造模前后在位子宫内膜组织和异位子宫内膜组织中COX-2、VEGF mRNA水平明显升高。当给予米非司酮干预后,子宫内膜异位症模型大鼠异位内膜病灶面积明显缩小,说明米非司酮能有效抑制异位内膜的生长和侵袭,这与BOUCHARD研究结果一致。异位内膜组织中COX-2、VEGF mRNA水平明显降低,说明COX-2、VEGF与子宫内膜异位症的发生、发展密切相关,这些结果与秦江霞等的研究也相符。米非司酮对子宫内膜异位症模型大鼠异位内膜病灶的疗效具有剂量依赖性,米非司酮可通过下调COX-2的水平减少VEGF的生成,从而控制异位病灶蔓延,这也证实了SUTRISNO等的推理。本实验证明较短周期的高剂量米非司酮对子宫内膜异位症可取得较好临床疗效,而且米非司酮具有廉价、口服吸收快、生物利用度高、不良反应少等优势,临床应用价值高。但长期大量使用后伴随的药物副反应及药物副反应最低的理想治疗剂量的选取仍需进一步研究。本次实验样本量较小,后期仍需大样本量资料验证,期望为子宫内膜异位症的临床治疗提供动物实验参考。
