1,25-二羟基维生素D3对脂肪细胞脂滴代谢的影响
2019-03-27向薇,程实,马玲
向 薇,程 实,马 玲
(1.新疆医科大学公共卫生学院,乌鲁木齐 830011;2.西南医科大学公共卫生学院营养与食品卫生学教研室,四川泸州 646000)
肥胖是全世界范围内重要的公共卫生问题[1],从细胞层面看,肥胖发生的原因在于脂肪细胞体积肥大和增生所造成,而这些现象的主要原因之一就是细胞内脂肪过度的堆积[2],其在形态上主要表现为中央超大脂滴的形成。细胞形态的改变,脂滴作为脂肪细胞内一种特殊的细胞器,在调节细胞内脂质代谢过程中起到关键作用,其过度的膨大将会导致生物体脂质代谢紊乱[3],是胰岛素抵抗、2型糖尿病、非酒精性脂肪肝病等疾病的重要特征之一[4]。
1,25二羟基维生素D3[1,25(OH)2D3]在骨骼中的作用早已被大量且深入的研究,而近些年,越来越多的证据表明1,25(OH)2D3的缺乏是肥胖的独立危险因素[5]。细胞研究也发现1,25(OH)2D3可在体外培养的脂肪细胞中起到调节脂肪代谢的作用,并明显抑制脂肪生成,减少细胞内脂肪含量[2]。虽然1,25(OH)2D3对脂肪细胞脂质代谢的研究已有很多,但结果并不一致,且其对脂肪细胞脂滴融合能力影响的研究还未见报道。本研究观察其对细胞脂滴形态和脂肪细胞脂滴融合相关基因的影响,为其有效地防治提供新的思路。
1 材料与方法
1.1材料
1.1.1细胞系 3T3-L1细胞系购自美国ATCC公司,用含10%胎牛血清和1%双抗的DMEM高糖培养基,在37 ℃、5%CO2的无菌培养箱中进行细胞培养,每隔2 d更换1次培养基。当细胞生长至80%~90%时进行传代。
1.1.2主要试剂及仪器 1-甲基-3-异丁基黄嘌呤(IBMX)、地塞米松、1,25(OH)2D3(美国Sigma公司),胰岛素注射液(江苏万邦生化医药股份有限公司),二甲基亚砜(DMSO,上海生工生物工程股份有限公司),棕榈酸(PA,北京Solarbio公司),牛血清白蛋白(BSA,德国Biofroxx公司),油红O、BCA法蛋白检测试剂盒、三酰甘油(TG)试剂盒(南京建成生物技术研究所);RNAiso Plus和SYBR Premix Ex TaqTM Ⅱ (日本TAKARA公司),cDNA反转录试剂盒(美国Applied Biosystems公司),酶标仪(美国BIO-RAD公司),CO2培养箱、离心机、超净工作台、PCR仪(美国Thermo公司),倒置显微镜(日本Olympus公司),水浴锅(北京永光明医疗仪器有限公司),电子天平(上海天美天平仪器有限公司)。
1.2方法
1.2.1诱导液的配置 诱导液Ⅰ,在含10%胎牛血清的高糖DMEM培养基中加入0.5 mmol/L的IBMX、10 μg/mL胰岛素、1 μmol/L地塞米。诱导液Ⅱ,在含10%胎牛血清的高糖DMEM培养基中加入10 μg/mL胰岛素。
1.2.2不同浓度PA溶液 取30% BSA溶液,置于55 ℃水浴中30 min;将PA置于0.01 mol/L的NaOH溶液中配成10 mmol/L的PA储存液,于70 ℃水浴中30 min,在70 ℃条件下分别取330 μL的30% BSA溶液迅速与100、300、600、900 μL PA储存液混合振荡,用10%FBS高糖DMEM定容于10 mL,于超净台中过滤,分别得到100、300、600、900 μmol/L的PA培养液,现用现配。
1.2.3诱导分化 采用“鸡尾酒法”,将细胞以每毫升2×105个接种于6孔板中,待细胞接触抑制48 h后,将细胞培养基换为诱导液Ⅰ(计为分化第0天),每2天换1次液。4 d后换诱导液Ⅱ,每2天换1次液。至分化第8天时,90%以上细胞分化为成熟脂肪细胞。
1.2.4肥大脂肪细胞模型的建立 将细胞以每毫升2×104个接种于96孔板中,当细胞接触抑制后按上述方法进行诱导分化,待3T3-L1细胞分化为成熟脂肪细胞后,分别用0、100、300、600、900 μmol/L的PA培养液干预24 h后,进行MTT细胞活力检测。同样将细胞以每毫升2×105个接种于6孔板中,待细胞分化为成熟脂肪细胞后,用不同浓度的PA培养液干预24 h后,测细胞质TG,根据试剂盒说明书进行。筛选出最佳干预浓度。
1.2.5不同浓度1,25(OH)2D3干预 将正常培养的3T3-L1细胞按照每毫升2×105个接种于6孔板中,当细胞接触抑制48 h后进行诱导分化。待细胞分化为成熟脂肪细胞后,根据筛选出的最佳PA浓度进行造模,造模24 h后分别用1、10、100 nmol/L的1,25(OH)2D3对模型细胞干预24 h,并设置分化成熟的脂肪细胞为对照组,PA干预的为模型组,以及3个不同浓度的干预组。
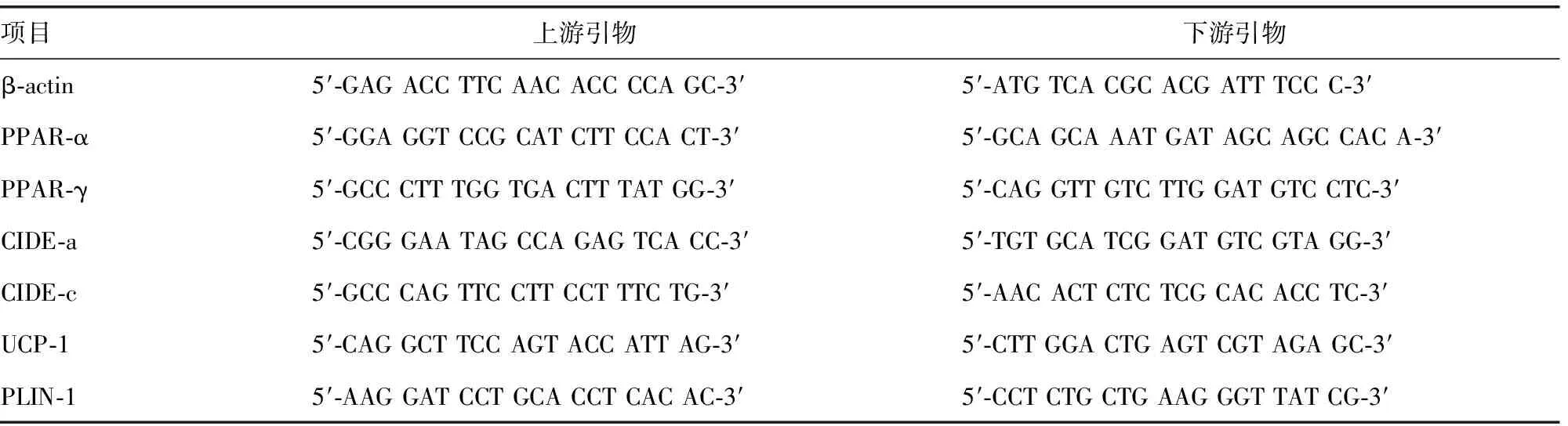
表1 引物设计和合成
PPAR:过氧化物酶体增殖物激活受体;CIDE:细胞死亡诱导DFF45样效应物
1.2.6油红染色 按照上述方法诱导分化8 d后,将培养基吸出,每孔加1 mL的PBS冲洗2次,每孔加1 mL的4%多聚甲醛固定15~20 min。弃去多聚甲醛,PBS冲洗后,加入油红染色15 min,吸出染剂后加入PBS润洗,于倒置显微镜下观察各组脂滴形成情况。
1.2.7脂滴数量和平均直径 采用Image-pro plus 6.0计算干预后各组脂滴数量和平均直径。
1.2.8TG水平 检测干预后各组TG水平。
1.2.9RT-qPCR 提取RNA,反转录成cDNA,稀释5倍后,RT-qPCR检测PPAR-α、PPAR-γ、CIDE-a、CIDE-c、UCP-1、PLIN-1 mRNA表达情况。PCR的反应条件为:95 ℃ 30 s,预热;95 ℃ 5 s,60 ℃ 30 s,40个循环。上下游引物见表1。
1.3统计学处理 采用SPSS 21.0 统计软件进行分析。对实验所得计量数据进行正态性检验,方差齐者多组间直接用单因素ANOVA分析组间整体差异,如有差异则用Tukey法进行两两比较;方差不齐者用Brown-Forsythe对单因素ANOVA结果进行校正,如果有差异则用Games-Howell法进行两两比较。如果数据不符合正态性,则用非参数的秩和检验进行统计分析。P<0.05为差异有统计学意义。
2 结 果
2.1筛选最佳PA浓度 MTT检测结果表明,600 μmol/L和900 μmol/L PA可使分化后的3T3-L1细胞活力下降,差异有统计学意义(P<0.05),不作为最佳造模浓度。剩余组别中300 μmol/L组细胞TG水平最高,差异有统计学意义(P<0.05),本研究最终选用300 μmol/L PA浓度作为造模最佳浓度,见图1。

A:各浓度PA干预后细胞活力;B:各浓度PA干预后TG水平;*:P<0.05,与对照组相比
图1筛选最佳PA浓度造模
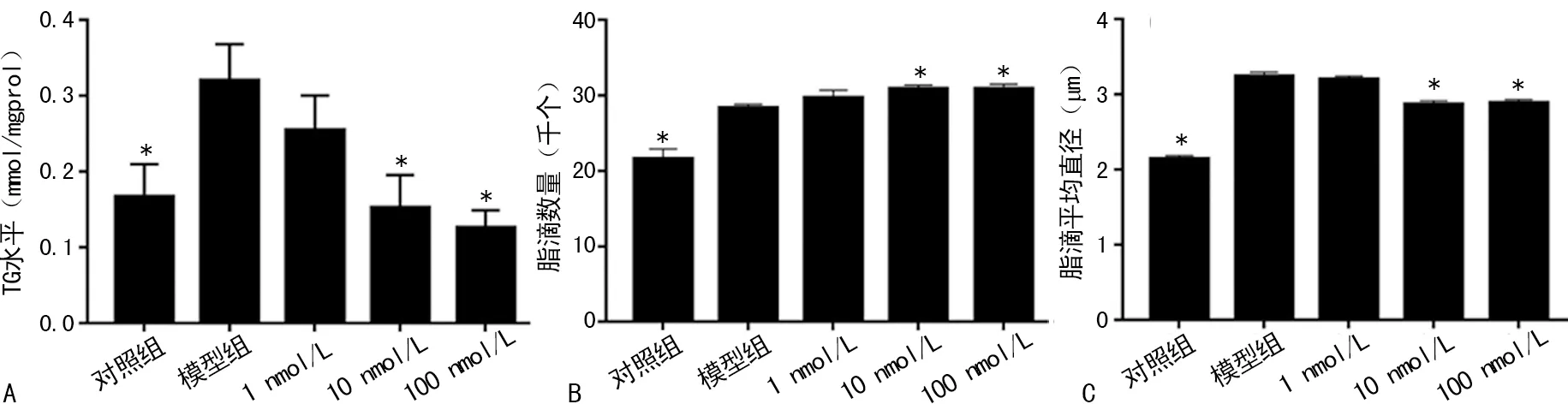
A:各组TG水平;B:各组脂滴数量;C:各组脂滴平均直径;*P<0.05,与模型组比较
图2不同浓度1,25(OH)2D3对细胞脂滴的影响
A:对照组;B:模型组;C:1 nmol/L组;D:10 nmol/L组;E:100 nmol/L组
图3各组细胞油红染色(×200)
A:PPAR-α;B:PPAR-γ;C:CIDE-a;D:CIDE-c;E:PLIN-1;F:UCP-1;*:P<0.05,与模型组比较
图4各组细胞脂滴代谢相关基因mRNA表达情况
2.2脂滴直径和计数 用不同浓度1,25(OH)2D3干预模型细胞后油红O染色结果显示,模型组脂滴数量明显多于对照组(P<0.05),脂滴平均直径大于对照组(P<0.05);与模型组相比,1 nmol/L组无论是脂滴数量还是平均直径差异均无统计学意义(P>0.05),10、100 nmol/L组脂滴数量明显增加,脂滴平均直径明显减小(P<0.05);模型组TG水平明显高于对照组(P<0.05),而10、100 nmol/L组TG水平明显低于模型组(P<0.05),见图2、3。
2.3脂滴相关基因mRNA表达情况 模型组PPAR-α mRNA表达与对照组相比差异无统计学意义(P>0.05);1,25(OH)2D3干预24 h后,高、中、低3个浓度组的PPAR-α mRNA表达均明显高于模型组(P<0.05)。PPAR-γ mRNA表达各组间差异均无统计学意义(P>0.05)。模型组CIDE-a mRNA表达明显高于对照组(P<0.05),而1 nmol/L组与模型组差异无统计学意义(P>0.05),10、100 nmol/L组CIDE-a mRNA表达明显低于模型组(P<0.05)。CIDE-c mRNA表达在对照组与模型组之间差异无统计学意义(P>0.05),1,25(OH)2D3干预后的各浓度组均明显低于模型组(P<0.05)。UCP-1 mRNA表达只在100 nmol/L组与模型组差异有统计学意义(P<0.05)。PLIN-1 mRNA表达在对照组与模型组之间差异无统计学意义(P>0.05),10、100 nmol/L组与模型组差异有统计学意义(P<0.05),见图4。
3 讨 论
脂滴是一个动态的细胞器,其核心主要是由TG和胆固醇酯构成,在表面由单层磷脂包围,脂滴作为储存能量和代谢脂肪酸及固醇的细胞器,负责大量膜结构和激素的合成。脂滴在不同的细胞中有不同的表面蛋白,它们调节着脂滴的结构和功能,其中包括PPAR家族、CIDE家族、PAT家族等。
本研究中采用300 μmol/L PA对诱导分化8 d的3T3-L1细胞进行肥大效果的模拟,虽然通过油红染色观察到细胞内形成了大量脂滴,但无论是分化后的对照组还是模型组,都没有观察到脂肪细胞典型的中央大脂滴出现。在其他学者对3T3-L1细胞成脂分化的研究中,分化后油红染色拍照的放大倍数一般在40倍甚至更小,不能观察出细胞内脂滴的形态[6-7],而BOSCHI 等[8]用与本文相同的方法对3T3-L1细胞进行成脂诱导分化,8 d后油红染色,显微放大倍数400倍的结果中并未发现中央大脂滴,对此疑问可能还需进一步研究探讨,体外研究用于诱导细胞成脂的方法可能还不够完善。通过软件对显微照片中脂滴量化后,模型组脂滴无论从数量还是平均直径上相较对照组均明显增加。1,25(OH)2D3对模型细胞进行干预后,10、100 nmol/L组脂滴平均直径相比于模型组明显降低。而对于1 nmol/L浓度的1,25(OH)2D3从油红染色的照片中并未观察到与模型组脂滴明显的形态变化。
PPARs在脂质代谢过程中的作用已经开展了大量研究[9],其中PPAR-α是调节能量代谢和脂质氧化的关键因素,在脂类代谢调节中起着枢纽作用;而PPAR-γ是脂肪细胞分化和脂肪细胞因子表达的主要调节剂,参与脂肪细胞分化和糖脂代谢的调节[10]。除PPARs近几年有关脂质合成代谢的研究发现CIDE是重要的调节蛋白,CIDE-a和CIDE-c在脂肪细胞脂滴代谢的调控中都有重要作用[11]。同时,PAT家族中PLIN-1在脂肪细胞中高度表达,并调节脂质的分解过程。本研究中,10、100 nmol/L组的PPAR-α和PLIN-1 mRNA表达明显高于模型组,而CIDE-a和CIDE-c mRNA表达相比模型组明显下降,提示10、100 nmol/L浓度1,25(OH)2D3干预可以在一定程度上抑制PA对分化后3T3-L1细胞造成的脂肪堆积作用,抑制脂滴融合,与CHANG等[2]研究中产生促进脂肪分解效果的剂量相同。该研究只在100 nmol/L组UCP-1 mRNA表达与模型组有统计学差异,提示100 nmol/L浓度1,25(OH)2D3能增加空热产生,促进脂代谢。虽然 1 nmol/L组与模型组相比脂滴变化差异无统计学意义(P>0.05),但PPAR-α mRNA表达相比模型组明显升高,CIDE-c mRNA表达明显下降,提示1 nmol/L浓度的1,25(OH)2D3浓度太低,在24 h的干预时间内还不足以对细胞脂滴的生物代谢产生明显的变化。而在JI等[12]研究中发现1 nmol/L的1,25(OH)2D3就可产生明显的效果,但还未见有用1 nmol/L浓度1,25(OH)2D3干预成脂分化后3T3-L1细胞的报道。1,25(OH)2D3干预后,尤其是10、100 nmol/L浓度,包括CIDE-a、CIDE-c、PLIN-1等均出现明显的变化,提示其可能抑制了脂质在细胞内的堆积。PPAR-γ是调节脂肪细胞脂质代谢的主要因子,主要表达在脂肪组织中,用于调节脂肪细胞的活动,脂质的代谢,应答胰岛素信号,并且与炎症相关[10],但PPAR-γ mRNA表达在所有组之间差异均无统计学意义(P>0.05),与CHANG等[2]的研究结果不一致。而BOLSONI-LOPES等[13]用200 μmol/L的棕榈油酸干预成脂分化后的3T3-L1细胞,发现棕榈油酸可以增加脂肪细胞脂质的分解,并且此过程依赖于PPAR-α的激活,而非PPAR-γ。
综上所述,本研究发现1,25(OH)2D3可以抑制PA造成的成脂分化后3T3-L1细胞的脂质堆积,10、100 nmol/L浓度效果较为明显,脂滴体积变小,数目变多,脂滴融合受抑制,脂肪降解的速度加快,导致脂肪细胞储存脂肪的能力降低。1,25(OH)2D3可能通过激活PPAR-α来起到抑制脂肪堆积的效果,而PPAR-γ可能并不参与其中。
