DAPK在人食管鳞癌组织及食管癌EC9706细胞中的表达及其对食管鳞癌转移侵袭的影响
2019-03-27贾敬周孙继伟袁五营侯智亮王文波赵正国
贾敬周,孙继伟,袁五营,侯智亮,王文波,赵正国
(1.河南省胸科医院微创外科,郑州 450000;2.河南省郑州市第七人民医院普外科 450002)
食管鳞癌是我国居民消化系统最常见的恶性肿瘤之一,其发病率和病死率仅次于肝癌、胃癌、肺癌,以侵袭性强、致死性高为临床特点,对居民健康造成严重危害[1]。虽然近年来食管癌的诊治技术有了明显提高,但依然存在生存率低、预后差等特点,因此深入研究食管鳞癌的具体转移、迁移机制尤为重要[2]。
死亡相关蛋白激酶1(DAPK)是一种丝氨酸/苏氨酸蛋白激酶,广泛参与机体多种病理生理过程,并在多种癌组织中异常表达,研究发现DAPK在非小细胞肺癌肺组织中的阳性表达率为34.7%,明显低于癌旁正常肺组织的82.6%[3]。近年来不断有研究发现DAPK在一系列癌细胞迁移中具有重要调节作用,可促进细胞凋亡,并已被证实在多种实体瘤及其细胞系中DAPK的表达缺失与肿瘤侵袭有关[4],但未见DAPK在人食管鳞癌组织及食管癌EC9706细胞中表达的相关报道。因此,本研究通过人食管鳞癌组织样本及人食管癌EC9706细胞检测DAPK的表达,探讨其与食管癌的关系,进一步研究DAPK过表达对食管鳞癌细胞转移侵袭的作用,旨在为食管癌的临床治疗及预后提供新的思路和寻找新的靶点。
1 材料与方法
1.1材料
1.1.1组织标本与细胞 人食管鳞癌组织及癌旁正常组织(距癌变组织3 cm以上并经组织病理学诊断无癌变)标本各20例,均为河南省胸科医院微创外科及胸外科2016年5月至2017年6月的手术病理切除冻存标本,其组织学类型均为食管鳞癌。其中男12例,女8例,年龄45~72岁,平均(55.26±10.28)岁,患者术前均未行放疗及化疗。人食管癌细胞株EC9706细胞由中国医科大学细胞生物研究中心提供。
1.1.2仪器与试剂 10%胎牛血清、胰蛋白酶、青链霉素、IMDM培养液均购自美国Gibco公司;Transwell小室购自美国Corning公司;鼠抗人DAPK单克隆抗体、鼠抗人β-actin单克隆抗体及兔抗小鼠二抗购自美国Sigma Aldrich公司;脂质体LipofectamineTM2000购自美国Invitrogen公司,pReceiver-M29-DAPK质粒和pReceiver-M29质粒购自广州复能生物技术有限公司;BCA蛋白分析试剂盒购自美国Pierce公司;RT-PCR试剂盒和逆转录试剂盒均购自日本Takara公司;倒置荧光显微镜购自日本Nikon公司;MK3型酶标仪和PCR仪购自美国Bio-Rad公司;HER Acell型CO2细胞培养箱购自美国Sim公司。
1.2方法
1.2.1免疫组织化学法检测人食管鳞癌组织及癌旁正常组织中DAPK的表达 所有组织标本均由病理科经10%福尔马林固定,石蜡包埋后保存。每组随机选取10个标本,每个标本取3张切片,按照免疫组织化学S-P法染色[5],采用柠檬酸盐缓冲液(0.01 mol/L)高温高压抗原修复,常规透膜,5% BSA室温封闭1 h,滴加DAPK鼠抗人多克隆抗体(1∶250)4 ℃过夜,生物素标记的二抗(1∶1 000) 37 ℃孵育1 h,DAB显色,自来水冲洗终止,苏木精复染后脱水、封片。每张切片随机选取3个视野,用光学显微镜测定观察区域阳性细胞数,并分级计算阳性率。阳性标准:细胞质或细胞核出现棕褐色颗粒。分级标准:阴性(-),阳性细胞少于10%;弱阳性(+),阳性细胞11%~50%;强阳性(++),阳性细胞超过50%。阳性率=(弱阳性数+强阳性数)/总数×100%。
1.2.2细胞培养 将EC9706细胞复苏后转移至IMDM培养基中,置于37 ℃、5%CO2环境中培养并进行传代,取2~3次传代后的细胞用于实验。将处于对数生长期的细胞转移至6孔板中,密度为8×105个/孔,保证转染时细胞密度为80%~90%。
1.2.3细胞转染及转染复合物的制备 将培养好的EC9706细胞接种于6孔板内,每孔1 500 μL细胞悬液;取250 μL Opti-MEMI无血清培养基用于稀释4.0 μg pReceiver-M29-DAPK质粒(转染组);另取250 μL Opti-MEMI无血清培养基用于稀释10 μL的LipofectamineTM2000;将以上两种稀释的液体混匀并于室温放置20 min,取500 μL依次加入培养好的EC9706细胞内。置于37 ℃培养箱中继续培养48 h后收集细胞用于后续实验。空载脂质体pReceiver-M29(空白转染组)转染条件同转染组,并以未转染的EC9706细胞为对照组。
1.2.4Western blot检测DAPK蛋白的表达 提取上述各组转染前后的EC9706细胞总蛋白,变性后每孔50 μg进行SDS-PAGE电泳,然后电转移至PVDF膜上,用含有5%脱脂牛奶的0.1%TBS-T室温封闭2 h,加一抗4 ℃孵育过夜,TBS-T洗膜10 min×5次,加HRP连接的兔抗鼠IgG 4 ℃振摇孵育1 h,TBS-T洗膜10 min×5次,用新鲜配制的DAB显色液显色,成像[6]。
1.2.5划痕修复实验检测EC9706细胞迁移能力 取100 μL上述培养好的EC9706细胞接种于6孔板中,待各组细胞单层生长铺满板底时,用移液枪头沿培养板底部划“一”字型划痕。各组EC9706细胞于37 ℃、饱和湿度及5% CO2环境下培养24 h。光学显微镜下观察各组EC9706细胞向致伤区迁移的相对距离并拍照,随后计算EC9706细胞迁移率[7],细胞迁移率=转染组细胞迁移面积/空白组细胞迁移面积×100%。
1.2.6Transwell小室侵袭实验检测EC9706细胞侵袭能力 Transwell 小室使用前铺上10 μL的0.5% Matrigel 膜基质并于37 ℃孵育过夜。分别取200 μL上述培养好的EC9706细胞悬液接种于Transwell 小室上室,并在Transwell小室下室加入600 μL含有20%胎牛血清的RPMI 1640培养液。随后各组EC9706细胞于37 ℃、饱和湿度及5% CO2环境下孵育培养24 h后取出Transwell小室,擦去上室内细胞,用0.1%结晶紫染色,转用33%醋酸溶液洗脱,在Leica DC300F显微镜下随机选取3个视野观察并拍照,计算细胞计数[8]。同样的步骤重复3次并取其均值。

2 结 果
2.1人食管鳞癌组织及癌旁组织中DAPK的表达 人食管鳞癌组织DAPK的阳性率为90.0%,明显高于癌旁正常组织的13.3%(P<0.05),见表1;在人食管鳞癌组织中DAPK的阳性区域面积明显高于癌旁正常组织(P<0.05),见图1。
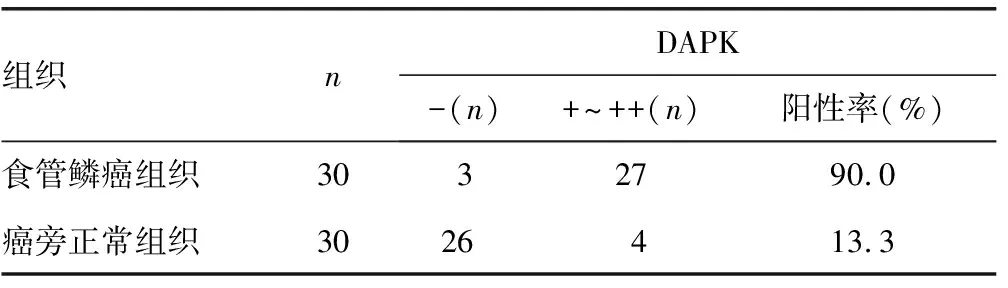
表1 DAPK在人食管鳞癌组织及癌旁正常组织中的表达
2.2DAPK在EC9706细胞中的表达 蛋白印迹法(Western blot)显示,在对照组和空白转染组中未见明显DAPK蛋白表达,DAPK蛋白在转染pReceiver-M29-DAPK的EC9706细胞中高表达,见图2。
2.3DAPK对EC9706细胞迁移能力的影响 与对照组细胞迁移率(36.42±8.52)%比较,转染组细胞迁移率(83.26±8.42)%明显升高(P<0.01),空白转染组细胞迁移率(43.45±11.56)%无明显变化(P>0.05),见图3。
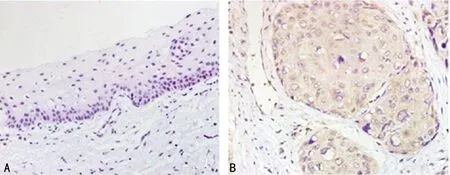
A:癌旁正常组织;B:食管鳞癌组织
图1 DAPK在人食管鳞癌组织及癌旁正常组织中的表达(×400)

1:对照组;2:空白转染组;3:转染组
图2转染前后EC9706细胞DAPK蛋白的表达

A:对照组;B:空白转染组;C:转染组
图3 DAPK对EC9706细胞划痕修复的影响(×100)
2.4DAPK对EC9706细胞侵袭能力的影响 与对照组侵袭细胞数(50.2±4.3)个比较,转染组侵袭细胞数(162.6±4.8)个明显升高(P<0.01),空白转染组侵袭细胞数(46.45±7.5)个无明显变化(P>0.05),见图4。

A:对照组;B:空白转染组;C:转染组
图4 DAPK对EC9706细胞体外侵袭的影响(×100)
3 讨 论
食管癌是世界上第八大常见癌症,也是导致因癌症死亡的第六大诱因,近年来估计每年有456 000例新发病例和400 000例死亡病例[9]。根据中国最新的癌症统计数据,食管癌的病死率在男性中位居第三,女性中位居第五,呈逐年升高趋势。食管癌可分为食管鳞癌和食管腺癌,它们是组织病理学、流行病学和分子学完全不同的两种亚型[10]。食管鳞癌占全球食管癌病例的90%左右,而食管鳞癌患者的5年生存率尽管在过去10年有所改善,但仍然普遍较差。许多患者在诊断时表现出淋巴结转移和肿瘤侵袭邻近器官,缺乏有效的化疗方法用于治疗食管鳞癌患者[11]。因此,对食管癌致病机制需要进一步研究探讨,以便为患者寻求更佳的治疗手段。
DAPK是一类丝氨酸/苏氨酸激酶,广泛参与调节多种细胞生命过程,如凋亡、自噬、细胞迁移等。DAPK在Ser308上磷酸化从而抑制了其在该位点的催化活性和去磷酸化,这也是DAPK被活化的重要标志。DAPK及其相关信号通路广泛参与多种疾病,如癌症、中风、炎症和动脉粥样硬化等[12]。
DAPK的功能在多种疾病中均受不同程度的影响。与p53等基因不同,DAPK在癌症中的功能障碍通常是由于表达丧失而不是突变。DAPK表达缺失主要是由DAPK基因50UTR处的高甲基化引起的,尽管频率不高也可能是纯合缺失的结果[13]。在30多种癌症中发现了DAPK基因甲基化,非小细胞肺癌的原发性组织和细胞系中DAPK蛋白仍然可以在高甲基化存在下表达。在其他如肾细胞癌和慢性淋巴细胞白血病中这种甲基化状态也与蛋白质表达的错误相关,这表明DAPK的翻译后调节在某些癌症类型中尤为重要[14]。
1995年首次发现DAPK是干扰素-c(IFN-c)诱导人宫颈癌细胞凋亡的介质[15]。后来研究表明,DAPK-/-小鼠的胚胎成纤维细胞(MEF)由于p19ARF-p53途径无法被激活而显示出无法对癌基因如c-myc和E2F的过度表达的凋亡响应;同时在Lewis肺癌细胞中,高度分化转移的细胞增加了DAPK的表达,并且在这些细胞减少了DAPK的表达后便抑制了它们在小鼠肺部转移迁移的能力[16]。以上研究结果均表明DAPK对于抑制早期癌症发展中的细胞转化和晚期癌症转移是非常重要的。本研究证明,人食管鳞癌组织DAPK的阳性率及阳性区域面积明显高于癌旁正常组织,同时在转染后的EC9706细胞中同样高表达,并且转染后的EC9706细胞细胞迁移率及细胞侵袭数目明显升高,这与上述文献研究结果一致并表明在食管鳞癌组织中DAPK亦呈现高表达。
综上所述,本实验证实了人食管鳞癌组织中DAPK的高表达,DAPK能促进食管鳞癌细胞的转移和侵袭。这表明DAPK同样参与食管癌组织的病理生理过程,同时调节DAPK的异常表达将可能为食管癌的临床治疗及预后提供新的思路和寻找新的靶点。
